恩度联合奈达铂治疗晚期食道癌临床评价*
孟新源,汤旭山,李俊杰
(新疆医科大学附属肿瘤医院,新疆 乌鲁木齐 830000)
胰岛素样生长因子-1(IGF-1)对肿瘤发生、发展的影响较大,其通过与胰岛素样生长因子- 1 受体(IGF-1R)结合后促进肿瘤细胞恶性分裂增殖,并抑制肿瘤细胞的凋亡[1-2]。同时,转化生长因子-β1(TGFβ1)、γ-干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)影响患者的细胞生物学行为,不仅促进血管内皮细胞的分裂、增殖,还加快细胞的黏附,促进细胞浸润[3]。恩度(重组人血管内皮抑制素)是我国自主创新药物,可通过调控血清因子分泌量,抑制新生内皮细胞迁移并加速其凋亡[4]。基于此,本研究中探讨了恩度联合奈达铂化学药物治疗(简称化疗)治疗晚期食道癌的临床疗效。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:有可测量的肿瘤病灶,并符合国际抗癌联盟(UICC)肿瘤TNM 分期Ⅲb~Ⅳ期标准;预计生存时间> 6 个月,卡氏生活质量(KPS)评分> 60 分;肝肾功能正常且无器质性神经系统疾病。本研究经医院医学伦理委员会研究批准,患者签署知情同意书。
排除标准:妊娠期或哺乳期;神经系统疾病;存在相关药物过敏史。
病例选择与分组:选取医院2019年3月至2020年6月确诊的晚期食道癌患者96例,按随机数字表法分为试验组和对照组,各48例。对照组患者男26例,女22例;年龄41~72岁,平均(52.46±6.71)岁。试验组患者男25例,女23 例;年龄41~73 岁,平均(52.24 ± 6.82)岁。两组患者一般资料比较,差异无统计学意义(P> 0.05),具有可比性。
1.2 方法
两组患者均予注射用奈达铂(南京先声东元制药有限公司,国药准字H20030884,规格为每支10 mg)60 mg/m2静脉滴注,每个疗程1 次。试验组患者加用重组人血管内皮抑制素注射液(恩度,山东先声麦得津生物制药有限公司,国药准字S20050088,规格为每支15 mg∶3 mL)15 mg,加入0.9%氯化钠注射液500 mL 静脉滴注,对照组患者加用氟尿嘧啶注射液(上海旭东海普药业有限公司,国药准字H31020593,规格为每支10 mL∶0.25 g)120 mg/m2,加入0.9%氯化钠注射液500 mL 静脉滴注。两组患者均以连续7 d,停药2 周,为1 个疗程,连续治疗2个疗程。
1.3 观察指标与疗效判定标准
观察指标:采集患者治疗前、治疗2 个疗程后的桡动脉血5 mL,5 000 r/min离心10 min,分离,得血清,置-20 ℃冰箱保存。采用酶联免疫吸附(ELISA)法测定血清中IFN-γ,TNF-α,TGF-β1水平;采用放射免疫法测定IGF-1水平。操作严格执行说明书步骤;参照KPS评分法[5]评估患者健康状况,满分100分,得分越高表明生存质量及体力状况越好。
疗效判定[6]:1)近期疗效。完全缓解,临床症状和生命体征稳定,病灶完全消失,无肿瘤体征超过1个月;部分缓解,临床症状和生命体征基本稳定,病灶部分消失,1 个月内未发现新病灶;稳定,生命体征改变,病灶大小无变化;恶化,出现新病灶或病灶变大。总有效=部分缓解+稳定+完全缓解。2)远期疗效。随访记录患者的1年生存率。
安全性:观察患者治疗期间肝功能损伤、恶心呕吐、白细胞减少、肾功能损伤、血小板减少等不良反应发生情况。
1.4 统计学处理
采用SPSS 18.0 统计学软件分析。计量资料以±s表示,行t检验;计数资料以率(%)表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
结果见表1至表4。

表1 两组患者临床疗效比较[例(%),n=48]Tab.1 Comparison of clinical efficacy between the two groups[case(%),n=48]

表2 两组患者预后效果比较(n=48)Tab.2 Comparison of prognosis between the two groups(n=48)
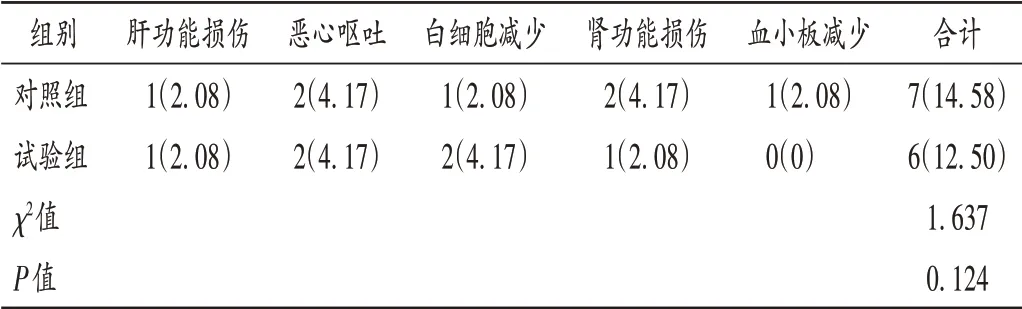
表3 两组患者不良反应发生情况比较[例(%),n=48]Tab.3 Comparison of incidence of adverse reactions between the two groups[case(%),n=48]
表4 两组患者血清因子水平比较(±s,n=48)Tab.4 Comparison of serum factor levels between the two groups(±s,n=48)
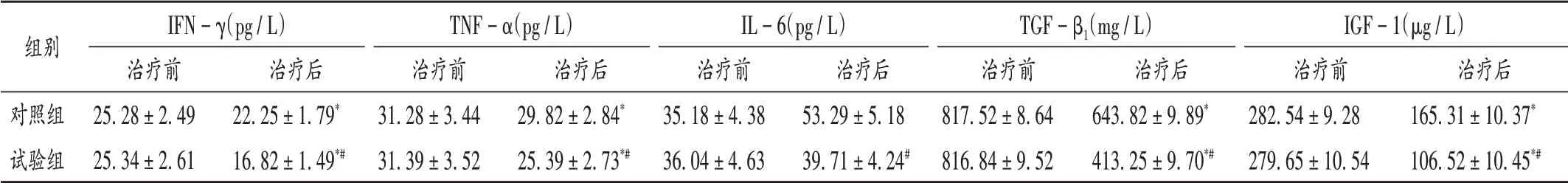
表4 两组患者血清因子水平比较(±s,n=48)Tab.4 Comparison of serum factor levels between the two groups(±s,n=48)
注:与本组治疗前比较,*P < 0.05;与对照组治疗后比较,#P < 0.05。Note:Compared with those before treatment,*P < 0.05;Compared with those in the control group,#P < 0.05.
组别对照组试验组IFN-γ(pg/L)治疗前25.28±2.49 25.34±2.61治疗后22.25±1.79*16.82±1.49*#TNF-α(pg/L)治疗前31.28±3.44 31.39±3.52治疗后29.82±2.84*25.39±2.73*#IL-6(pg/L)治疗前35.18±4.38 36.04±4.63治疗后53.29±5.18 39.71±4.24#TGF-β1(mg/L)治疗前817.52±8.64 816.84±9.52治疗后643.82±9.89*413.25±9.70*#IGF-1(μg/L)治疗前282.54±9.28 279.65±10.54治疗后165.31±10.37*106.52±10.45*#
3 讨论
食道癌是食管上皮组织上发生恶性肿瘤,与长期吸烟、嗜饮烈酒、饮食过硬、过热有关等因素有关[7]。大部分患者确诊时已处于晚期,错失了手术治疗的最佳时机,临床方案常采用化疗治疗方案。虽然单纯化疗能在短时间内缓解患者的病情,但仍存在较高的复发率及局部未控制率[8]。随着医疗技术的发展,新的化学治疗药物和临床化疗方案提出,改善了晚期食道癌患者的疗效。化疗药物的使用会改变机体的血清因子水平,导致产生免疫抑制。在正常生理条件下,辅助性T 细胞(Th)1 细胞分泌IFN-γ、TNF-α 细胞因子,Th2 细胞分泌IL - 6 细胞因子,Th1/Th2 细胞保持动态平衡,当食道癌患者发生病变时,正常的免疫应答被破坏,进而影响血清IFN-γ,TNF-α,IL-6的分泌[9]。
奈达铂进入细胞后,甘醇酸脂配基上的活性氧和铂之间的键断裂,铂与水分子结合,形成离子型化合物。断裂的甘醇酸酯基由于不稳定性而被释放,产生多种离子型化合物,与DNA 结合并抑制DNA 的复制和转录,从而产生抗癌活性[10]。恩度可通过调节肿瘤细胞蛋白水解酶的活性及表皮血管内皮生长因子的表达,发挥多靶点抗血管生成,间接起到使肿瘤细胞休眠的作用[11]。有研究证明,恩度与奈达铂共同用药具有协同作用[12]。肿瘤的发生、发展受IGF-1 的影响较大,其通过与受体IGF - 1R 结合后促进肿瘤细胞恶性分裂增殖,并抑制肿瘤细胞的凋亡[13]。IGF - 1 刺激DNA 和RNA的合成,抑制细胞有丝分裂,尤其对骨骼肌细胞的生长及细胞的增殖具有重要作用。TGF-β1是一类多功能的细胞因子,参与机体的多种病理过程[14]。TGF-β1通过调控细胞周期、抑制细胞增殖及加速细胞凋亡等延缓细胞增殖速度。在食管癌的发生、发展过程中,肿瘤细胞会抑制血液供应而导致局部缺氧以及感染等因素,刺激IGF-1 和TGF-β1的大量表达,过量的IGF-1 可进一步刺激TGF - β1的合成,从而扩大或加速肿瘤新生血管的形成[15]。同时,IGF-1通过促进P38有丝分裂激活蛋白激酶和P125 局部黏附激酶的磷酸化,刺激内皮细胞形态分化,诱导肿瘤细胞形成[16]。
本研究结果显示,试验组的总有效率明显高于对照组。治疗后,两组患者的IFN - γ,TNF - α,TGF - β1及IGF-1 血清因子水平明显降低,且试验组明显低于对照组,说明采用恩度联合奈达铂治疗患者的免疫系统抑制情况较轻,恩度治疗患者的淋巴细胞能修复损伤DNA,增强患者的免疫功能。随访1年后,试验组患者的生存率和KPS 评分均明显高于对照组。恩度联合奈达铂可有效抑制肿瘤细胞血管形成,阻断其血液供应,进而影响其能量和物质交换,可明显改善疗效。但由于随访时间较短,远期疗效还需进一步观察。
综上所述,恩度联合奈达铂治疗晚期食道癌能改善患者血清因子水平,提高1年生存率。

