乙肝扶正胶囊微生物限度计数法的建立及微生物鉴定
姬 俊,王立云,牛萌萌,朱世真,王尊文
(1.山东省青岛市食品药品检验研究院·海洋中药质量研究与评价重点实验室,山东 青岛 266073; 2.山东省青岛市妇女儿童医院,山东 青岛 266034)
乙肝扶正胶囊由何首乌、虎杖、贯众、肉桂等11 味中药组方,临床用于治疗乙型肝炎。现行标准收录于《卫生部药品标准·中药成方制剂(第一册)》,目前国内有109家医药生产企业持有该药的批准文号。含药材原粉的中药制剂因处方中多有以原粉形式直接入药的药味,可能存在微生物污染等问题[1-2],若为致病菌污染,则药品存在较大安全隐患,乙肝扶正胶囊处方中当归、肉桂、丹参等中药均为原粉入药。故本研究中参考2020年版《中国药典(四部)》通则1105方法对乙肝扶正胶囊进行微生物限度计数方法研究,并按适用性试验建立的方法对4家医药生产企业84件共计11个批号的产品进行微生物限度检查。检出的污染微生物依据2020 年版《中国药典(四部)》通则9204“微生物鉴定指导原则”,采用16SrDNA 测序、核糖体鉴定和特异性引物聚合酶链式反应(PCR)等方法进行鉴定,分析污染微生物对该制剂质量的影响程度。现报道如下。
1 材料与方法
1.1 仪器、试药与菌种
仪器:INE500型电热恒温培养箱(德国Memmert公司);ARKTIK 型PCR 仪(美国Thermo Fisher Scientific 公司);电泳仪、电泳槽(北京六一仪器厂);化学发光成像仪(法国Vilber Lourmat 公司);RiboPrinter®全自动微生物指纹分型系统(美国Dupond 公司);BX53 型显微镜(日本Olympus公司)。
试药:乙肝扶正胶囊(企业A,批号分别为160201,170601,170602,170901;企业B,批号分别为20170601,20180101;企业C,批号分别为20160301,20160302,20170501;企业D,批号分别为170201,171102);细菌基因组DNA 提取试剂盒、2×Pfu PCR 预混试剂(北京天根生化科技有限公司);GelGreen Nucleic Acid Stain(美国Biotium 公司);50 × TAE 缓冲液(北京酷来搏科技有限公司);革兰染色液试剂盒(青岛高科园海博生物技术有限公司);胰酪大豆胨琼脂培养基(批号为3105660)、胰酪大豆胨液体培养基(批号为3105589)、沙氏葡萄糖琼脂培养基(批号为3104045),均购自广东环凯生物科技有限公司。
菌种:金黄色葡萄球菌[Staphylococcus aureus,CMCC(B)26003]、铜绿假单胞菌[Pseudomonas aerugi⁃nosa,CMCC(B)10104]、枯草芽孢杆菌[Bacillus subtilis,CMCC(B)63501]、白色念珠菌[Candida albicans,CMCC(F)98001]、黑曲霉[Aspergillus niger,CMCC(F)98003],均购自中国食品药品检定研究院。
1.2 方法
1.2.1 菌液制备
按2020 年版《中国药典(四部)》通则及有关文献[3]方法制备菌液。
1.2.2 计数方法适用性试验
采用2020 年版《中国药典(四部)》通则1105“非无菌产品微生物限度检查:微生物计数法”。取样品10 g,加胰酪大豆胨液体培养基稀释至100 mL,制成1∶10(m/V)供试液,再用胰酪大豆胨液体培养基稀释成1∶100(m/V)供试液。试验分为试验组、菌液对照组、供试品对照组。试验组,取不同稀释度的供试液,每份9.9 mL,移至无菌试管中,分别加入1.2.1 项下菌液0.1 mL 制成供试液与菌液混合物,混匀,使每份供试液中的菌含量不超过100 cfu/mL;取1 mL,注入平皿中,平行制备2 个平皿,分别倾注熔化的胰酪大豆胨琼脂培养基或沙氏葡萄糖琼脂培养基。菌液对照组,以胰酪大豆胨液体培养基代替供试液,其余均按试验组项下方法操作。供试品对照组,以胰酪大豆胨液体培养基代替菌液,其余均按试验组项下方法操作。将3 个组的平皿置32.5 ℃培养箱中培养,逐日计数。微生物计数回收比值=(试验组菌落数-供试品对照组菌落数)/菌液对照组菌落数,应在0.5~2范围内。
1.2.3 污染菌分离和革兰染色镜检
从1.2.2 项下检出菌的供试品平皿上,挑取11 种污染菌的菌落,划线接种于TSA 平皿,置32.5℃培养箱中培养24 h。对纯化菌进行革兰染色,显微镜下观察。
1.2.4 微生物污染情况分析
采用PCR 法。取1.2.3 项下11 种污染菌,提取其DNA,并以总DNA为模板,分别进行16SrDNA 和巨大芽孢杆菌DNA 的PCR 扩增。16SrDNA 的引物为,27F:5'-AGAGTTTGATCCTGGCTCAG - 3',1492R:5' - TACG‑GCTACCTTGTTACGACTT - 3';巨大芽孢杆菌的引物为,BML257:5' - TGATGATAATCGGGAACT - 3' ,BMR700:5'-TGAATGATGCTCGTAATG- 3'[4]。16SrD‑NA 的PCR 反应体系为,模板1 μL,引物各1 μL,2×Pfu PCR预混试剂10 μL,ddH2O 7 μL;巨大芽孢杆菌的PCR反应体系为:模板2 μL,引物各1 μL,2× Pfu PCR 预混试剂10 μL,ddH2O 6 μL。16SrDNA 的PCR 扩增条件为,94 ℃4 min;94 ℃45 s,55 ℃45 s,72 ℃1 min,30 个循环;4 ℃10 min。巨大芽孢杆菌的扩增条件为,94 ℃3 min,94 ℃40 s,55.5 ℃40 s,72 ℃25 s,30 个循环;4 ℃10 min。16SrDNA 的PCR 产物由生工生物工程股份有限公司测序,所得结果与GenBank 数据库中的序列进行比对,再用Mega 5.0 软件构建系统发育树;用2%琼脂糖凝胶电泳检测巨大芽孢杆菌的PCR产物大小。
采用核糖体鉴定。从培养皿中挑取纯化的菌落,加热灭活后,进行RiboPrinter 全自动微生物基因指纹鉴定。
2 结果
2.1 微生物计数检查
对4家企业产品分别进行计数方法适用性试验,其中企业A和B需氧菌总数计数方法为平皿法(1∶10供试液,1 mL/皿),企业C 和D 的需氧菌总数计数方法为平皿法(1∶100 供试液,1 mL/皿);4 家企业霉菌和酵母菌总数计数方法均为平皿法(1∶10 供试液,1 mL/皿)。详见表1(表中*表示所得数据为胰酪大豆胨琼脂培养基/沙氏葡萄糖琼脂培养基上的回收比值)。所有样品检查结果均符合规定。

表1 微生物计数方法适用性试验结果Tab.1 Results of the applicability test of the microbial enumeration tests
本次抽取的84 件检品,共涉及11 批次,抽样地区分布于26 个省、自治区、直辖市,每家企业抽取的检品次数、批号数和抽样地区数见表2。检出需氧菌集中于批号171102样品,本次共抽取该批次15件,其中7件检出需氧菌,检出菌落数和抽样地区分布情况见表3,其中“检出需氧菌菌落数”为用于需氧菌计数的2 个平行平皿的菌落数之和;因为企业D 需氧菌计数是以1∶100供试液采取平皿法进行试验,报告需氧菌总数= 检出需氧菌菌落数/2×100。
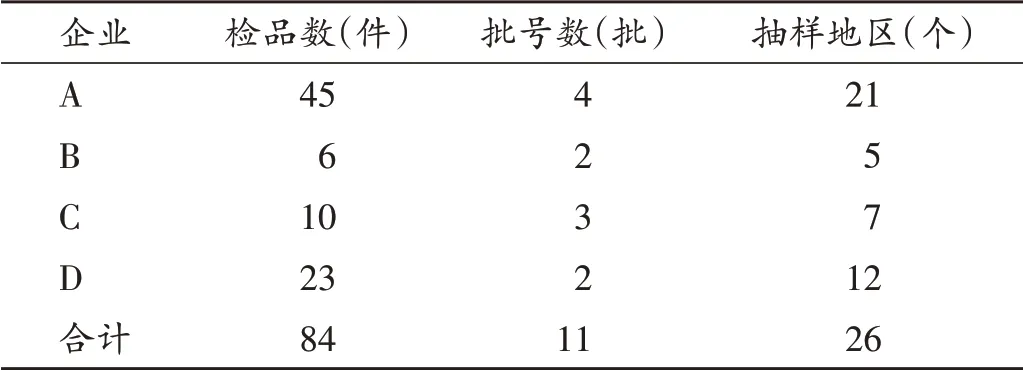
表2 4家企业抽样情况及地区数量Tab.2 Sampling conditions of four manufacturers and number of sampling areas involved
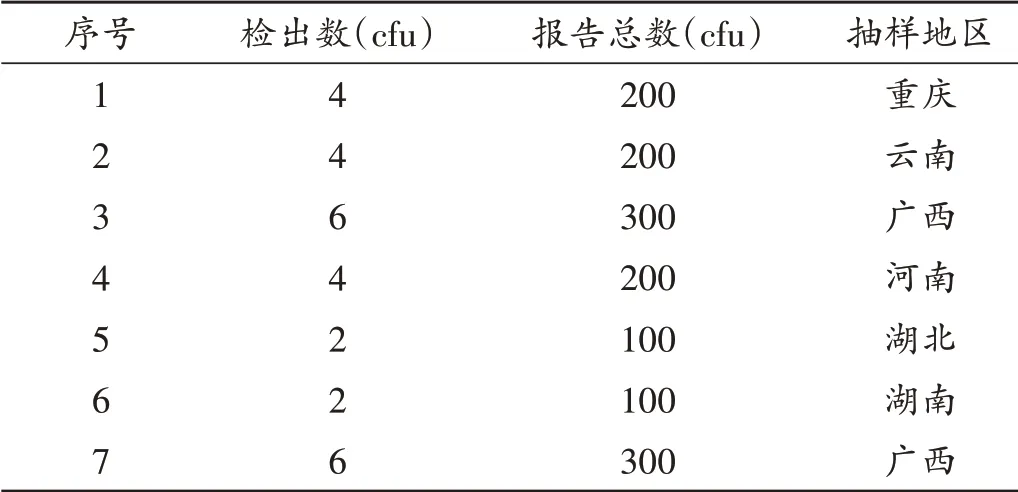
表3 企业D 7件检出污染菌样品的需氧菌菌落情况及抽样地区分布Tab.3 The total number of aerobic bacteria of seven samples which detected contaminant bacteria in manufacturer D and distribution of their sampling areas
2.2 16SrDNA 的系统发育分析及镜检结果
将11种污染菌的16SrDNA PCR扩增序列与GenBank数据库中的序列进行比对,以同源性较高的已知序列作为参考,构建系统发育树(见图1)。可见,形态相似、呈粗大杆状的YGFZ - 1~7 为巨大芽孢杆菌(Bacillus megaterium);YGFZ - 9 和YGFZ - 10 为枯草芽孢杆菌(Bacillus subtilis),YGFZ - 8 和YGFZ - 11 为短小芽孢杆菌(Bacillus pumilus)。16SrDNA 的系统发育分析将这11 种污染菌分为3 类,革兰染色后显微镜(见图2,以3 株菌为代表)下也观察到3 种形态,并且2 种检验方式的结果相对应。
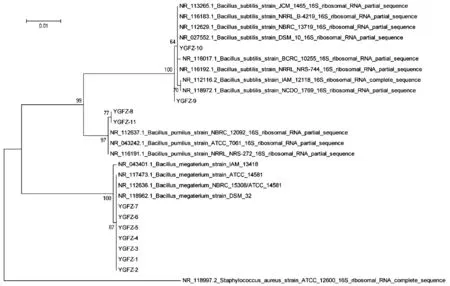
图1 污染菌16SrDNA基因序列的系统发育分析图Fig.1 Phylogenetic analysis of 16SrDNA gene sequence of contaminant bacteria
2.3 核糖体鉴定
11 种污染菌基因指纹鉴定结果见表4。7 株巨大芽孢杆菌选取其中的YGFZ - 3 进行鉴定,结果为巨大芽孢杆菌,相似度为0.75。YGFZ - 9、YGFZ - 10 为枯草芽孢杆菌,YGFZ - 8、YGFZ - 11 为短小芽孢杆菌,相似度均大于0.85,与16SrDNA 的系统发育分析一致。

表4 RiboPrinter鉴定结果Tab.4 Results of the identification by RiboPrinter

A.YGFZ-3 B.YGFZ-8 C.YGFZ-10图2 YGFZ-3,8,10菌株的革兰染色显微图A.YGFZ-3 B.YGFZ-8 C.YGFZ-10Fig.2 Microscopic photograph of Gram-staining of YGFZ-3,8,10
2.4 巨大芽孢杆菌特异性引物PCR 结果
巨大芽孢杆菌的核糖体鉴定与系统数据库比较,相似度小于0.85,为进一步确认,用其特异性引物BML257/ BMR700 进行PCR 扩增。琼脂糖凝胶电泳图见图3,片段长度与目标片段长度(443 bp)相符。结合菌落形态、16SrDNA 系统发育分析和核糖体鉴定的结果,确定污染菌YGFZ-1~7为巨大芽孢杆菌。
3 讨论
药品抽验的目的是对上市后药品质量进行监测和综合评价,为药品监管工作提供技术支持。自2014 年以来,国家药品评价抽验开设专项,对存在的风险和问题进行针对性和探索性研究,全面分析药品质量[5]。近年来多家微生物检测实验室综合运用表型鉴定、基因型鉴定手段,包括VITEK 2 COMPACT 全自动微生物生化鉴定系统、RiboPrinter®核糖体鉴定系统、MALDITOF - MS 技术和16SrDNA 测序等,对国家药品评价样品检出的微生物进行鉴定、溯源,并发现有害或致病微生物[6-7]。本次菌种鉴定根据实验室的条件和仪器,首先运用16SrDNA 的基因测序和系统发育分析,初步确定污染菌种类,进一步采用核糖体鉴定,并用特异性引物PCR 扩增的方法对核糖体鉴定相似度低的菌进行再确认。多种检测方式的综合运用,提高了鉴定结果的准确性和可信度,为菌种溯源提供有效参考,也为潜在危害性微生物的检测和鉴定提供了可行方案。
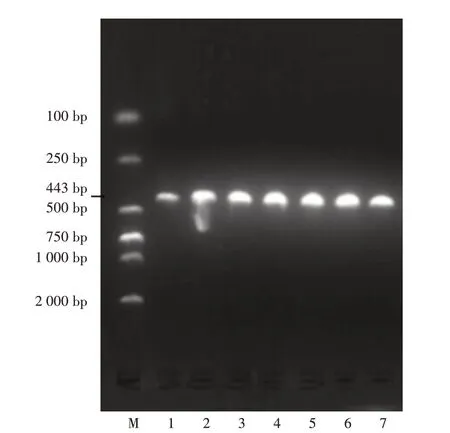
M.Marker 1-7.YGFZ-1~7图3 巨大芽孢杆菌特异性引物PCR结果N.Marker 1-7.YGFZ-1-7Fig.3 Results of PCR with specific primers of Bacillus megaterium
检出污染菌的7件样品均属同一企业同一批次,分别抽取于6 个不同的省、自治区、直辖市,其中1 个位于长江以北,2 个位于长江流域,3 个位于长江以南。本次分离的污染菌经鉴定均属芽孢杆菌属,并未呈现显著地域特性,且检验时包装完整、干净,因此分析污染菌的来源与流通环节的储存条件无关。本次抽取企业D的2 批次样品,分别于2 月和11 月生产,其中11 月的产品检出污染菌,因检验批次较少,无法分析出与生产季节的相关性。因此,分析污染菌可能主要源于以下生产环节:1)原材料,芽孢杆菌是土壤的优势种群之一,也是中药饮片耐热菌的主要来源[8-9],乙肝扶正胶囊处方中多味药材是原粉直接入药,易引入芽孢杆菌;2)工作人员或生产环境中引入,因仅部分批次检出污染菌,而芽孢杆菌广泛存在于自然界中,如果消毒、灭菌不到位,也易引入污染。
药品生产中常用的灭菌法有辐照灭菌法、高压灭菌法等,其中辐照灭菌法是中药原粉制剂的主流灭菌手段[5]。虽然辐照灭菌的效果较好,大部分微生物经60Co - γ 辐照后被杀灭,少部分微生物处于缺损状态,由于中药制剂含有适宜微生物生长的多种营养成分,一段时间后,部分微生物又能重新繁殖[10]。若辐照剂量不合适,会改变中药材化学成分含量,降低药品的有效性[11-13],并且辐照的残留对患者也造成安全隐患。因此,对药品尤其是含药材原粉中药制剂的微生物控制不能仅靠最终的辐照灭菌和限度检查,而应在整个生产过程中,严格按工艺流程要求和生产管理规范,对原料、环境、人员等各环节进行微生物检测监控,从而保证产品质量。
综上所述,4 家生产企业84 件11 批次的乙肝扶正胶囊微生物计数检查结果均符合规定,污染的微生物为芽孢杆菌,是原材料及生产环境中的常见菌,均为非致病菌。分析污染微生物的来源,可为该制剂或相关中成药的风险评估提供参考。

