有氧运动联合白藜芦醇通过Nrf2/ARE信号通路抗血管性痴呆大鼠海马氧化损伤
黎轶 王景振 刘瑞莲 (宜春学院体育学院,江西 宜春 336000)
血管性痴呆(VD)是由一系列脑血管病变导致的脑组织损害引起的以认知功能障碍为特征的综合性痴呆疾病〔1〕,由于脑血管因素如缺血性脑卒中、出血性脑卒中导致的脑组织损伤,进而损害相应部位的神经元,影响脑组织中的病理及生理变化,造成记忆力、认知能力和行为习惯等方面出现严重的认知功能障碍〔2,3〕。VD的发病机制比较复杂,至今尚未完全阐明,从国内外的研究报道来看,尚缺乏对控制本疾病进程的理想防治方法。而现有的VD治疗主要集中于脑卒中的预防、认知功能的改善及行为控制和精神症状、血管扩张和脑血流量改善、脂质过氧化反应减轻及对脑血管和神经的保护等〔4〕;药物的使用也主要倾向于神经递质调节剂、脑循环改善药物、自由基清除剂等。从对VD的发病机制方面的研究来看,其发病可能与以下因素有关:中枢胆碱能系统功能障碍、中枢RNA和蛋白质合成减少、局部炎症反应、氧自由基损伤及机体免疫异常等〔5,6〕。白藜芦醇最早发现于法国的红葡萄酒,相关研究表明,红葡萄酒所具有的保护血管、预防冠心病的主要作用来源于白藜芦醇,近年来的研究也显示,白藜芦醇具有显著的抗炎〔7〕、抗氧化和抗血小板凝集等作用〔8,9〕。本研究旨在探讨有氧运动联合白藜芦醇通过核因子E2相关因子/抗氧化反应元件(Nrf2/ARE)信号通路抗VD大鼠海马氧化损伤。
1 材料与方法
1.1实验动物与分组 健康雄性12~14月龄SD大鼠,体重280~350 g,由湖南斯莱克景达实验动物有限公司提供。所有实验动物标准齿啃类饲料适应性饲养1 w,自由饮食,无异常,用Morris水迷宫筛选出较灵活的大鼠84只,随机分为空白对照(C)组、空白对照运动(CE)组、VD模型(VD)组、VD模型运动(VE)组、白藜芦醇对照(R)组、白藜芦醇干预(RV)组、运动干预组和白藜芦醇联合运动干预(RE)组,每组12只,其中除对照组外的其他组大鼠进行VD造模。
1.2研究方法
1.2.1VD模型的构建 大鼠术前禁食12 h,禁水4 h。参照相关文献,用2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,仰卧固定,消毒剃毛后,颈正中切口,纵向切开皮肤及皮下组织,玻璃分针避开迷走神经分离双侧颈总动脉,以4号手术线,拉紧丝线扣,阻断血流30 min,观察到大鼠心跳加快,呼吸深慢即松开丝线扣恢复血流10 min后,再次阻断血流30 min,反复3次后,双重丝线结扎,术中注意确保大鼠体温,术后送至通风和空调设备的SPF动物房饲养。对照组大鼠除不结扎颈总动脉外,麻醉及手术过程均与模型组相同。术后7 d进行Morris水迷宫检测,依据超出对照组大鼠游至平台平均时间的95%上限值的标准的模型组大鼠选定为VD大鼠。白藜芦醇治疗组于术后第4周开始给予白藜芦醇治疗〔25 mg/(kg·d),白藜芦醇溶解于2 ml 0.5 g/L羧甲基纤维素钠〕灌胃,连续进行4 w。
1.2.2有氧运动干预模式 运动组大鼠借鉴Bedford等〔10〕运动方案和最大摄氧量(VO2max)百分数强度标准进行改良,坡度为10°、速度为16 m/min(约为65%VO2max强度)的动物跑台持续训练8 w,1次/d,60 min/次,6 d/w。
1.2.3神经行为学评定 采用中国医学科学院研制的Morris水迷宫测定系统记录大鼠定点巡航和空间探索能力,摄像头自动记录大鼠运动轨迹、计算机辅助系统分析其游泳距离、平台潜伏期,并计算不同象限中的游泳时间比例、距离比例等。
1.2.4海马组织取材 最后一次运动训练结束后,所有实验大鼠禁食过夜,2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,每组随机筛选6只进行脑在体固定,即严格按照开胸,自心尖处将灌注针插入主动脉后,先用4℃生理盐水快速冲洗,再用4℃的预冷的4%多聚甲醛灌注,待大鼠前肢及颈背部僵硬,肝组织等脏器变白而硬后,灌注结束;冰上固定后自枕骨大孔处横断,斜向插入剪刀剪开顶骨,止血钳掰断两边顶骨,剥离整个顶层颅骨,暴露整个脑组织,眼科剪分离颅底组织,将整块脑组织翘起,置于4%多聚甲醛4℃保存48 h及以上。每组其余6只大鼠麻醉后,俯卧位固定,用上述方法剥离颅骨,暴露脑组织,眼科镊翻开大脑皮层,玻璃分针剥离海马周边组织,取下海马组织,滤纸吸干组织液称重后,正中分开,左侧海马组织用于检测蛋白成分,右侧海马组织保存于Trizol溶液中,-80℃冻存,用于核酸提取。
1.2.5大鼠海马组织丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽(GSH)活性检测 冰上称重后的海马组织加入预冷的生理盐水,玻璃匀浆器冰水浴中匀浆海马组织,定量Biorad蛋白。严格按照MDA、SOD和GSH试剂盒说明书,硫代巴比妥酸法测定MDA、氮蓝四唑(NBT)法检测SOD活性、考马斯亮蓝法测定GSH蛋白含量。
1.2.6大鼠海马组织免疫组化检测 固定完成的大鼠脑组织,脱水,冠状面超前包埋、切片;常规脱蜡、复水,磷酸盐缓冲液(PBS)冲洗,蒸馏水浸泡,PBS冲洗3次,滴加抗原修复液,PBS洗涤3次,滴加过氧化物酶阻断剂,室温孵育30 min,滴加Nrf2多克隆抗体(1∶50,美国Santa Cruz),4℃过夜;次日PBS洗涤,滴加生物素标记的二抗,室温孵育30 min,PBS冲洗3次,滴加链霉菌抗生素-过氧化物酶溶液,室温孵育30 min;二氨基联苯胺显色,蒸馏水冲洗,苏木素复染,二甲苯透明,滴加中性树胶封片。每只大鼠相同视野下随机取5张切片(×400),应用Image Pro Plus-6图像分析软件分析每组切片积分吸光度IA值。
1.2.7海马组织总RNA提取 采用Total RNA提取试剂盒提取海马组织总RNA。于超低温冰箱取出存有海马组织的Trizol试管,置于玻璃匀浆机中,冰中充分研磨,室温裂解3 min,加入0.2体积的三氯甲烷,充分振荡,12 000 r/min,15 min离心,取上清加入同体积的异丙醇,-20℃静置20 min。12 000 r/min,15 min离心,弃上清,在沉淀中加入1 ml RNase-Free配制的75%乙醇,振荡器振荡。12 000 r/min,15 min离心,弃上清,无菌空气中干燥10 min。加入50 μl RAase-Free水溶解沉淀。完全溶解后,紫外分光光度计检测OD260 nm与OD280 nm值,判定其浓度和纯度。
1.2.8RT-PCR检测海马组织Nrf2、SOD表达水平 提取的海马组织总RNA,逆转录合成cDNA。引物由上海生物工程有限公司合成。引物合成序列:Nrf2:上游引物:5′-TTGGCAGAGACATTCCCATTTGTA-3′、下游引物:5′-ATCAGTCATGGCCGTCTCCAG-3′,215 bp;SOD-1:上游引物:5′-AATGTGTCCATTGAAGATCGTGTGA-3′、下游引物:5′-GCTTCCAGCATTTCCAGTCTTTGTA-3′,375 bp;HO-1:上游引物:5′-AGGTGCACATCCGTGCAGAG-3′、下游引物:5′-TCCAGGGCCGTATAGATATGGTACA-3′,339 bp;GAPDH:上游引物:5′-GGCACAGTCAAGGCTGAGA ATG-3′、下游引物:5′-ATGGTGGTGAAGACGCCAGTA-3′,452 bp。RT-PCR反应条件:95℃预变性30 s,95℃变性5 s,60℃退火延伸20 s,共40个循环,每个循环延伸末收集荧光信号,绘制扩增曲线,并对Nrf2、血红素氧合酶(HO)-1、SOD等目的基因相对定量进行分析,2-ΔΔCt计算其相对表达量〔11〕。
1.3统计学处理 采用SPSS20.0软件进行方差分析。
2 结 果
2.1有氧运动联合白藜芦醇干预VD大鼠空间学习记忆能力测试结果 与C组相比,VD组、VE组、RV组和RE组第1周训练的平均平台潜伏期时间和上台前游泳距离显著升高(P<0.05),但四组间无显著差异(P>0.05),第5周VE、RV与RE组的平均平台潜伏期时间和上台前游泳距离均显著低于VD组(P<0.01,P<0.05);第8周的测试结果显示,与VD组比较,VE、RV与RE组平均平台潜伏期时间和上台前游泳距离均显著降低(P<0.01),且以RE组改善趋势最大,见表1。
空间探索实验结果也显示,与VD组相比,VE与RV组大鼠在平台撤去后所在象限中的潜伏期比例和游泳距离比例明显增加(P<0.05);RE组大鼠呈非常显著性增加(P<0.01),见表1。
2.2免疫组化检测结果与分析 免疫组化染色显示,C组大鼠海马神经细胞中Nrf2核表达较少,而VD组大鼠海马神经细胞可见大量Nrf2核着色的阳性细胞;与C组(6.63±1.32)相比,VD组IA显著增加(23.77±6.61,P<0.01),与VD组相比,RV组(17.96±6.33)、VE组(13.29±4.74)、RE组海马神经细胞NRf2核着色的IA表达(8.45±3.50)显著减少(P<0.05,P<0.01),且明显接近于R组(7.90±2.55)和CE组(5.47±2.09)。见图1。
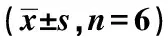
表1 白藜芦醇联合有氧运动干预VD大鼠定位巡航、空间探索的效果比较
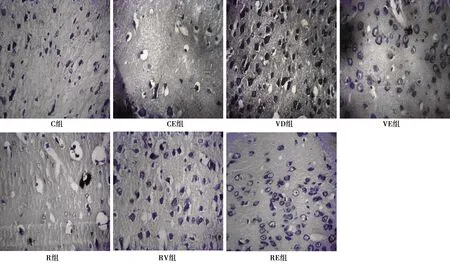
图1 各组大鼠海马神经细胞Nrf2表达水平(免疫组化染色,×400)
2.3MDA、SOD和GSH活性比较 VD组大鼠海马组织内MDA活性较C组明显升高,但SOD与GSH活性明显低于对照组(均P<0.01);与VD组比较,RV与VE、RE组MDA活性明显降低,SOD与GSH活性显著升高(P<0.05,P<0.01)。见表2。
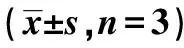
表2 白藜芦醇联合有氧运动干预VD大鼠海马组织 MDA、SOD与GSH活性的效果
2.4白藜芦醇联合有氧运动干预VD大鼠海马组织Nrf2、HO及SOD检测结果与分析 RT-PCR检测结果显示,VD组大鼠海马组织内Nrf2 mRNA的表达较C组显著上调(P<0.05);CE组Nrf2、HO-1、SOD mRNA较C组显著上调(P<0.01);与VD组相比,VE、RV、RE组大鼠海马组织的Nrf2、HO-1、SOD mRNA均呈显著上调(P<0.05,P<0.01)。见表3。
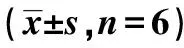
表3 白藜芦醇联合有氧运动干预VD大鼠 海马组织基因表达检测结果
3 讨 论
本研究结果提示有氧运动联合白藜芦醇能够有效改善VD大鼠空间学习记忆能力和空间探索能力。
氧化应激损伤与VD发病具有高度的相关性,这可能与因氧化应激导致体内OFR沉积,进而诱导海马组织损伤,诱发VD,尤其是表现在氧化还原产物MDA、GSH与SOD在机体内所反映的氧化还原状态呈密切相关〔12〕。作为体内氧自由基水平的标志产物,MDA是细胞膜脂质过氧化反应的终产物,含量高低直接反应机体氧化损伤程度〔13〕。SOD可通过水化而歧化O2-,在清除机体氧自由基的过程中发挥了重要作用,切断自由基连锁效应,保护细胞免受氧化损伤,其活性与机体清除自由基的能力相关〔14〕。GSH广泛存在于机体内,其可通过特异性催化稳定细胞膜结构,确保细胞的正常生理功能〔15〕。本研究结果说明,有氧运动虽然可以提高VD大鼠海马组织抗氧化能力,但效果不如白藜芦醇。
作为氧化应激感受器的Nrf2〔16〕,是碱性亮氨酸拉链家族中调节抗氧化应激反应活性最强的转录因子〔17,18〕。Nrf2/ARE是近年来最重要的内源性抗氧化应激信号通路,该通路可调节细胞的抗氧化应激能力,保护细胞组织氧化应激损伤〔19〕。ARE负责调控多种抗氧化酶基因的额表达,以抵抗各种内外源性氧化刺激诱导的氧化应激性损伤,促进氧自由基的平衡恢复〔20,21〕。本研究结果提示,白藜芦醇和有氧运动均可降低Nrf2免疫组化切片积分吸光度IA值,且联合干预组的影响最大。有氧运动可通过减少机体氧自由基的产生,增加其代谢,提高机体抗氧化能力,延缓大脑衰老,对VD有积极的防治作用〔22,23〕,但针对有氧运动防治VD的氧化应激性损伤是否通过Nrf2/ARE信号通路发挥关键调控作用,鲜有报道。本研究进一步证实,白藜芦醇联合有氧运动可增加Nrf2及其下游抗氧化酶的表达,降低海马组织MDA水平,增加SOD、GSH含量,减轻氧化应激损伤,逆转由VD诱导的氧化应激性海马神经细胞损伤。

