基于Sirt1/NF-κB信号通路探讨红景天苷在脑缺血再灌注体外模型中的神经保护作用
李军 张秀清
(1菏泽市成武县人民医院神经内科,山东 菏泽 274200;2山东第一医科大学第一附属医院神经内科)
缺血性脑血管疾病具有高发病率、高致残率和高死亡率等特点。脑缺血再灌注损伤是缺血性脑血管疾病重要病理过程〔1〕。红景天苷是中药红景天提取的主要活性成分,具有抗疲劳、抗衰老、保护心脑功能、抗肿瘤等多种药理功能。研究表明,红景天对脑缺血再灌注导致的神经损伤具有保护作用〔2〕。然而关于红景天苷在脑缺血再灌注损伤中的作用机制尚不清楚。氧葡萄糖剥夺/再恢复(OGD/R)诱导的SH-SY5Y细胞是构建体外脑缺血再灌注的常用模型。本研究通过构建OGD/R损伤体外模型,探讨红景天苷对OGD/R损伤的保护机制。
1 材料与方法
1.1材料 细胞株 人神经母细胞瘤SH-SY5Y细胞,购自美国ATCC。药品与试剂:红景天苷(纯度:≥98%,规格:100 mg/瓶,生产批号:20181467,阿拉丁生物试剂公司生产);DMEM培养基(美国Gibco公司生产);噻唑蓝(MTT)试剂盒(上海贝博生物公司);乳酸脱氢酶(LDH)检测试剂盒、RIPA细胞裂解液、膜联蛋白V异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)双染试剂盒(上海碧云天生物公司生产);聚偏氟乙烯膜。沉默信息调节因子(Sirt)1抗体、核因子(NF)-κB抗体、NF-κB p65抗体、辣根过氧化物标记的IgG抗体(美国Millipore公司生产)。仪器:全自动酶标仪(美国BioTek公司产品);FACS流式细胞仪(美国BD公司生产);凝胶成像系统(美国Bio-Rad公司生产)。
1.2细胞培养〔3〕SH-SY5Y细胞培养于含10%胎牛血清、100 U/ml青霉素、100 mg/ml链霉素的DMEM培养基中,培养箱环境为37℃、5% CO2。
1.3以SH-SY5Y细胞建立OGD/R细胞模型〔4〕将SH-SY5Y细胞接种于无糖DMEM培养基,置于37℃、95% N2、5 % CO2的培养气室培养4 h后,更换细胞培养基为正常培养基,并转移至含95%空气和 5% CO2的培养箱中培养24 h。
1.4细胞处理和分组〔5〕SH-SY5Y细胞分为正常组、模型组、实验组1、实验组2、NF-κB信号通路激活剂(SC7273)+实验组2。正常组细胞使用常规培养基培养;模型组细胞进行OGD/R处理;实验组1和实验组2分别用10、20 μmol/L红景天苷干预24 h,SC7273+实验组2使用20 μmol/L红景天苷和1 μg/ml SC7273处理24 h后,进行OGD/R处理。
1.5MTT法检测细胞存活率〔6〕取对数生长期的SH-SY5Y细胞,胰蛋白酶消化后,以1×104个/孔接种于96孔板。将SH-SY5Y细胞按照1.4方法分组处理,各孔加入20 μl MTT溶液,37℃继续培养 4 h 后,加入150 μl二甲基亚砜(DMSO)振荡混匀,室温放置10 min。在酶标仪上读取570 nm 处的吸光度(A)值,计算细胞活力。细胞存活率(%)=〔实验孔A值-空白孔A值〕/〔对照孔A值-空白孔A值〕×100%。
1.6微量酶标法检测培养液中LDH漏出率〔7〕将SH-SY5Y细胞接种于96孔培养板,并设置只含培养液的空白孔。各组细胞按照前述方法处理。对照组孔中加入10 μl LDH释放试剂,其余孔中加入10 μl培养基。37 ℃孵育1 h后,使用多孔板离心机将培养板板以400 r/min离心5 min,取60 μl各孔上清液,移至新96孔板对应孔中,并向各孔加入60 μl LDH检测工作液,混匀后室温下避光孵育30 min,在490 nm处测定各孔A值。LDH活性=〔实验孔A值-空白孔A值〕/〔对照组A值-空白孔A值〕×100%。
1.7流式细胞术检测细胞凋亡率〔8〕使用Annexin V-FITC/PI双染试剂盒检测细胞凋亡率。将对数生长期的SH-SY5Y细胞,用0.25 %的胰蛋白酶消化后,4℃下1 000 r/min离心3 min弃去上清液。然后加入1 ml的Annexin V缓冲液后重悬细胞,制成5×105个/ml的单细胞悬液。取1 ml细胞悬液,70%乙醇4℃固定24 h,加入5 μl PI 染色液避光孵育30 min,使用FACS流式细胞仪上检测细胞凋亡。
1.8Western印迹检测Sirt1/NF-κB信号通路相关蛋白表达〔9〕使用含蛋白酶抑制剂的RIPA细胞裂解液冰上裂解细胞10 min,收集细胞总蛋白。二喹啉甲酸(BCA)蛋白浓度检测试剂盒检测蛋白浓度。取总蛋白样品煮沸变性后,使用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白条带,并转至聚偏氟乙烯膜上。使用5%脱脂奶粉将膜室温封闭1 h后,分别加入一抗(Sirt1抗体、NF-κB抗体、NF-κB p65抗体、GAPDH抗体)4℃孵育过夜,二抗(辣根过氧化物标记的IgG抗体)37℃孵育1 h。使用电化学发光(ECL)试剂显影5 min,然后用凝胶成像系统分析。
1.9统计学处理 采用SPSS25.0软件进行单因素方差分析、LSD法。
2 结 果
2.1各组SH-SY5Y细胞存活率比较 与正常组〔(100.00±0.00)%〕比较,模型组细胞存活率〔(48.54±5.21)%〕显著降低(P<0.05);相比于模型组,实验组1〔(63.39±3.86)%〕和实验组2的存活率〔(76.17±6.42)%〕显著升高(P<0.05)。
2.2各组SH-SY5Y细胞上清液LDH漏出率比较 模型组细胞上清液LDH漏出率〔(54.79±3.16)%〕显著高于正常组〔(6.38±0.45)%,P<0.05〕;而实验组1〔(31.27±2.05)%〕和实验组2 LDH漏出率〔(23.65±2.81)%〕相比于模型组均显著降低(均P<0.05)。
2.3各组SH-SY5Y细胞凋亡率比较 模型组细胞凋亡率〔(14.52±1.17)%〕明显高于对照组〔(5.29±0.37)%;P<0.05〕;实验组1〔(12.43±0.82)%〕、实验组2〔(7.54±0.66)%〕与模型组比较均显著降低(均P<0.05)。见图1。
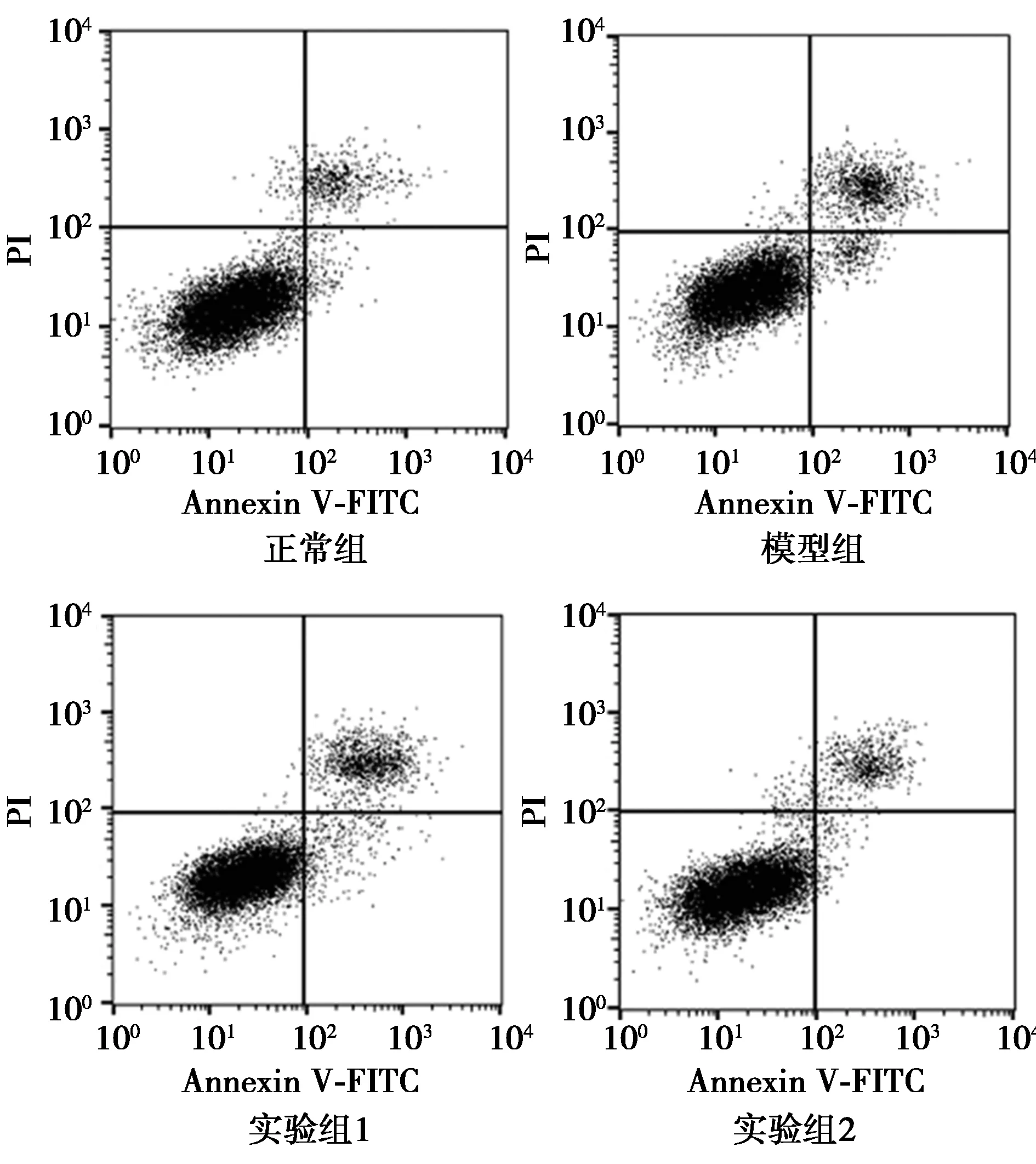
图1 各组SH-SY5Y细胞凋亡流式图
2.4各组Sirt1/NF-κB信号通路相关蛋白水平比较 正常组、模型组、实验组1、实验组2 Sirt1蛋白相对表达分别为0.78±0.08,0.43±0.05,0.61±0.04,0.72±0.05;NF-κB蛋白相对表达分别为0.32±0.05、0.66±0.08、0.52±0.03、0.36±0.03;NF-κB p65蛋白相对表达分别为0.31±0.03,0.65±0.05,0.43±0.03,0.34±0.02。模型组与正常组比较,实验组1、实验组2与模型组比较,Sirt1、NF-κB及NF-κB p65蛋白相对表达差异均有统计学意义(P<0.05)。见图2。表明红景天苷可能通过显著抑制Sirt1/NF-κB信号通路抑制SH-SY5Y细胞凋亡。
2.5SC7273逆转红景天苷对SH-SY5Y细胞的影响 与实验组2〔(75.34±6.79)%〕相比,SC7273+实验组2的细胞存活率〔(42.31±3.79)%〕显著下降(P<0.05),而实验组2 LDH漏出率〔(22.16±3.01)%〕和细胞凋亡率〔(6.89±0.79)%〕均显著低于SC7273+实验组2〔(48.97±4.67)%、(15.31±1.63)%,均P<0.05〕,表明SC7273逆转了红景天苷对SH-SY5Y细胞存活率、LDH漏出率和凋亡率的影响。见图3。
2.6SC7273逆转红景天苷对Sirt1/NF-κB信号通路相关蛋白水平 实验组2和SC7273+实验组2的Sirt1蛋白表达量分别为0.77±0.07和0.32±0.04;NF-κB蛋白表达量分别为0.35±0.04和0.80±0.09;NF-κB p65蛋白表达量分别为0.33±0.04和0.70±0.08。与实验组2相比,SC7273+实验组2 Sirt1、NF-κB和NF-κB p65蛋白表达差异均具有统计学意义(均P<0.05),见图4。表明SC7273可逆转红景天苷对Sirt1/NF-κB信号通路相关蛋白水平的影响。
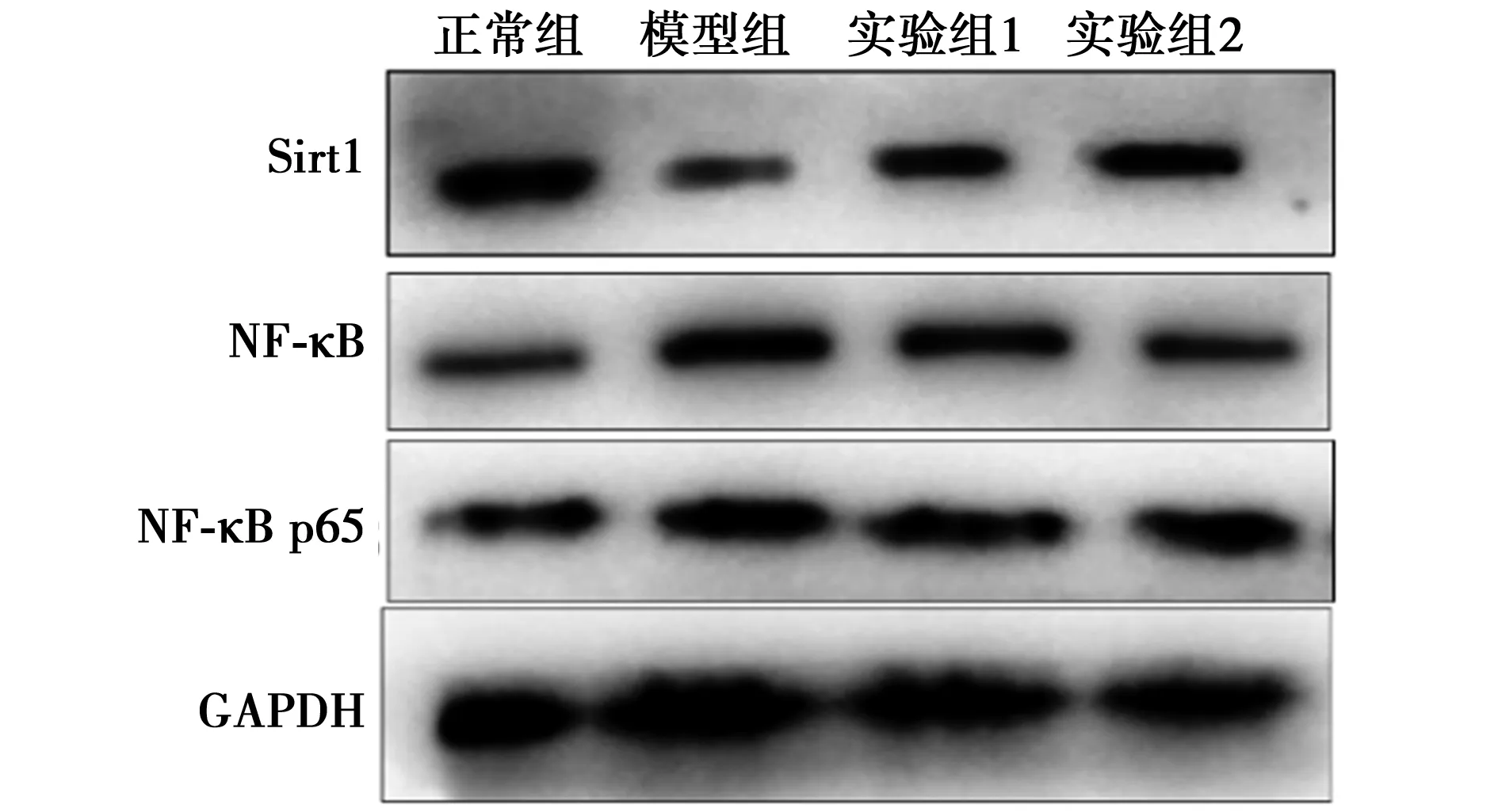
图2 各组细胞内Sirt1/NF-κB信号通路相关蛋白表达
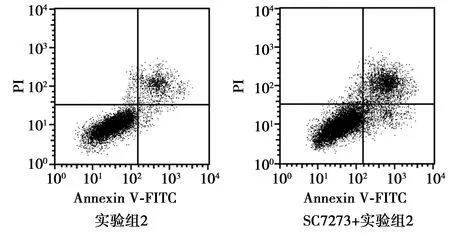
图3 两组细胞凋亡流式图

图4 两组细胞内Sirt1/NF-κB信号通路相关蛋白表达
3 讨 论
近年来,中药活性成分对脑缺血再灌注神经损伤的保护作用引起了越来越多的关注。红景天苷已被证实通过多个信号通路发挥保护脑缺血再灌注神经损伤〔10〕。本研究结果提示红景天苷可能通过增加SH-SY5Y细胞存活率和抑制氧化应激的途径发挥其治疗作用。有研究报道红景天苷可通过抑制细胞凋亡的途径减轻缺血再灌注带来的损伤〔11〕。本研究发现,OGD/R诱导SH-SY5Y细胞后,细胞凋亡率增加,而红景天苷可逆转OGD/R对SH-SY5Y细胞凋亡的影响,这与先前的研究结果一致〔11〕。
Sirt1是依赖于烟酰胺腺嘌呤二核苷酸的去乙酰化酶,介导细胞代谢、增殖、凋亡等多种细胞活动。据报道,Sirt1在缺血性脑血管病患者血浆中表达水平与内皮细胞恶化程度呈正相关〔12〕。此外,Sirt1去乙酰化后能够影响NF-κB激活,Sirt1/NF-κB信号通路已被证实在脑缺血再灌注损伤机制发挥重要作用〔13〕。本研究发现,红景天苷可显著削弱OGD/R对SH-SY5Y细胞中Sirt1、NF-κB和NF-κB p65蛋白的表达的影响,表明红景天苷可能通过抑制Sirt1/NF-κB信号通路发挥对SH-SY5Y细胞的保护作用。进一步分析发现,SC7273可扭转红景天苷对SH-SY5Y细胞增殖和凋亡的影响,并逆转了红景天苷对Sirt1/NF-κB信号通路的抑制作用。
综上,红景天苷可通过抑制Sirt1/NF-κB信号通路减轻OGD/R对SH-SY5Y细胞诱导的损伤。
——题《圣山系-金巅》

