恩格列净通过抑制iNOS 改善脂多糖诱导的高血糖和对心脏功能的影响
钮燕,朱静,严久琼
海军官兵尤其是舰艇部队及登陆作战官兵在发生开放性外伤的同时,往往面临着伤口被海水浸泡的问题。目前开放性外伤治疗上最大难题是感染,因为海水中存在多种致病菌,开放性外伤经海水浸泡后细菌入侵和增殖,往往会加重感染的严重程度,甚至发生脓毒血症[1]。脓毒血症患者常伴随着许多代谢改变,包括胰岛素抵抗和高血糖等,这些代谢改变会加剧感染,延缓疾病的恢复等[2-3]。脓毒血症作为一种重大疾病,应激诱导的高血糖很常见,并且与患者预后相关[4-5]。此外,应激诱导的高血糖通过氧化应激和炎症反应等机制降低心脏功能,而采用胰岛素治疗降低应激性高血糖可以改善心脏功能,但是有研究报道重症脓毒血症患者采用胰岛素强化降糖治疗会增加患者低血糖等不良事件的风险[6]。因此,开发有效降低应激性高血糖但又不会引起低血糖的治疗策略对脓毒血症患者心脏功能保护具有重要的意义。
钠葡萄糖协同转运蛋白2 抑制剂(sodium glucose cotransporter 2 inhibitors,SGLT2i)是首个有效减少2 型糖尿病患者心力衰竭和心血管死亡的降糖化合物,SGLT2i 被明确用于抑制肾脏中的钠葡萄糖协同转运蛋白2(SGLT2)[7]。最近大量研究表明,SGLT2i——恩格列净(empagliflozin, Empa)对各种类型的心脏细胞和心脏功能具有直接作用,Empa在心肌细胞和内皮细胞缺氧/复氧后能够维持细胞活力和腺苷三磷酸(ATP)含量,从而恢复高血糖和肿瘤坏死因子(TNF)-α 刺激的主动脉环和高血糖内皮细胞的血管反应性[8-9]。在离体的小鼠心脏中,Empa 可以诱导血管舒张[10]。在离体心脏的缺血再灌注研究中,Empa 在缺血期间能够延迟挛缩的发展,并在缺血后增加线粒体呼吸[11]。由此可见,Empa 对心脏具有广泛的保护作用,但是Empa 通过何种机制改善细菌脂多糖(LPS)诱导的高血糖和心脏功能障碍尚未明确。
既往研究报道,心脏中不存在SGLT2 的表达,提示Empa 改善LPS 诱导的心脏功能障碍并非直接通过作用于SGLT2 而发挥效应[12-13]。LPS 是革兰氏阴性菌血症和脓毒血症引起的许多宿主反应的关键介质,可诱导许多参与免疫、炎症和急性期反应的基因[14]。这些基因中,诱导型一氧化氮合酶(iNOS)与脓毒血症和内毒素血症等有害宿主的反应有关。敲除iNOS 的小鼠对LPS 诱导的低血压有抵抗力[15]。与iNOS 基因敲除小鼠的数据一致,iNOS 抑制剂氨基胍可降低野生型小鼠注射LPS 后的死亡率[16]。本研究旨在探讨Empa 通过抑制iNOS 改善LPS 诱导的高血糖和心脏功能障碍。
1 材料与方法
1.1 实验动物 成年雄性Sprague-Dawley(SD)大鼠,体重200~250 g,购自上海吉辉实验动物饲养有限公司[许可证号:SCXK(沪)2017-0012]。SD 大鼠饲养在气温恒定为25°C 的动物房,并以12/12 h 的明暗循环照明。SD 大鼠可自由获取标准啮齿动物饲料以及随意饮水。本研究方案得到海军军医大学实验动物管理委员会批准,有关动物实验操作均接受了实验动物管理委员会的评估和认证。
1.2 实验动物模型和分组 20 只SD 大鼠隔夜禁食18 h 后,按数字表法随机分为4 组,每组5 只,分别腹腔注射单纯生理盐水(NS)、Empa、LPS、LPS 联合Empa(LPS+Empa)。LPS 溶液给药剂量20 mg/kg,LPS 来源于055:B5 血清型大肠杆菌(Sigma,美国),0.25 g LPS 溶解于100 ml 生理盐水中,根据大鼠体重,按照8 ml/kg 的LPS 溶液腹腔注射[17];Empa(Sigma)给药剂量5 mg/kg,0.062 5 g Empa 溶解于100 ml 生理盐水中,根据大鼠体重,按照8 ml/kg 的Empa 溶液腹腔注射[18]。
1.3 血糖测量 大鼠分别于腹腔注射后0、60、120、180 和240 min 从尾静脉获取血样,通过Elite血糖仪(Bayer,Elkhart,IN)测量血糖。
1.4 心脏功能 通过心室内插管,测量SD 大鼠左心室舒张末期压力(LVEDP)、压力变化最大上升速率(+dP/dt)和最大下降速率(−dP/dt),由左心室压力变化来评估心脏功能[19]。简要步骤如下:SD 大鼠腹腔注射造模完成240 min 后,称重,腹腔注射尿脂800 mg/kg 和α-氯醛糖40 mg/kg 的混合麻醉液,麻醉大鼠。固定动物,备皮,在颈部正中切口,逐层暴露颈部肌肉和气管,钝性分离气管,插入气管插管,固定气管插管,保持大鼠气道通畅。钝性分离大鼠右侧颈部肌肉,暴露颈动脉鞘,游离右侧颈总动脉,插入PE 动脉插管,通过PowerLab 生物信号采集系统,记录大鼠颈总动脉血压。稳定后,继续插入动脉插管,深度为3.5~4.0 cm,当观察到血压波形脉压差增大,表明动脉插管已经进入左心室,等波形稳定后,连续记录左心室内压力10 min,计算LVEDP、+dP/dt 和−dP/dt,心功能指标记录结束后,过量麻醉使大鼠安乐死,取出心脏,清除血液,液氮冷冻,转移至−80 ℃冰箱,待用。
1.5 蛋白质免疫印迹法检测心脏组织iNOS 蛋白表达 剪取心尖处100 mg 的心脏组织,液氮处理后研磨组织块,按照说明书比例,加入RIPA 裂解液(P0013B,碧云天生物科技有限公司),提取大鼠心脏总蛋白,4 ℃静置10 min 后,3 000 r/min 离心提取上清,离心半径为5 cm,通过BCA 法测定上清液的蛋白浓度。按照终浓度为4 μg/μl 加入蛋白变性上样缓冲液,变性10 min,备用。处理好的心脏蛋白样本进行SDS-PAGE 电泳,通过转膜、封闭和洗膜,加入iNOS 一抗(ab178945,英国Abcam 公司),一抗孵育浓度为1∶1 000,以GAPDH 作为内参,4 ℃孵育一抗,过夜,洗膜后,室温孵育二抗1.5 h,洗膜后,经化学发光法显示蛋白条带,并采用Gel-Pro Analyzer 1 软件对蛋白条带灰度值进行分析。
1.6 Elisa 检测心脏组织中一氧化氮(NO)水平如1.5 实验中提取心脏组织,获取组织上清液,通过BCA 试剂盒测定所有样本上清液的蛋白质水平。采用总NO 检测试剂盒(碧云天公司,S0023),通过心脏组织中硝酸盐和亚硝酸盐的含量来反映心脏样本中NO 的水平。按照总NO 检测试剂盒操作说明书,简要步骤如下:配制NADPH、标准品等试剂待用。按说明书加样顺序往96 孔板中依次加入标准品、样品以及实验所需的试剂进行检测,加样结束后,通过酶标仪检测540 nm 处吸光度,根据标准曲线,计算每个样本硝酸盐和亚硝酸盐的含量,最后用硝酸盐和亚硝酸盐含量与相应样品蛋白浓度的比值来反映各心脏样本的NO 水平。
1.7 统计学处理 采用GraphPad Prism 6.0 软件进行统计分析,呈现正态分布的计量资料以±s表示,组间比较采用t检验。各组大鼠处理后不同时间点血糖水平采用重复测量的方差分析进行数据分析,各组心功能、iNOS 蛋白表达和NO 水平的差异采用单因素方差分析进行检验,组间差异采用采用Tukey 检验进行多重比较。检验水准α 为0.05。P<0.05 表示差异有统计学意义。
2 结果
2.1 大鼠腹腔注射后不同时间点血糖水平 尾静脉取血进行血糖水平检测结果显示,与同时间点NS 组相比,LPS 组在腹腔注射后60、120 和180 min 血糖水平升高,差异均有统计学意义(P<0.05);而与LPS 组比较,LPS+Empa 组在60 min 和120 min 血糖水平降低,差异均有统计学意义(P<0.05)。见表1。
表1 各组大鼠腹腔注射后不同时间点尾静脉血糖水平比较(mmol/L,± s,每组n=5)
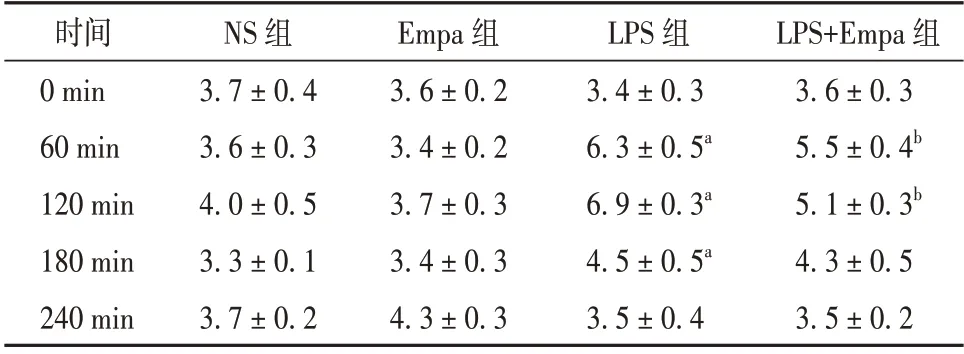
表1 各组大鼠腹腔注射后不同时间点尾静脉血糖水平比较(mmol/L,± s,每组n=5)
注:与NS 组比较aP<0.05;与LPS 组比较bP<0.05。NS 为生理盐水,Empa 为恩格列净,LPS 为脂多糖
LPS+Empa 组3.6±0.3 5.5±0.4b 5.1±0.3b 4.3±0.5 3.5±0.2时间0 min 60 min 120 min 180 min 240 min NS 组3.7±0.4 3.6±0.3 4.0±0.5 3.3±0.1 3.7±0.2 Empa 组3.6±0.2 3.4±0.2 3.7±0.3 3.4±0.3 4.3±0.3 LPS 组3.4±0.3 6.3±0.5a 6.9±0.3a 4.5±0.5a 3.5±0.4
2.2 大鼠心功能指标 心功能检测指标显示,与NS 组相比,LPS 组LVEDP 和−dP/dt 显著升高,+dP/dt显著下降,差异均有统计学意义(P<0.05);而与LPS 组比较,LPS+Empa 组LVEDP、+dP/dt 和−dP/dt显著改善,差异均有统计学意义(P<0.05)。见表2。
表2 各组大鼠心功能指标比较(± s,每组n=5)

表2 各组大鼠心功能指标比较(± s,每组n=5)
注:与NS 组比较aP<0.05;与LPS 组比较bP<0.05。+dP/dt 为心室压力变化最大上升速率,−dP/dt 为心室压力变化最大下降速率,LVEDP 为左心室舒张末期压力,NS 为生理盐水,Empa 为恩格列净,LPS 为脂多糖
LPS+Empa 组6 519±442b−6 760±631b 10.8±1.6b项目+dP/dt(mmHg/s)−dP/dt(mmHg/s)LVEDP(mmHg)NS 组9 193±720−8 811±906 2.2±1.0 Empa 组8 390±232−8 802±1 003 4.0±0.7 LPS 组4 919±345a−4 942±629a 14.1±1.5a
2.3 大鼠心脏组织中iNOS 表达和NO 水平 与NS组相比,LPS 组心脏组织中iNOS 蛋白表达和NO 水平显著升高,差异均有统计学意义(P<0.05);而与LPS组比较,LPS+Empa 组心脏组织中iNOS 蛋白表达和NO水平显著降低,差异均有统计学意义(P<0.05)。见图1 和表3。
表3 各组大鼠心脏组织中iNOS 表达和NO 水平比较(± s,每组n=5)

表3 各组大鼠心脏组织中iNOS 表达和NO 水平比较(± s,每组n=5)
注:与NS 组比较aP<0.05;与LPS 组比较bP<0.05。NS 为生理盐水,Empa 为恩格列净,LPS 为脂多糖,iNOS 为诱导型一氧化氮合酶,NO 为一氧化氮
LPS+Empa 组1.35 ± 0.14b 3.92 ± 0.34b项目iNOS 蛋白NO(μmol/g)NS 组1.00 ± 0.21 1.79 ± 0.30 Empa 组0.89 ± 0.12 1.90 ± 0.51 LPS 组1.76 ± 0.14a 5.48 ± 0.75a
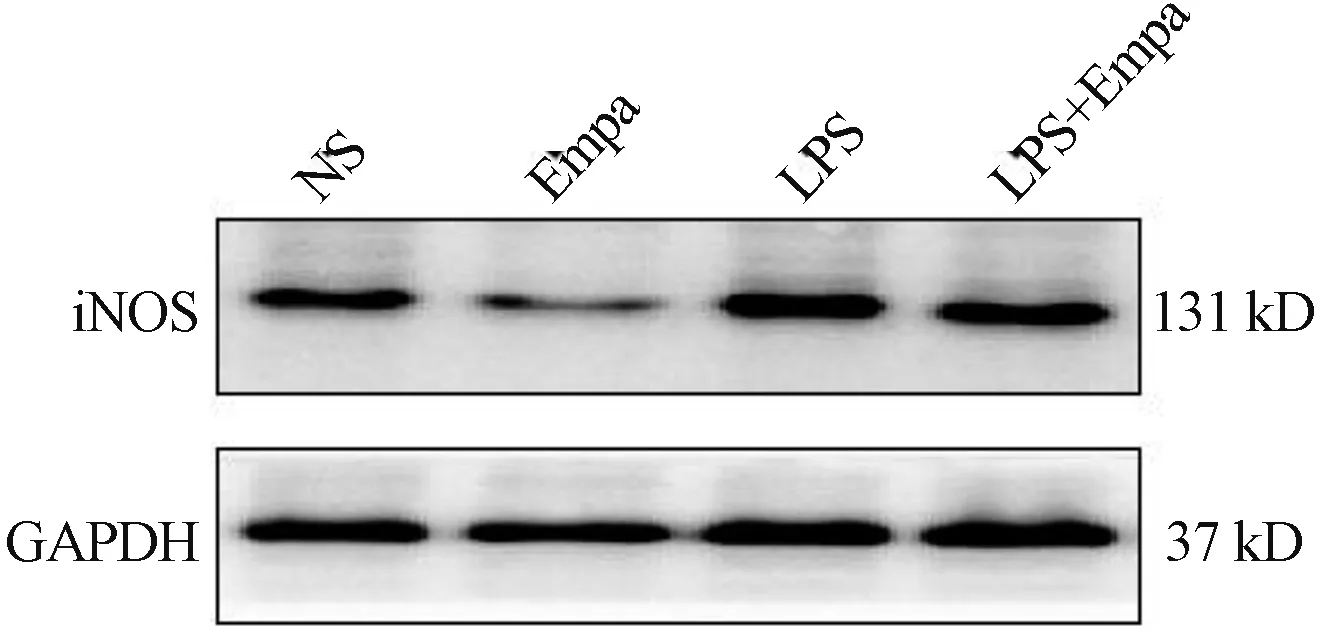
图1 各组大鼠心脏组织中iNOS 蛋白表达条带
3 讨论
脓毒血症是宿主对感染或损伤的全身性有害反应,是导致经海水浸泡外伤的海军官兵感染和死亡的主要原因。尽管发展为脓毒血症的患者的住院死亡率在脓毒症生存运动指南推出后的2 年内从37%下降至30.8%,但死亡率仍然很高[20]。2012 年,一项关于脓毒血症负担的全球研究估计,严重脓毒血症患者的死亡率接近50%[21]。心血管功能异常在脓毒血症的发病机制中起重要作用。大量研究表明,心脏功能障碍是脓毒血症患者常见的临床表现,其中大约50%的脓毒血症患者具有心脏功能障碍的迹象[22-23]。然而,脓毒血症诱导的心脏功能障碍的确切机制仍未明确。本研究以LPS 诱导脓毒血症为模型,发现SGLT2i——Empa 可显著改善LPS 诱导的心脏收缩和舒张功能,并伴随心脏组织中iNOS 表达和NO 产生的改善,从而发挥心血管保护作用。
基于动物研究,关于脓毒血症诱导的心脏功能异常的病理机制的可能假设是冠状动脉血流量不足导致的整体心肌缺血[24-25]。然而,有研究发现,伴有心肌功能障碍的感染性休克患者冠状动脉血流量正常或增加[26],反驳了上述假设。此外,一些研究表明,由于冠状动脉血流分布明显不均、内皮损伤、血管内纤维蛋白沉积和中性粒细胞浸润,脓毒血症期间伴有心脏微循环障碍,可能导致局灶性心肌缺血和心功能下降,但没有心肌缺氧的证据[27-29]。这些研究结果表明冠状动脉循环改变在脓毒血症诱导的心脏功能异常的病理生理学机制中不太重要。本研究发现LPS 诱导脓毒血症过程中伴随着高血糖,而采用Empa 可以改善LPS 诱导的高血糖,显著改善心脏组织中iNOS 表达和NO 产生,这些结果提示Empa 可以较好地控制LPS 诱导的应激性高血糖并改善心脏功能。
在脓毒血症期间,各种病原体相关分子模式(PAMP),如LPS 以及内源性损伤相关分子模式(DAMP),包括高迁移率族框1(HMGB1)和细胞外组蛋白;其与免疫细胞和其他细胞上的Toll 样受体(TLR)相互作用,除TLR3 外,所有TLR 均通过骨髓分化因子88(MyD88)依赖性途径发出信号并激活c-Jun N 末端激酶(JNK)、细胞外信号调节激酶1/2(ERK1/2)、p38 丝裂原活化蛋白激酶(MAPK)和转录因子核因子(NF)-κB 信号通路,进而诱导多种促炎细胞因子的产生,包括白细胞介素(IL)-1、IL-6 和TNF-α[30-31]。这些物质被认为是心肌抑制因子,包括TNF-α、IL-1、IL-6、补体过敏毒素(C5a)和LPS 等,最终参与了脓毒血症诱导的心脏功能异常。有研究表明,激活心肌细胞α1-肾上腺素能受体可抑制LPS 诱导的心肌细胞TNF-α 的表达,改善脓毒血症期间的心功能不全[32]。此外,另一项研究发现阻断α2-肾上腺素能受体可以抑制脓毒血症动物的心肌TNF-α、iNOS 表达以及心肌细胞凋亡和心功能不全[33]。在炎症反应中,iNOS 表达可诱导产生大量NO,因此,本研究检测心脏组织中iNOS 表达和NO水平,并发现LPS 诱导的脓毒血症大鼠心脏组织中iNOS 表达和NO 水平显著升高,而Empa 可以改善LPS 诱导的这些改变,并伴随着心脏功能的改善。但是,本研究存在不足之处是在评估大鼠心功能时采用了有创的心内导管记录心室内压力的变化,并未进一步开展无创大鼠心脏超声检查以及心肌组织病理学形态评估。
脓毒血症作为一种重大疾病,应激诱导的高血糖很常见,并且与患者预后相关。本研究采用腹腔注射LPS 诱导脓毒血症,发现LPS 可显著诱导血糖升高,而Empa 可以降低LPS 诱导的高血糖,提示应激性高血糖可能与脓毒血症诱导的心脏功能异常相关。目前研究认为心脏组织中并不存在Empa 直接作用的SGLT2,而大量研究报道Empa可以改善心衰和糖尿病患者心脏功能[34],这些结果表明Empa 可以不直接通过作用于SGLT2 而发挥心脏保护作用。本研究发现Empa 可以改善LPS 诱导的iNOS 表达和NO 水平,提示Empa 可能通过iNOS 参与改善脓毒血症诱导的心脏功能异常。
综上所述,Empa 可以改善LPS 诱导的心脏功能异常,其机制可能通过与改善高血糖,降低心脏组织中iNOS 表达和NO 水平有关。

