动态监测降钙素原对脓毒症急性肾损伤近期恢复预测价值
沈侃,许东伟,李俊,程智慧,瞿炜,邓星奇
(上海市浦东新区周浦医院重症医学科,上海 201318)
脓毒症是感染引发的炎症反应失调所致的危及生命的器官功能障碍[1]。急性肾损伤(acute kidney injury,AKI)是脓毒症常见的并发症,发病率高达60%[2]。有研究显示,AKI的延迟恢复与持续肾替代治疗需求增加、死亡率增高以及残余肾功能较差密切相关[3]。2017年急性透析质量倡议将48 h内肾功能未恢复的AKI定义为持续性AKI[4]。研究显示,持续性AKI与脓毒症及危重患者预后密切相关[5-8]。但是目前持续性AKI的诊断依赖于肌酐动态变化,诊断具有滞后性,不利于早期肾脏替代治疗的及时介入以及更加个体化的液体管理。近年开展的多项针对持续性AKI早期诊断的临床研究均未取得良好的效果[7,9-10]。降钙素原(procalcitonin,PCT)是降钙素的前体,由甲状旁腺分泌,含有116个亚基,分子量为13 600[11]。正常人群仅能检测到少量的PCT。细菌感染后,PCT可在3~6 h内迅速升高,24 h达到高峰[11]。PCT检测便捷、易于获取,已广泛用于临床,PCT的动态变化广泛用于评估脓毒症预后以及指导抗感染治疗。近年研究显示,PCT对危重患者及脓毒症患者AKI早期诊断有一定的价值[12-13]。但目前还没有PCT对脓毒症持续性AKI早期诊断价值的相关研究。基于此,本研究旨在探讨PCT及其动态变化对脓毒症持续性AKI的早期诊断价值。
1 资料与方法
1.1一般资料 收集2020年3月至2021年4月上海市浦东新区周浦医院重症医学科收治的74例脓毒症AKI患者的临床资料进行回顾性队列研究,其中男44例、女30例,年龄21~97岁,平均(67.8±19.0)岁。根据AKI后48 h内血清肌酐(serum creatinine,SCr)水平是否恢复正常分为持续性AKI组(44例)和短暂性AKI组(30例)。纳入标准:①符合脓毒症3.0[1]诊断标准。②符合改善全球肾脏病预后组织(Kidney Disease:Improving Global Outcomes,KDIGO)的AKI诊断标准[14],即48 h内SCr升高≥26.5 μmol/L或SCr升高≥1.5倍基线或尿量≤0.5 ml/(kg·h),且持续6 h。基线SCr为前三个月SCr的最低值。若无法获取SCr值,可采用肾脏病膳食改良公式[15]通过肾小球滤过率的正常值[75 ml/(min·1.73 m3)]计算SCr值。排除标准:①年龄≤18岁;②诊断AKI后48 h内死亡者;③慢性肾功能不全者;④48 h内接受肾脏替代治疗者;⑤PCT监测连续2次大于最高值,导致无法判断PCT动态变化者。
1.2方法
1.2.1资料收集 收集患者性别、年龄、体重、合并症、感染部位、临床评分、KDIGO分级以及AKI确诊时、确诊1 d、确诊2 d的血常规、PCT、C反应蛋白(C-reactive protein,CRP)检测结果。根据AKI确诊后24 h内各指标检测结果的最差值进行序贯器官衰竭评估(sequential organ faliure assessment,SOFA)评分和急性生理学和慢性健康状况评价Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)评分。各检测指标差值[ΔPCT、Δ白细胞(white blood cell,WBC)计数、ΔCRP、ΔSCr]定义为AKI确诊1 d、确诊2 d的检测结果与AKI确诊当日的差值,比较两组各时点同一指标及各指标动态变化(与确诊当日比较)。
1.2.2检测方法 采用多角度偏振光分类法、使用血细胞分析仪(雅培广州生物分析技术有限公司生产,型号:CELL-DYN RUBY)及配套原装试剂盒检测血常规。采用免疫浊度分析仪(芬兰Orion Diagnostica公司生产,型号:QuickRead go)及原装试剂盒测定CRP,检测范围8~350 mg/L;采用干式免疫荧光定量法、使用荧光定量分析仪(南京基蛋生物科技有限公司生产,型号:Getein1100)及配套原装试剂盒(南京基蛋生物科技有限公司生产)检测PCT,检测范围0.1~100 μg/L。使用全自动生化免疫分析仪(美国强生公司生产,型号:VITROS 5600)及配套原装试剂盒检测SCr,检测范围4~9 904 μmol/L。
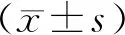
2 结 果
2.1两组一般资料比较 两组性别、年龄、体重、合并症、感染部位比较差异均无统计学意义(P>0.05)。持续性AKI组SOFA评分、APACHEⅡ评分以及KDIGO 3级患者占比均高于短暂性AKI组(均P<0.01)。见表1。

表1 两组脓毒症AKI患者一般资料比较
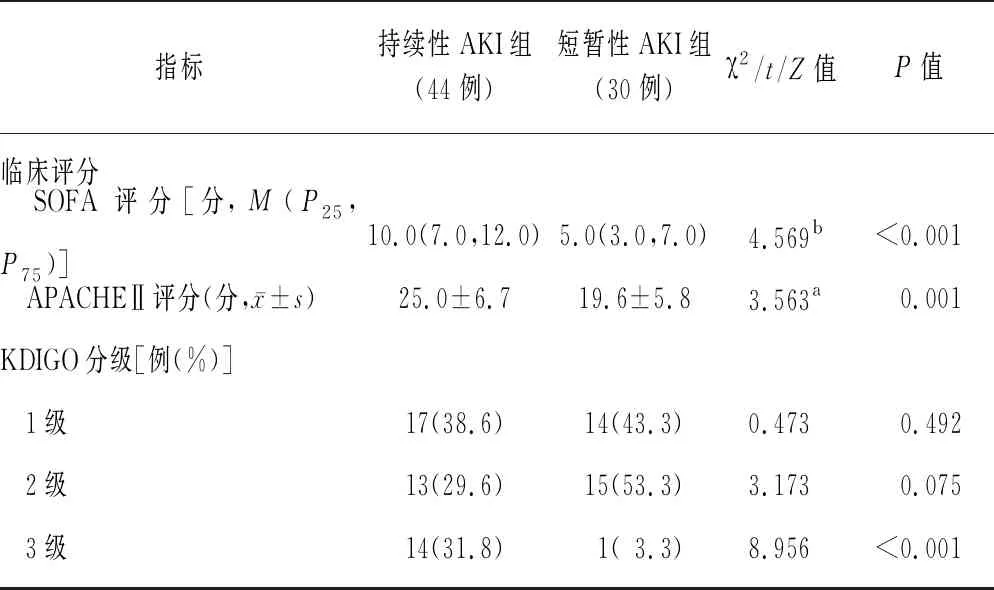
续表1
2.2两组检验指标及其动态变化比较 AKI确诊当日,两组SCr、WBC计数、PCT、CRP比较差异均无统计学意义(P>0.05)。AKI确诊1 d,持续性AKI组SCr、PCT水平高于短暂性AKI组(P<0.05或P<0.01),但两组WBC计数、CRP比较差异无统计学意义(P>0.05)。AKI确诊2 d,持续性AKI组SCr、WBC计数、PCT、CRP均高于短暂性AKI组(P<0.05或P<0.01)。且持续性AKI组ΔSCr-24 h、ΔSCr-48 h、ΔWBC-48 h、ΔPCT-24 h、ΔPCT-48 h、ΔCRP-48 h均高于短暂性AKI组(P<0.05或P<0.01),但两组ΔWBC-24 h、ΔCRP-24 h比较差异无统计学意义(P>0.05)。见表2。

表2 两组脓毒症AKI患者不同时间点指标及指标动态变化比较 [M(P25,P75)]
PCT动态变化显示,确诊后持续性AKI组PCT水平呈进行性升高趋势,而短暂性AKI组PCT水平呈进行性降低趋势,见图1。

注:AKI为急性肾衰竭,PCT为降钙素原;a与确诊当日比较,P<0.001,与确诊1 d比较,bP<0.001,cP<0.05
2.3脓毒症AKI患者PCT动态变化与SCr动态变化的相关性 Spearman相关分析结果显示,ΔScr-24 h与ΔPCT-24 h呈正相关(r=0.560,P<0.001),见图2。ΔScr-48 h与ΔPCT-48 h呈正相关(r=0.773,P<0.001),见图3。

注:AKI为急性肾衰竭,Scr为血清肌酐,PCT为降钙素原

注:AKI为急性肾衰竭,Scr为血清肌酐,PCT为降钙素原
2.4脓毒症持续性AKI独立预测因子的多因素Logistic回归分析 将持续性AKI组与短暂性AKI组差异有统计学意义的指标(SOFA评分、APACHEⅡ评分、确诊1 d的PCT、ΔPCT-24 h及KDIGO 3级)纳入Logistic回归模型进行分析,结果显示,SOFA评分、确诊1 d的PCT、ΔPCT-24 h是脓毒症持续性AKI的独立预测因子(P<0.05或P<0.01)。见表3。
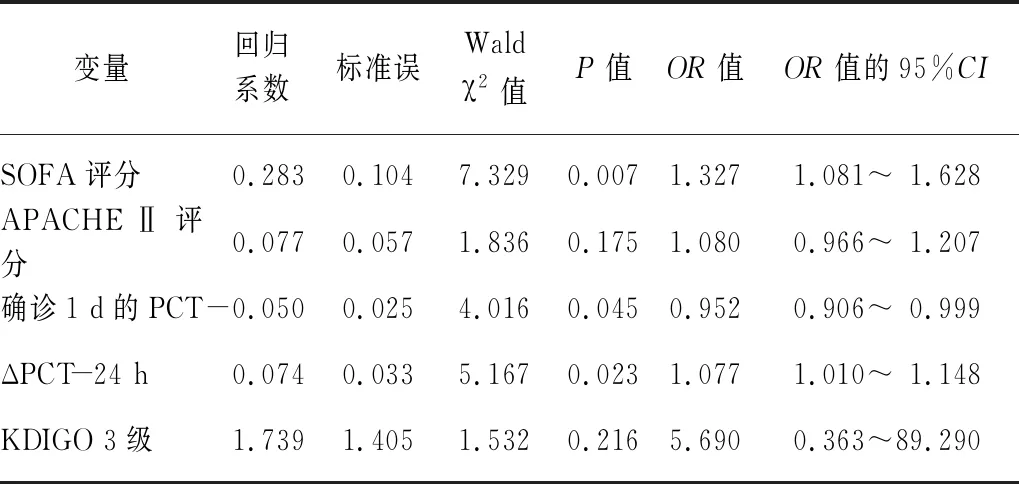
表3 脓毒症持续性AKI的多因素Logistic回归分析
2.5SOFA评分、APACHEⅡ评分、确诊1 d的PCT与ΔPCT-24 h对脓毒症持续性AKI的预测价值 ΔPCT-24 h的ROC曲线下面积高于SOFA评分、APACHEⅡ评分、确诊1 d的PCT,ΔPCT-24 h的最佳截断值为0.110 μg/L,灵敏度、特异度分别为77.27%、86.67%。见表4、图4。
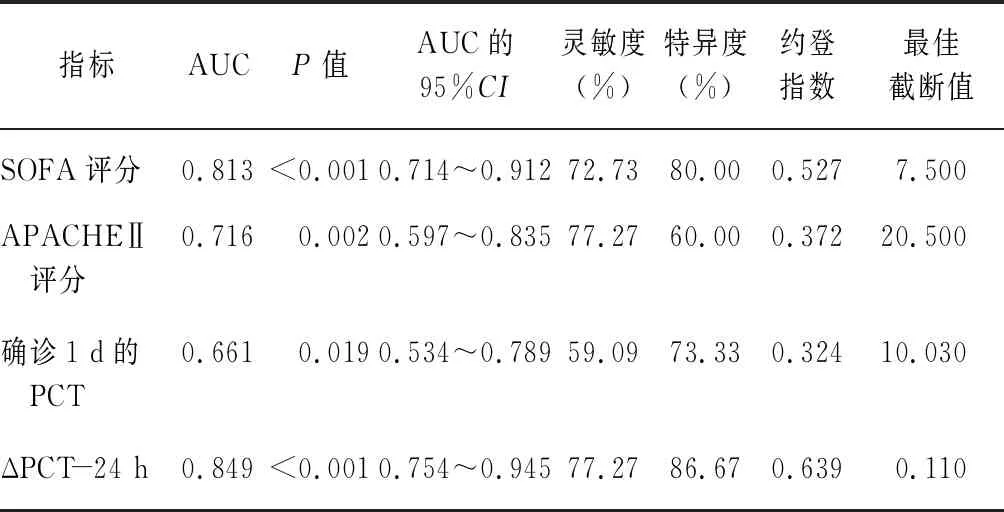
表4 SOFA评分、APACHEⅡ评分、确诊1 d的PCT、ΔPCT-24 h对脓毒症持续性AKI的诊断效能
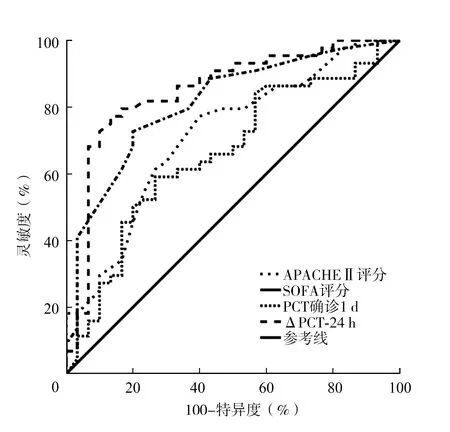
注:SOFA为序贯器官衰竭评估,APACHE为急性生理学和慢性健康状况评价,PCT为降钙素原,AKI为急性肾衰竭,ROC为受试者工作特征曲线
3 讨 论
AKI是脓毒症的常见并发症,短期内肾功能无法恢复的AKI患者往往需要严格的液体管理[16-18],并尽早开展肾脏替代治疗[19]。因此,早期识别持续性AKI、开展个性化治疗、实施精准的液体管理,对改善AKI患者预后有重要意义。
AKI发生后PCT的持续升高与持续性AKI的发生密切相关。本研究中多因素Logistic回归结果显示,ΔPCT-24 h是脓毒症持续性AKI发生的独立危险因素(P<0.01)。绘制ROC曲线,结果显示ΔPCT-24 h的ROC曲线下面积为0.849,最佳截断值0.110 μg/L,表明ΔPCT-24 h对脓毒症持续性AKI的早期诊断有良好的预测价值。
脓毒症AKI的病理生理过程复杂,过度炎症反应及炎症趋化因子激活不仅参与脓毒症AKI的发病过程[20],也是导致持续性AKI发生的重要因素[10]。PCT作为脓毒症的重要标志物,其表达主要受到细菌内毒素、炎症因子(肿瘤坏死因子-α、白细胞介素-6等)的调控[11,21]。同时,PCT还具有独特的促炎与细胞毒性机制,Araujo等[22]的研究显示,循环PCT可通过上调促炎通路的表达,促进肿瘤坏死因子-α、白细胞介素-6的表达,也可以直接作用于肾脏系膜细胞,诱导肾脏系膜凋亡,参与AKI的发病。Uhel等[5]的研究发现,持续性AKI患者的炎症因子水平在AKI发生后4 d内呈升高趋势,而短暂性AKI患者的炎症因子水平变化则相反。上述研究表明,PCT可能通过促进炎症反应失调以及直接对肾脏系膜细胞产生毒性作用而参与持续性AKI的发病。
PCT主要在肾脏代谢,分子量为13 600。由于慢性肾功能不全患者肾脏对PCT的清除能力下降,其PCT水平高于正常人[23]。以往研究显示,AKI患者PCT水平与SCr呈正相关[24],与肾小球滤过率呈负相关[25]。本研究结果显示,ΔSCr-24 h与ΔPCT-24 h呈正相关(P<0.01),ΔSCr-48 h与ΔPCT-48 h也呈正相关(P<0.01),且两项指标差值的相关性随时间延长而进行性增强,表明PCT的清除受到肾功能的影响。因此,持续性AKI患者PCT进行性升高可能是PCT清除减少的表现。本研究纳入样本时已剔除慢性肾功能不全以及48 h内进行肾脏替代治疗的患者,因此可以较真实地反映持续性AKI对PCT代谢的影响。但本研究仍存在一定的不足,首先,本研究为纳入脓毒症患者的单中心研究,结果难免存在一定的偏倚;其次,研究观察时间有限,仅纳入AKI发生24 h、48 h的实验室指标,可能并不能完全反映AKI后患者的真实病情变化。
综上所述,脓毒症AKI患者的PCT进行性升高与持续性AKI发病密切相关,且ΔPCT-24 h可作为脓毒症持续性AKI早期诊断的独立预测因子。

