妊娠期糖尿病患者肠道菌群相关代谢产物、SF、SOCS-3变化及其对母婴不良结局的预测价值
傅小青,李明,刘清秀,文丹
(重庆市开州区人民医院产科,重庆 405400)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是一种特殊类型的糖尿病,为妊娠期常见并发症之一,可明显增加先兆子痫、胎盘早剥、流产、产后出血、早产、难产、巨大儿、低体重儿及畸形等母婴不良结局发生率[1]。有数据统计,全球高达14%的女性曾患GDM,且近年仍呈上升趋势;我国GDM患病率现已高达14.8%[2-3]。尽管已有很多学者探讨了GDM的相关病因,但尚未得出具体结论[4]。近年来,有研究发现肠道菌群失衡及代谢产物异常在GDM发生发展中发挥一定作用,与胰岛素抵抗(insulin resistance,IR)有关[5]。氧化三甲胺(trimethylamine oxide,TMAO)是肠道菌群代谢产物中研究较多的指标,目前关于其对GDM的影响仍存在争议,国外有研究报道孕中期妇女血TMAO水平较低者更易发展为GDM;而我国有学者则发现GDM患者血TMAO水平明显高于正常妊娠女性[6-7],故需要更多研究探讨TMAO在GDM中的作用并探讨相关作用机制。近年有学者发现,血清铁蛋白(serum ferritin,SF)和细胞因子信号转导抑制因子3(suppressor of cytokine signaling-3,SOCS-3)通过加重IR引发GDM[8]。但关于TMAO、SF、SOCS-3三者在GDM中的变化及关系尚不清楚。本研究主要探讨GDM患者肠道菌群相关代谢产物TMAO、SF、SOCS-3的变化及其对母婴不良结局的预测价值。
1 资料与方法
1.1一般资料 选取2018年7月至2020年10月重庆市开州区人民医院收治的80例GDM患者作为观察组,年龄21~38岁,平均(29.7±5.6)岁;孕周8~12周,平均(9.3±2.7)周。纳入标准:①GDM符合《妇产科学》中的诊断标准[9];②均为初产妇,单胎妊娠;③自妊娠开始所有受试者产检均在本院完成;④年龄20~40岁。排除标准:①原发性糖尿病;②存在导致血糖升高的内分泌疾病;③合并妊娠高血压等妊娠期其他特殊疾病;④既往存在心、肝、肾、脑、肠道等功能异常;⑤近1个月内使用过抗生素或微生态调节剂等影响肠道菌群药物;⑥合并贫血。同期选择年龄和孕周与观察组匹配的80例正常妊娠孕妇作为对照组,年龄21~38岁,平均(29.3±5.5)岁;孕周8~12周,平均(9.5±2.6)周。两组年龄和孕周比较差异无统计学意义(P>0.05)。本研究获得重庆市开州区人民医院伦理委员会批准(伦理批准号:QK1821),受试者均签署了知情同意书。
1.2方法 分别抽取观察组[入组后第1天(孕早期)、GDM确诊当天(确诊期)]和对照组(入组后第1天,即孕早期)空腹外周静脉血3 ml于乙二胺四乙酸抗凝管和5 ml于分离胶管,前者用于TMAO检测,后者用于SF、SOCS-3检测。静置10 min,以离心半径12.5 cm,4 000 r/min离心10 min,吸取上清后于-80 ℃冰箱保存,待所有标本集齐后进行检测。①采用稳定同位素稀释高效液相色谱串联质谱技术(6420 Triple Quad三重四级杆质谱仪和1260 Infinity高效液相色谱仪均购自美国Agilent公司)检测各标本中血浆TMAO水平,试剂盒购自美国Sigma公司(批号:201907);②通过mini ViDas免疫酶化学发光分析仪(法国Biomerieux公司)采用化学发光法检测SF和空腹胰岛素,试剂盒购自上海透景生命科技股份有限公司(批号:20191123);③通过Multiskan FC全自动酶标仪(美国Thermo Fisher公司)采用酶联免疫吸附法检测血清SOCS-3水平,试剂盒购自上海酶联生物科技有限公司(批号:20200212);④通过AU5800全自动生化仪(美国Beckman公司)采用酶法检测空腹血糖,试剂盒购自北京利德曼生化股份有限公司(批号:20191211);⑤计算稳态模型评估的IR指数(homeostasis model assessment insulin resistance,HOMA-IR)=空腹血糖×空腹胰岛素/22.5[10]。
1.3观察指标 比较观察组(孕早期和确诊期)和对照组(孕早期)血TMAO、SF、SOCS-3和HOMA-IR差异;收集观察组母婴结局,其中母婴不良结局包括胎膜早破、羊水过多、流产、早产、剖宫产、产后出血、早产儿、巨大儿、新生儿窒息和新生儿低血糖。
2 结 果
2.1观察组和对照组孕早期血TMAO、SF、SOCS-3和HOMA-IR比较 与对照组相比,观察组孕早期血TMAO降低(P<0.01),而SF、SOCS-3和HOMA-IR均明显升高(P<0.01)。见表1。

表1 观察组和对照组孕早期血TMAO、SF、SOCS-3和HOMA-IR比较
2.2观察组孕早期TMAO、SF、SOCS-3、HOMA-IR的相关性分析 Pearson分析结果显示,观察组孕早期TMAO与HOMA-IR呈明显负相关(r=-0.794,P=0.006),SF、SOCS-3与HOMA-IR呈明显正相关(r=0.682,P=0.011;r=0.721,P=0.009);TMAO与SF、SOCS-3呈明显负相关(r=-0.815,P=0.001;r=-0.847,P=0.001)。
2.3孕早期血TMAO、SF和SOCS-3对GDM的预测价值 孕早期TMAO预测GDM的ROC曲线下面积(area under curve,AUC)为0.687(95%CI0.625~0.737),最佳截断值为13.59 μmol/L,灵敏度和特异度分别为66.1%、71.9%;孕早期SF预测GDM的AUC为0.663(95%CI0.614~0.722),最佳截断值为33.92 μg/L,灵敏度和特异度分别为64.2%、70.1%;孕早期SOCS-3预测GDM的AUC为0.672(95%CI0.618~0.731),最佳截断值为47.53 ng/L,灵敏度和特异度分别为65.4%、70.4%;三者联合预测效能更佳,其AUC为0.854(95%CI0.782~0.889),灵敏度和特异度分别为77.5%、86.4%。见图1。
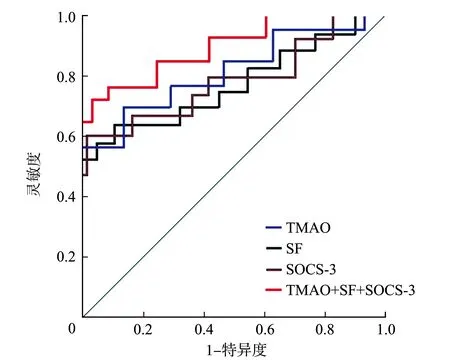
注:TMAO为氧化三甲胺,SF为血清铁蛋白,SOCS-3为细胞因子信号转导抑制因子3,GDM为妊娠期糖尿病,ROC为受试者工作特征曲线
2.4观察组母婴结局及母婴不良结局组和良好结局组确诊期血TMAO、SF和SOCS-3比较 GDM患者中母婴不良结局20例,母婴良好结局60例。与母婴良好结局组比较,不良结局组确诊期血TMAO降低(P<0.01),SF和SOCS-3升高(P<0.05或P<0.01)。见表2。

表2 母婴不良结局组和良好结局组确诊期血TMAO、SF和SOCS-3比较
2.5确诊期血TMAO、SF和SOCS-3对GDM母婴不良结局的预测价值 确诊期TMAO预测母婴不良结局的AUC为0.757(95%CI0.684~0.789),最佳截断值为5.82 μmol/L,灵敏度和特异度分别为70.5%、65.4%;确诊期SF预测母婴不良结局的AUC为0.732(95%CI0.671~0.775),最佳截断值为52.03 μg/L,灵敏度和特异度分别为71.7%、64.2%;确诊期SOCS-3预测母婴不良结局的AUC为0.729(95%CI0.663~0.781),最佳截断值为82.28 ng/L,灵敏度和特异度分别为69.8%、63.5%;三者联合预测效能更佳,其AUC为0.895(95%CI0.814~0.942),灵敏度和特异度分别为87.9%和81.5%。见图2。
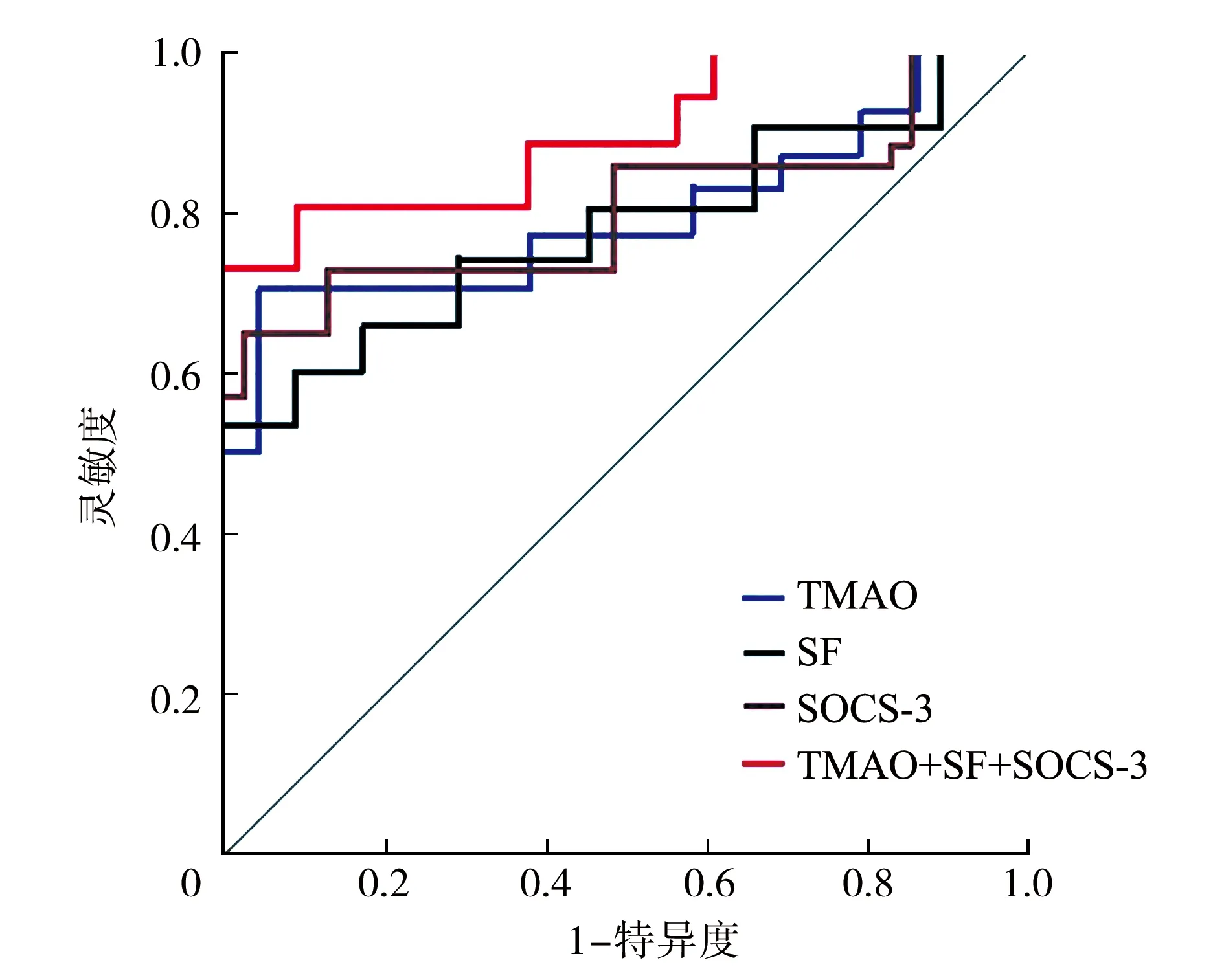
注:TMAO为氧化三甲胺,SF为血清铁蛋白,SOCS-3为细胞因子信号转导抑制因子3,GDM为妊娠期糖尿病,ROC为受试者工作特征曲线
3 讨 论
研究调查显示,我国是GDM高发国家,且发病率逐年上升,严重影响母婴健康[11]。因此,探讨GDM致病机制,寻找早期诊断GDM的有效指标十分重要。研究发现,GDM致病机制复杂,目前认为胰岛素分泌受损和IR是GDM发生的重要原因,而高能量摄入及膳食营养素是导致IR的重要因素[12]。
肠道菌群是人体最大的微生态系统,在机体代谢中占有重要地位,其中35%以上机体代谢所用的酶类来自肠道正常菌群;研究表明,肠道菌群与代谢性相关疾病的发生发展存在密切联系[13-14]。TAMO是肠道内特定微生物酶复合物参与代谢的氧化产物,有研究发现2型糖尿病与TMAO水平密切相关;TMAO主要通过阻断肝脏胰岛素信号通路、促使脂肪组织炎症反应加重糖耐量异常程度,导致血糖进一步升高[15-16]。但TMAO与2型糖尿病的关联也存在不一致的观点,美国学者研究发现摄入较高的卵磷脂(终产物为TMAO)可增加2型糖尿病的发生风险;但挪威学者发现卵磷脂的终产物——TMAO与2型糖尿病无明显关联性[17]。在本研究中,观察组孕早期血TMAO低于对照组(P<0.01),这可能是由于肠道菌群异常导致TMAO前体三甲胺快速堆积,但负责将三甲胺转化为TMAO的黄素单加氧酶3活性降低,使机体呈现高三甲胺-低TMAO状态,激活机体炎症反应和内质网应激反应等,导致糖代谢异常、IR,最终导致血糖持续升高[18]。此外,本研究还显示,TMAO与IR呈明显负相关(P<0.05)。
有研究发现SF和SOCS-3过表达也是导致糖尿病发生的重要原因,前者主要是由于大量铁离子蓄积导致活性氧过度产生,加剧脂质过氧化,同时减少肌肉组织对葡萄糖的利用,最终诱发肝脏IR;后者不仅可通过竞争性抑制转录激活因子5b抑制胰岛素受体底物-1酪氨酸磷酸化,并作为泛素化连接蛋白降解帮助胰岛素受体底物-1还可激活Janus激酶/信号转导及转录活化因子3信号转导通路,导致IR[19-20]。在本研究中,观察组SF、SOCS-3和HOMA-IR均明显高于对照组(P<0.01),且SF、SOCS-3与HOMA-IR均呈明显正相关(P<0.05),提示高水平SF、SOCS-3可导致IR,与前述研究结论[8]基本吻合。此外,本研究还显示TMAO与SF、SOCS-3呈明显负相关(P<0.05),提示TMAO、SF和SOCS-3通过互相影响参与IR,最终导致GDM。本研究ROC曲线分析显示,TMAO、SF和SOCS-3联合检测预测GDM的诊断效能最佳,灵敏度和特异度提高至77.5%和86.4%,但本研究中TMAO、SF和SOCS-3单独检测的灵敏度低于楼公先等[21]报道的孕早期空腹血糖、糖化血红蛋白、血清总胆固醇和三酰甘油在GDM中的诊断价值,这可能与本研究样本量较少有关,但TMAO、SF和SOCS-3联合检测特异度则高于上述文献。本研究结果显示,母婴不良结局组TMAO低于良好结局组(P<0.01),而SF和SOCS-3则明显高于良好结局组(P<0.05或P<0.01),提示TMAO、SF和SOCS-3还可能介导GDM进展,与母婴结局存在某种关联,TMAO、SF和SOCS-3联合预测GDM母婴不良结局的诊断效能最佳,为GDM母婴监测提供了更多依据。
综上所述,血TMAO、SF、SOCS-3在GDM中异常表达且互相关联,有望成为预测GDM及GDM母婴不良结局的指标,为GDM诊疗提供更多理论依据。但本研究为单中心研究、样本量有限,使结论推广受限,有待后续深入探讨。

