小檗碱治疗重症急性胰腺炎的临床疗效
倪倩雯,高振军,沈曼茹,黄继英,唐鄂,刘庭玉
(复旦大学附属中山医院青浦分院消化内科,上海 201799)
重症急性胰腺炎(severe acute pancreatitis,SAP)是临床常见且致死率较高的急腹症,15%~20%的胰腺炎会进展为重症[1]。SAP早期伴随强烈的全身炎症级联反应并释放大量炎症因子,常出现肠道屏障功能障碍,进一步加重胰腺感染及坏死,可能引发多器官功能衰竭甚至死亡[2-3]。肠道屏障功能障碍所引发的肠道细菌移位、内毒素血症及大量促炎性细胞因子的过度释放在胰腺炎向重症化发展中发挥重要作用[4]。小檗碱属于异喹啉类生物碱,是一种具有广谱抗菌作用的中成药[5]。目前多项动物实验已证实其具有抗氧化和抗炎特性,能减少胰腺组织中的氧化应激、组织学改变、炎症细胞浸润和胶原沉积[5-6]。此外,小檗碱还能改善胰腺炎所致的肠道微生态失衡,避免肠道细菌移位及改善内毒素血症,对减轻SAP的发生发展发挥积极作用[7]。因此,本研究从临床角度探讨小檗碱治疗SAP的临床疗效及其相关作用机制。
1 资料与方法
1.1一般资料 回顾性分析2018年2月至2021年2月复旦大学附属中山医院青浦分院收治的78例SAP患者的临床资料。纳入标准:①符合SAP诊断标准[8];②急性生理学和慢性健康状况评价Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)>8分;③发病24 h以内;④入组患者均签署了知情同意书。排除标准:①合并恶性肿瘤者;②近2周内服用可能影响肠道微生态的药物(益生菌、抗生素、影响胃肠动力药物等);③各种原因需急诊手术者。上述患者依据治疗方法不同分为对照组和观察组,每组39例。其中对照组男23例,女16例,年龄26~65岁,平均(45.5±7.1)岁;观察组男21例,女18例,年龄28~62岁,平均(45.3±7.4)岁。两组患者性别、年龄比较差异无统计学意义(P>0.05)。本研究获得复旦大学附属中山医院青浦分院伦理学审批(伦理批准号:202102411L)。
1.2治疗方法 两组患者入院后均接受综合治疗,包括禁食、胃管减压、早期液体复苏[复苏目标:平均动脉压为65~85 mmHg(1 mmHg=0.133 kPa),心率<120次/min,尿量>0.5~1 ml/(kg·h),血细胞比容<0.44]、抑制胰腺分泌(生长抑素)。观察组在对照组的基础上采用盐酸小檗碱片(瑞阳制药有限公司生产,批号:21091012,规格:0.1 g)干预,每次0.3 g,每日3次,经胃管灌入。两组均连续治疗2周。
1.3观察指标 ①两组患者临床症状的改善情况(腹痛缓解时间、首次排气时间、首次排便时间)和住院时间。②干预前后采集患者外周静脉血样5 ml,采用酶联免疫吸附法测定血清炎症因子[肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-8、IL-6]及内毒素水平。③治疗前后采用无菌粪便采集杯留取粪便1.0 g左右,分别对肠道中双歧杆菌及大肠埃希菌进行培养和计数。采集的粪便标本在30 min内采用光冈法进行检测,以1 g cfu/g为单位计算菌落数值。④治疗前后留取粪便样本300 mg于无菌离心管中,经离心后取上清,经膜过滤后,通过气相色谱仪测定乙酸、丙酸和丁酸的含量。⑤比较两组治疗前后APACHEⅡ评分。
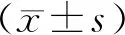
2 结 果
2.1两组患者临床症状改善时间和住院时间比较 观察组患者腹痛缓解时间、首次排气、首次排便时间及住院时间均短于对照组(均P<0.01),见表1。

表1 两组SAP患者临床症状改善时间和住院时间比较
2.2两组患者治疗前后炎症因子和内毒素水平比较 治疗前,两组炎症因子和内毒素水平比较差异无统计学意义(P>0.05);治疗后,两组患者炎症因子(IL-6、IL-8、TNF-α)及内毒素水平均较治疗前明显下降(P<0.05),且观察组较对照组下降更明显(P<0.05或P<0.01)。见表2。
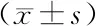
表2 两组SAP患者治疗前后血清炎症因子和内毒素水平比较
2.3两组患者治疗前后肠道菌群变化比较 治疗前,两组双歧杆菌、大肠埃希菌数量及双歧杆菌/大肠埃希菌比值比较差异无统计学意义(P>0.05)。治疗后,两组大肠埃希菌数量较治疗前显著下降(P<0.05),且观察组低于对照组(P<0.05);两组双歧杆菌数量和双歧杆菌/大肠埃希菌比值较治疗前显著升高(P<0.05),且观察组高于对照组(P<0.05或P<0.01)。见表3。
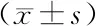
表3 两组SAP患者治疗前后肠道菌群变化比较
2.4两组患者治疗前后粪便3种短链脂肪酸含量比较 治疗前,两组患者粪便中乙酸、丙酸和丁酸的含量比较差异无统计学意义(P>0.05);治疗后,两组患者乙酸、丙酸和丁酸的含量明显高于治疗前(P<0.05),且观察组高于对照组(P<0.01)。见表4。

表4 两组SAP患者治疗前后粪便中3种短链脂肪酸的含量比较
2.5两组患者治疗前后APACHEⅡ评分比较 治疗前,两组患者APACHEⅡ评分比较差异无统计学意义(P>0.05);治疗后,两组APACHEⅡ评分均低于治疗前(P<0.05),且观察组低于对照组(P<0.01),见表5。
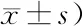
表5 两组SAP患者治疗前后APACHEⅡ评分比较 (分,
3 讨 论
急性胰腺炎患者早期大量炎症介质释放、肠道屏障功能障碍及肠源性内毒素血症的形成在急性胰腺炎向重症转化甚至进展为多器官功能衰竭的过程中发挥重要作用[9-10]。一项研究表明,59%的急性胰腺炎患者伴有肠道功能障碍,是急性胰腺炎患者常见的胰腺外器官损伤[11]。肠道功能障碍所诱发的肠道通透性增加、菌群移位是内源性感染的主要原因,可加重胰腺组织的坏死和继发感染,增加多器官功能障碍综合征发生率和死亡率[12-13]。因此,改善肠屏障功能障碍、减轻肠源性内毒素血症是SAP的潜在治疗靶点。近年来,小檗碱抗氧化应激、抗炎、改善肠道微生态等作用被广泛接受。
SAP诱发的大量炎症介质释放导致肠道功能障碍,继而出现腹痛腹胀等麻痹性肠梗阻的临床症状。本研究中,观察组治疗后临床腹痛缓解时间、首次排气时间、首次排便时间及住院时间均短于对照组,提示小檗碱可促进肠道功能的早期恢复。SAP动物模型已证实,小檗碱可改善SAP诱导的肠屏障功能失衡[14]。此外,诸多文献报道小檗碱可改善SAP患者的血清炎症因子水平,Choi等[6]发现小檗碱可通过抑制c-Jun氨基端激酶信号通路对SAP模型发挥抗炎作用。与对照组相比,经小檗碱灌胃治疗的SAP小鼠胰腺和肺的组织学损伤减轻,血清淀粉酶、脂肪酶水平下降,炎症因子(TNF-α、IL-1β、IL-6)的表达下调。本研究显示,治疗后观察组血清炎症因子IL-6、IL-8、TNF-α水平显著低于对照组。TNF-α是一类极为重要的细胞因子,可诱导其他炎症介质的产生,为SAP全身炎症级联反应的产生奠定基础。上述结果提示,小檗碱治疗能够降低胰腺炎患者的炎症因子水平,抑制全身炎症反应,且观察组内毒素血症也得到明显改善。诸多动物实验也提示小檗碱具有抗氧化应激和抗炎的作用,Bansod等[15]研究发现,小檗碱可显著抑制急性坏死性胰腺炎和肺的组织学损伤,并降低血清淀粉酶、脂肪酶、髓过氧化物酶活性及细胞因子的产生和SAP动物模型的死亡率。另有动物实验表明,小檗碱通过降低SAP大鼠脂多糖和TNF-α水平,阻断炎症级联反应,减轻胰腺病理改变,提高SAP大鼠的存活率[16]。由此可见,小檗碱具有抗氧化和抗炎特性,能有效抑制炎症风暴,快速缓解患者临床症状,提高临床效果。
肠道微生态与SAP的发生发展密切相关,来自肠道的大肠埃希菌和肠球菌是引起胰腺坏死和感染的重要因素[11,17]。有研究显示,与轻度胰腺炎患者相比,SAP患者肠杆菌科和肠球菌的丰度增加了3.2%,而双歧杆菌丰度下降了9.2%[11],且这种变化随着胰腺炎的进展越来越明显。肠道微生物群是急性胰腺炎的重要介质,其失调与急性胰腺炎的严重程度有关[18-19]。为了进一步探究小檗碱抑制炎症反应的机制,本研究中观察了SAP患者中肠道菌群及其代谢产物的变化。结果显示,治疗2周后观察组肠道致病菌(大肠埃希菌)数量明显下降,而益生菌(双歧杆菌)数量明显上升,肠道定植抗力(双歧杆菌与大肠埃希菌比值)明显升高(P<0.05),提示小檗碱可通过调节肠道微生态、保护肠道屏障,减少细菌移位而减轻SAP。
SAP患者早期肠道菌群失调,短链脂肪酸(short-chain fatty acids,SCFAs)含量明显降低。SCFAs是肠道微生物群最常见的代谢物,对维持肠道机械和免疫屏障功能至关重要,同时作为肠上皮细胞的主要能量来源,可促进肠上皮细胞的增殖和分化,减少细胞凋亡[20]。肠道中95%以上的短链脂肪酸是乙酸、丙酸和丁酸。通过测定粪便中3种短链脂肪酸的含量可较好地反映肠道菌群的结构。本研究结果显示,治疗后,观察组的短链脂肪酸含量较对照组明显升高,提示小檗碱通过改变肠道微生态结构增加 SCFAs含量,保护肠道屏障功能,同时因SCFAs可酸化肠道,抑制致病菌的定植并促进益生菌的增殖,从而减轻肠道炎症和SAP的进展。有研究发现,小檗碱能诱导回肠基因表达,从而缓解全身和局部炎症,显著改变整个肠道微生物群结构,许多产SCFAs的细菌丰度增加,从而减轻肠道炎症[7]。APACHEⅡ评分可客观评价SAP患者的危重程度,评价治疗效果,预测患者死亡率[21]。本研究结果显示,治疗后,观察组APACHEⅡ评分低于对照组(P<0.05),提示经小檗碱治疗SAP可降低患者的疾病严重程度,提高临床治疗效果。
综上所述,小檗碱通过调节肠道微生态、减轻肠道炎症、阻断SAP患者进一步的全身炎症风暴,提高治疗效果。

