QuEChERS净化-高效液相色谱法测定蔬菜中除虫脲和灭幼脲的残留量
安 佳,张 营,盛玉婷,刘益丰,于海波,景 逵
(辽宁大学 环境学院,沈阳 110036)
除虫脲和灭幼脲属于苯甲酰脲类杀虫剂[1],主要用于防治棉花、玉米、甜菜、土豆、葡萄、柑橘和观赏植物上的昆虫,具有降解快速、动物毒性低、选择性高、生物活性好等优点,是广泛运用的农作物杀虫剂[2]。该类杀虫剂在施用后,会通过径流进入水生环境,并继续在环境中积累,对水生生物和人类健康产生潜在威胁。2019年国家卫生健康委员会发布了相关国家标准GB 2763-2019《食品安全国家标准 食品中农药最大残留限量》,规定蔬菜中除虫脲和灭幼脲的最大残留量分别为0.7~10 mg·kg-1和3~30 mg·kg-1[3]。因此,有必要对蔬菜中除虫脲和灭幼脲的残留量进行控制。
农药的常用检测方法主要有液相色谱法[4-6]、气相色谱-串联质谱法[7]、液相色谱-串联质谱法[8-14],其中检测除虫脲和灭幼脲的方法主要为高效液相色谱法,且被国家标准方法采用。蔬菜基质比较复杂,测定前需要对其进行前处理,目前采用的方法主要为固相萃取法,但用其分析复杂基质样品或不同性质多农药残留时,可能引起回收率偏低。Qu ECh-ERS是一种有效的样品前处理方法,可纯化萃取物,将分析物从非常复杂的基质中分离出来,且与色谱法、质谱法具有较好的相容性,而利用QuECh-ERS-高效液相色谱法同时测定蔬菜中除虫脲和灭幼脲残留量的研究尚未见报道。鉴于此,本工作采用乙腈提取,Qu ECh ERS净化,并对吸附剂的种类和用量进行优化,用高效液相色谱法测定蔬菜样品中除虫脲和灭幼脲的残留量,可为农药用量的控制、农产品质量控制和分析检测提供科学依据。
1 试验部分
1.1 仪器与试剂
Agilent 1260型高效液相色谱仪,配备真空脱气装置、二元泵、自动进样装置和可变波长扫描紫外检测器(VWD);INESA L5S型紫外-可见分光光度计;TDL-8M 型台式高速离心机;TGL-16G 型超速冷冻离心机;WH-866型涡旋混合器;A200S型电子天平(感量0.1 mg)。
混合标准储备溶液:1 000 mg·L-1,取除虫脲和灭幼脲标准品各0.100 0 g,用乙腈溶解并定容至100 mL棕色容量瓶中,摇匀后立刻用锡箔纸将瓶身严密包裹,避光保存于暗处。
混合标准溶液:100 mg·L-1,取混合标准储备溶液10.00 mL 于100 mL 棕色容量瓶中,用50%(体积分数,下同)乙腈溶液稀释至100 mL,摇匀后立刻用锡箔纸将瓶身严密包裹,避光保存于暗处。
混合标准溶液系列:分别取0.05,0.25,0.5,1.0,2.5 mL混合标准溶液置于50 mL 棕色容量瓶中,并用50%乙腈溶液稀释至刻度,制得0.1,0.5,1.0,2.0,5.0 mg·L-1的混合标准溶液系列,用锡箔纸将瓶身包裹,避光保存于暗处。
除虫脲、灭幼脲标准品的纯度分别为98.0%,97.7%;甲醇、乙腈为农残级;试验用水为超纯水。
1.2 仪器工作条件
ZORBAX SB-C18色谱柱(150 mm×4.6 mm,5μm);柱温40℃;流动相为体积比45∶55的乙腈-水体系;等度洗脱;流量0.8 mL·min-1;检测波长256 nm;进样量20μL。
1.3 试验方法
将蔬菜样品切成小段,分取10.00 g 置于50 mL离心管中,加入10 mL 乙腈,以最大转速涡旋1 min。加入4.0 g无水硫酸镁和1.0 g氯化钠,涡旋振荡1 min,以4 000 r·min-1转速离心5 min。分取上清液1 mL 置于2 mL 离心管中,分别加入100 mg无水硫酸镁、75 mg C18,以最大转速涡旋1 min,以6 000 r·min-1转速离心2 min,上清液过0.22μm 滤膜,滤液按照仪器工作条件测定。
2 结果与讨论
2.1 流动相的选择
试验考察了分别以甲醇-水体系和乙腈-水体系为流动相时对除虫脲和灭幼脲分离效果的影响。结果表明:两者均可实现除虫脲和灭幼脲的色谱分离,而后者可以获得更好的峰形和分离度。由于提取剂为乙腈,且该提取剂对苯甲酰脲类农药提取效果较好[1]、后续净化较便捷,试验选择以乙腈-水体系为流动相。进一步考察了乙腈-水体系的体积比对除虫脲和灭幼脲分离效果的影响,结果显示,当乙腈-水的体积比为45∶55时,除虫脲和灭幼脲可实现基线分离,保留时间分别为4.981,5.963 min,混合标准溶液的色谱图见图1。
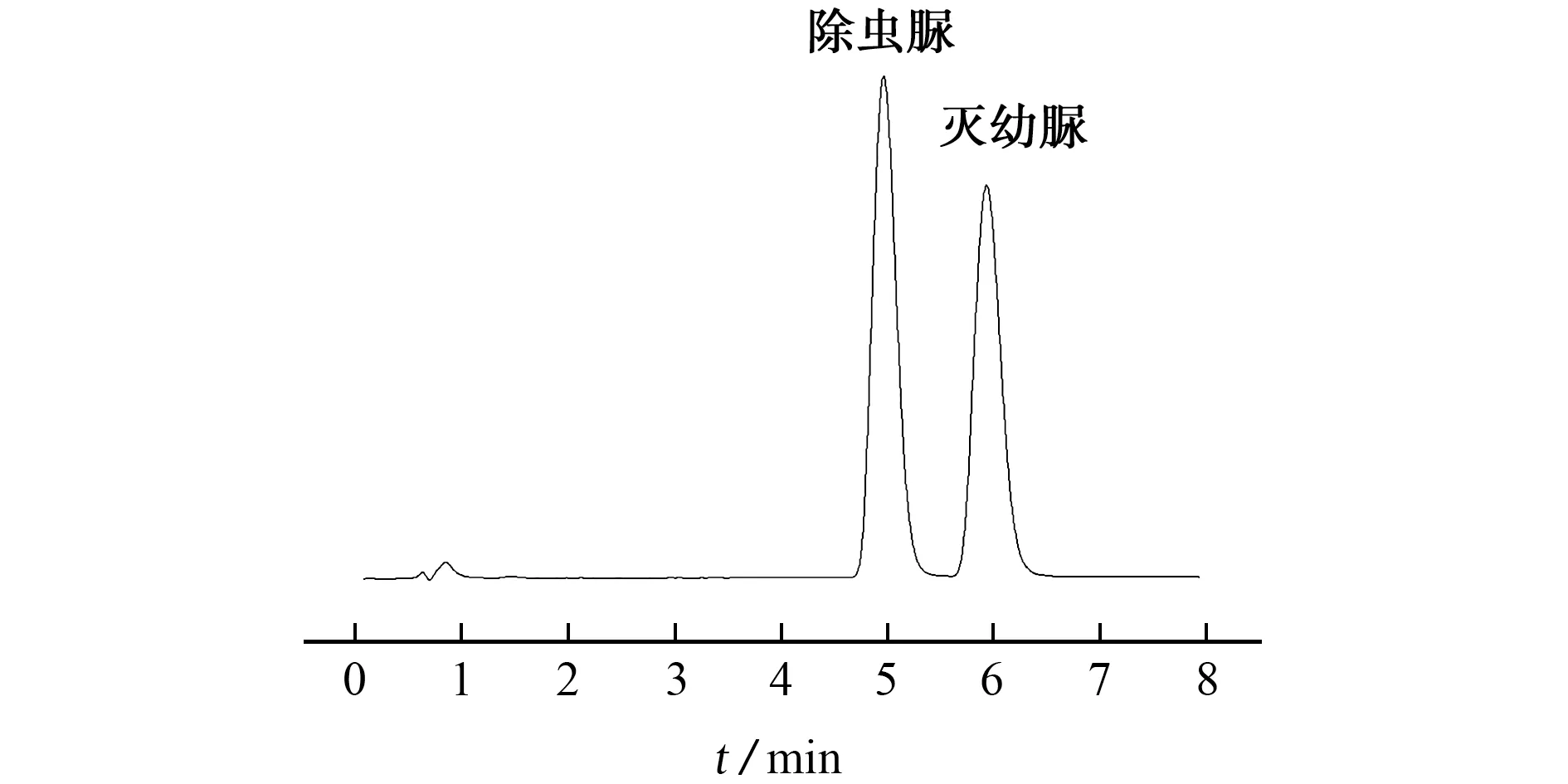
图1 混合标准溶液的色谱图Fig.1 Chromatogram of the mixed standard solution
2.2 QuECh ERS吸附剂的选择
QuECh ERS吸附剂主要起净化除杂的作用,可去除脂肪酸、蛋白质、色素和糖类化合物。本试验比较了N-丙基乙二胺(PSA)和C18的净化效果,结果见图2。

图2 分别以C18和PSA 作吸附剂时的色谱图Fig.2 Chromatograms with C18 and PSA as adsorbents
由图2可知,PSA 和C18都可使杂质和目标峰达到较好分离,而C18可以获得更高的响应值及更好的峰形和分离度。因此,试验选择C18作吸附剂。
进一步考察了C18用量分别为25,35,50,75,100 mg时对加标样品(加标量为0.5 mg·kg-1)中除虫脲和灭幼脲回收率的影响,结果如表1所示。
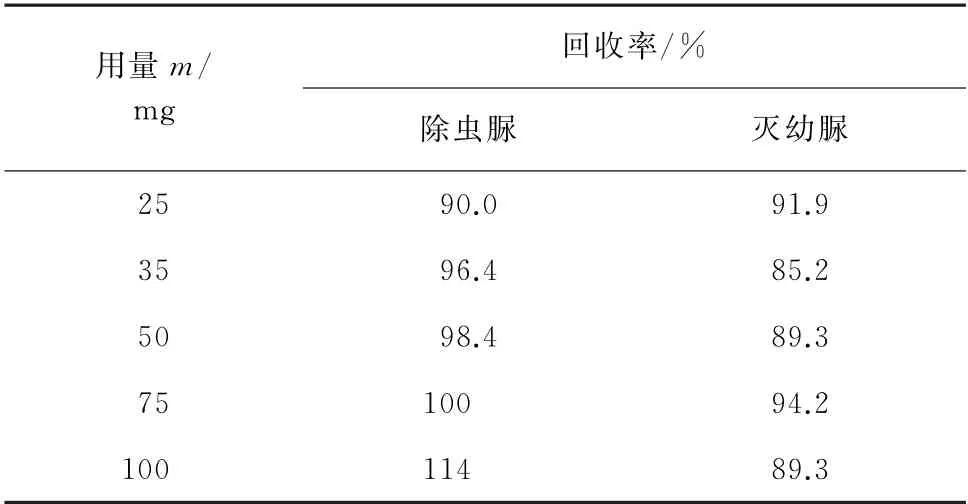
表1 不同吸附剂用量下回收试验结果Tab.1 Results of test for recovery with different amounts of adsorbent
由表1可知,不同吸附剂用量下除虫脲和灭幼脲的回收率均在80.0%以上,当C18用量为75 mg时,两者的回收率为100%和94.2%,准确度较高。因此,试验选择C18用量为75 mg。
2.3 标准曲线和检出限
按照仪器工作条件分析混合标准溶液系列,以各分析物的质量浓度为横坐标,其对应的色谱峰面积为纵坐标绘制标准曲线。结果表明,标准曲线的线性范围均为0.1~5.0 mg·L-1,线性回归方程分别为y=286.6x+1.642和y=331.3x+6.984,相关系数均为0.999 8。
以3倍信噪比(S/N)计算检出限(3S/N),除虫脲和灭幼脲的检出限分别为0.007,0.02 mg·kg-1。
2.4 精密度试验
将1.0 mg·L-1混合标准溶液于1 d内重复进样6次,按照仪器工作条件测定,计算峰面积的相对标准偏差(RSD),除虫脲和灭幼脲峰面积的RSD 分别为0.83%和1.6%。将1.0 mg·L-1混合标准溶液按照仪器工作条件连续分析6 d,所得除虫脲和灭幼脲色谱峰面积的RSD 分别为2.5%和1.8%。
2.5 回收试验
按照试验方法对结球甘蓝、菠菜、花椰菜等3种蔬菜样品进行3个浓度水平的加标回收试验,每个浓度水平平行测定3次,所得结果见表2。
由表2 可知,除虫脲、灭幼脲的回收率分别为87.4%~104%和75.3%~98.1%,满足检测要求。
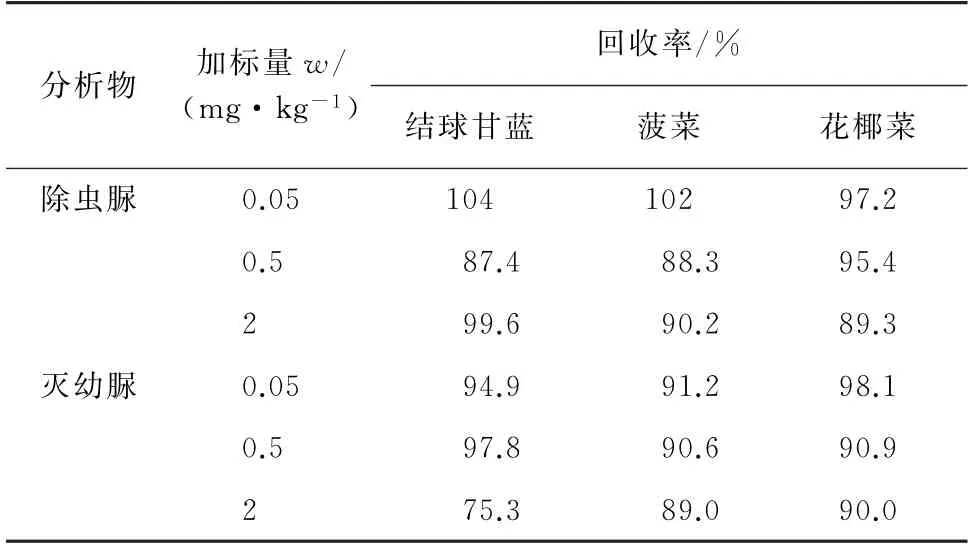
表2 回收试验结果Tab.2 Results of test for recovery
2.6 样品分析
采用本方法分析从辽宁省沈阳市的某超市和菜市场随机购买的结球甘蓝、菠菜、花椰菜等3种蔬菜共15份样品。在其中1份花椰菜样品中检出了除虫脲,检出量为0.014 mg·kg-1,低于相关标准[3-4,6]规定的除虫脲的残留限量(1 mg·kg-1)。
本工作以QuEChERS净化-高效液相色谱法同时测定蔬菜中除虫脲和灭幼脲的残留量,方法净化效果好、操作简便、准确可靠,可满足除虫脲和灭幼脲残留分析要求,并可为其他农产品中苯甲酰脲类杀虫剂的残留检测提供参考依据。

