1,2,4-三唑酰胺类转酮醇酶抑制剂的合成及除草活性研究
戴龙涛,魏汐宇,曾 荣,杨冬臣,王彦恩,,张金林
(1.河北农业大学 植物保护学院,河北 保定 071001;2.河北农业大学 理学院,河北 保定 071001)
自1941 年合成第一个除草剂2,4-D 以来,除草剂的使用在农作物生产中发挥了重要的作用,从此,氯代苯氧乙酸类化合物的发现和开发开创了有机除草剂工业的新纪元。从20 世纪50 年代到90 年代,共发现约20 种现有商品化除草剂靶标酶[1],基于这些酶开发了众多商品化除草剂。例如,PPO 抑制剂类除草剂[2],AHAS 抑制剂类除草剂[3],HPPD抑制剂类除草剂[4-5]等。但是,迄今为止,近30 年还没有发现真正意义的新作用靶标除草剂[6],目前新除草剂的生物合理设计主要还是基于现有已知的商品化除草剂靶标酶,从而获得具有除草活性的新化合物[7-8]。
由于长期频繁使用同一品种或相同靶标的除草剂,杂草对现有除草剂产生了严重地抗性,导致药效降低和使用剂量增大,并且造成恶性循环[9-10],虽然基于现有已知的商品化除草剂靶标酶,可以开发一些新的除草剂品种,但是由于其作用位点的局限性,势必加剧杂草抗性的恶化;通过混用、减少使用频率等措施仅能延缓这一过程,只有不断发现新靶标和以新靶标开发结构新颖的除草剂才是解决杂草抗性的有效途径[11-12]。
转酮醇酶是植物碳代谢和卡尔文循环中一个重要的酶[13],是植物光合速率的最大限制因子,在植物的光合作用中发挥着重要作用。一旦转酮醇酶活性受到抑制,则依赖于转酮醇酶的底物和产物的卡尔文循环、淀粉和蔗糖的合成、莽草酸盐途径和苯丙素代谢都将受到抑制。Henkes 等研究表明转酮醇酶可以作为除草剂靶标开发新型除草剂[14]。Zhao 等明确了转酮醇酶是一种新除草剂作用靶标[15-16],能够以此酶为靶标设计合成新型除草活性化合物。但是,目前具有良好除草活性的转酮醇酶抑制剂还很少[17-19],因此,以转酮醇酶为靶标开发更高活性、结构新颖的新型除草剂具有重要的研究意义。
本课题组一直致力于开发以转酮醇酶为靶标的除草活性化合物的研究,最近,本课题组研究发现了一种具有高效除草活性的1,2,4-三唑席夫碱类转酮醇酶抑制剂5aw[7],荧光淬灭研究表明,化合物5aw 与转酮醇酶之间形成了稳定受体-配体络合物,进而导致化合物对转酮醇酶具有更强的抑制作用[7,20]。
本研究采用骨架跃迁策略和活性亚结构拼接方法对先导化合物5aw 进行结构优化,在保留5aw 核心骨架不变得情况下,通过酰胺键和硫醚键将1,2,4-三唑、噻吩、嘧啶、苯氧乙酸等活性基团拼接,设计合成了系列1,2,4-三唑酰胺类除草活性化合物8(a-e)。以双子叶杂草反枝苋和单子叶杂草马唐为供试植物,采用小杯法测试目标化合物的除草活性,然后利用荧光结合实验研究化合物对拟南芥转酮醇酶的抑制活性,以期筛选出更高活性和更高选择性的转酮醇酶抑制剂类除草活性化合物,为开发出新型除草剂奠定基础。
1 材料与方法
1.1 试验材料
BRUKER AC-P400(400 MHz)核磁共振波谱仪(CDCl3 或DMSO-d6 为溶剂,TMS 为内标);FTICR-MS (Ionspec 7.0T)型质谱仪,ESI 离子源;北京瑞利公司生产WQF510/520A 傅立叶变换红外光谱仪;深圳环宇测技术有限公司 X-4 精密显微熔点测定仪,上海黎鑫科学仪器有限公司;RF-5301PC 荧光分光光度计,试验过程中所用其他化学试剂均为分析纯,水为二次蒸馏水。
供试杂草:反枝苋(Amaranthus retroflexus)和马唐(Digitaria sanguinalis)均由河北农业大学植物保护学院农药系提供。
1.2 目标化合物的合成
将噻吩-3-甲酸甲脂1 与水合肼发生酰胺化反应生成噻吩-3-酰肼2,在氢氧化钾的乙醇溶液中与CS2反应,粗产物继续与水合肼发生反应,得到4-氨基-5-巯基化合物3。将3 与2-氯-嘧啶4 发生亲核取代反应,粗产物通过柱层析法分离纯化得到化合物5。然后中间体5 与酰氯化合物7 发生酰胺化反应,通过柱纯化得到目标化合物8(a-e)。具体合成步骤如下(见图1):
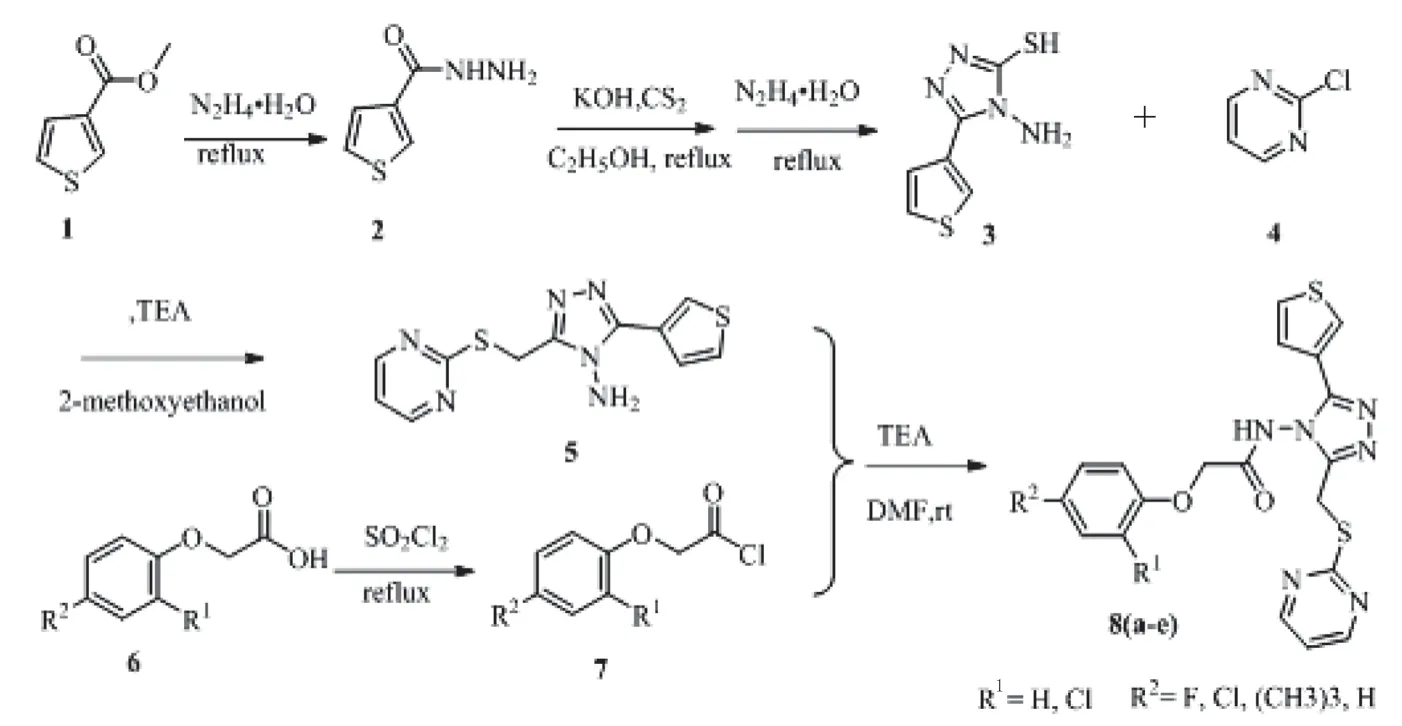
图1 1,2,4-三唑酰胺类除草活性化合物8(a-e)的合成路线Fig. 1 Synthesis route of 1,2, 4-triazolamides herbicidal active compound 8(a-e)
1.2.1 噻吩-3-酰肼2 的合成 3-噻吩甲酸甲酯1(0.5 mL,0.004 1 mol)与0.60 mL 的 80%水合肼在回流状态下发生反应, TLC 监测反应进程,反应约5 h 后,停止反应,冷却至室温,减压旋蒸除去剩余水合肼,干燥,得到粗产品即为噻吩-3-酰肼2,收率100%。
1.2.2 4-氨基-5-巯基化合物3 的合成 在(0.46 g,0.008 2 mol)KOH 的无水乙醇溶液中,加入0.004 1 mol 芳(杂)环酰肼2,在冰浴条件下,向上述溶液中逐滴滴入(0.74 mL,0.012 3 mol)CS2溶液,加热升温至回流,TLC 监测反应进程,反应结束后,减压旋蒸溶剂,粗产品为芳(杂)环-3-恶二唑巯基的钾盐,将此钾盐在3 mL 80%水合肼溶液中回流,反应约4 h, 然后,将反应液倒入200 mL 冰水中溶解,使用10% HCl 调节溶液pH≈5,生成黄色沉淀,减压抽滤,所得固体在真空干燥箱干燥,得到4-氨基-5-巯基-1, 2, 4-三唑类化合物3,收率82%。
1.2.3 中间体5 的合成 取干燥的烧瓶,依次加入适量的乙二醇甲醚溶剂,(634 mg,0.003 2 mol)化合物3,(0.366 4 g,0.003 2 mol)2-氯嘧啶和(0.89 mL,0.006 4 mol)三乙胺,加热至回流反应,TLC 监测反应至结束,加入100 mL 的二氯甲烷溶解,使用饱和食盐水洗涤,萃取分离,无水硫酸钠干燥有机层,减压抽滤,减压旋蒸溶剂,粗产品用柱层析法纯化,得到目标产物5,洗脱剂配比为二氯甲烷∶乙酸乙酯=30 ∶1,收率70%。
1.2.4 目标化合物8(a-e)的合成 在冰浴条件下,将一定体积的氯化亚砜,逐滴滴入苯氧乙酸6(a-e)的无水乙腈溶液中,然后,加热至回流反应,反应结束后,生成苯氧乙酰氯,旋蒸除去溶剂;然后,在冰浴条件下,将苯氧酰氯7(a-e)的无水二氯甲烷溶液,逐滴滴入到三乙胺和DMAP 的无水二氯甲烷溶液中,室温条件下,TLC 监测反应进程,反应结束后,在反应液加入约100 mL 的二氯甲烷溶剂,使用饱和食盐水洗涤(75 mL×3),萃取分离,有机层用无水硫酸钠干燥,减压抽滤,减压旋蒸溶剂,粗产品进一步柱层析,提纯得到目标化合物8(a-e),洗脱剂配比为石油醚∶乙酸乙酯=5∶1 ~3∶1。
1.3 采用小杯法测试化合物的除草活性
根据文献报道方法[7,18],采用小杯法测试化合物的生物活性,马唐和反枝苋为供试植株。以DMF为溶剂,分别将目标化合物8(a-e) 和丙炔氟草胺(阳性对照)配成浓度为20 g/L 的供试物储备液。取0.01 mL 的供试物储备液用灭菌水稀释至1 mL,配成浓度为200 mg/L 的待测溶液,空白对照是不含药剂的空白溶液。
将供试植物反枝苋和马唐种子清水浸泡24 h,置于25 ℃培养箱中催芽至露白,选取大小一致的种子10 颗置于小烧杯中。移取1 mL 供试物溶液或空白对照溶液缓缓加入到小烧杯中,用保湿膜覆盖小烧杯并在保湿膜上随机扎孔,以保证透气性。将小烧杯置于24 ~ 26 ℃的光照培养箱中培养。7 d 后测定供试植株的根长和茎长,评价目标化合物对马唐和反枝苋的抑制活性。
1.4 荧光结合实验
为了研究这些目标化合物对TK 酶的抑制活性,在0.01 mol/L DMF/磷酸盐缓冲液(PBS)中进行化合 物(c= 0 ~ 20 mg/L) 与At TKL (0.35 mg/mL) 的荧光结合实验,并在F-4500 荧光分光光度计上进行。在比色皿中加入转酮醇酶蛋白 2 mL,逐滴向比色皿中加入 2 μL 事先配置好的一定浓度的化合物溶液,混合均匀,并于恒温水浴中恒温 2 min,然后迅速进行荧光实验的测量,转酮醇酶的荧光猝灭实验于250 nm 激发波长激发,最大发射波长为336 nm,记录 250 ~450 nm 波长范围的荧光光谱,激发与发射狭缝均为 5 nm。试验前,所有反应组分在30 ℃下预平衡20 min;最后使用 Origin 软件拟合求荧光结合常数 Ka 值。根据Ka 值大小和荧光强度或峰位移变化,初步分析化合物与转酮醇酶的相互作用。
2 结果与分析
2.1 目标化合物结构表征
本试验基于除草剂新靶标转酮醇酶,根据农药分子合理设计原理,设计合成5 个1,2,4-三唑酰胺类化合物8(a-e),所有化合物均经IR、MS 和1H NMR 分析验证,其理化数据和结构表征如下(见表1):
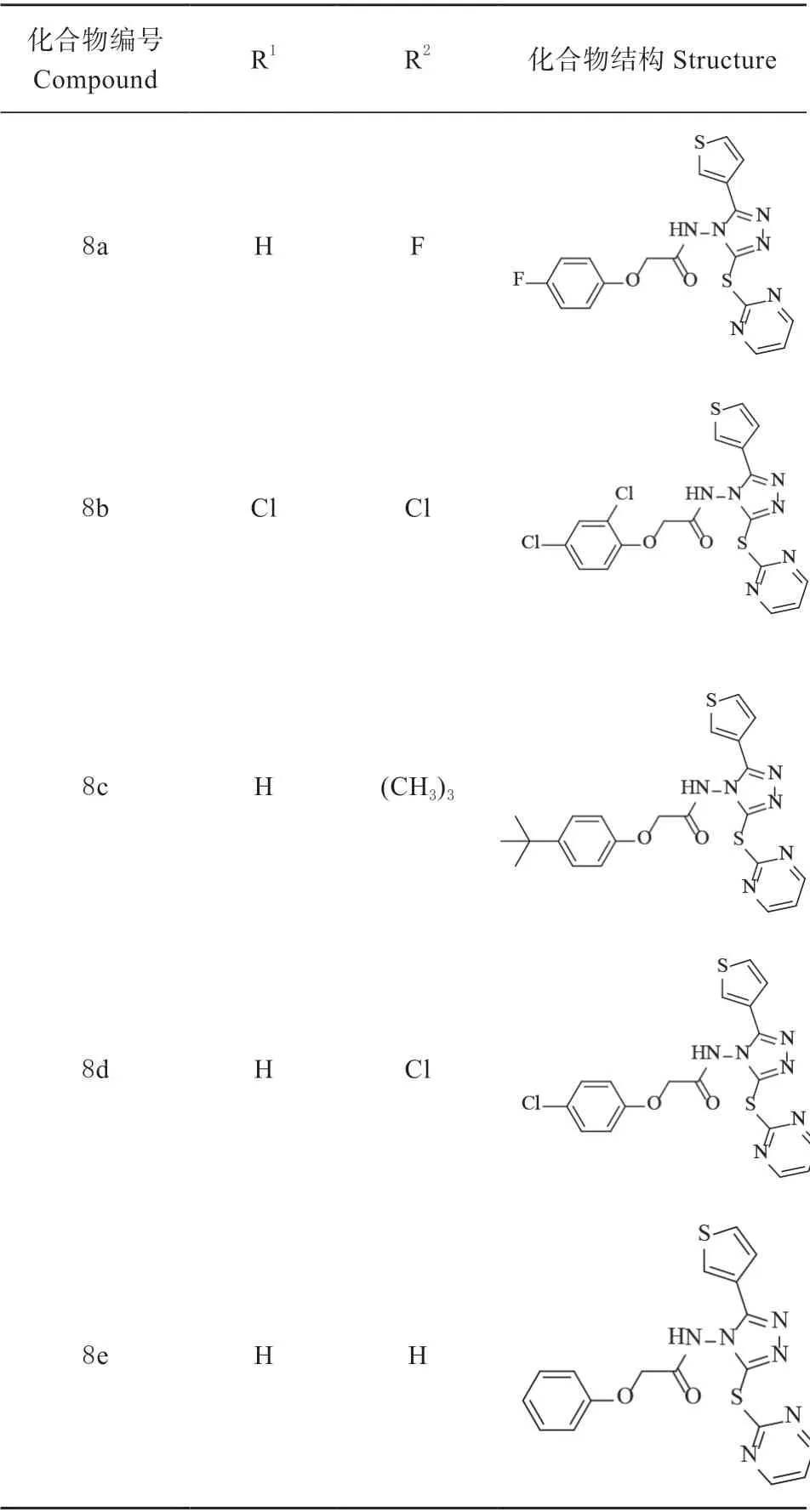
表1 1,2,4-三唑酰胺类除草活性化合物8(a-e)结构Table 1 Structure of 1,2, 4-triazolamide herbicidal active compounds 8(a-e)
化合物8a,淡黄色固体,产率26.6%, m.p. :199.1 ~200.0 ℃;1H NMR (CD3OD, 400 MHz): δ 8.53 -8.52 (m, 1H), 7.69 (d, J = 4.0 Hz, 1H), 7.54 (dd,J = 4.2 Hz, 2H), 7.02-6.92 (m, 7H), 4.76 (s, 2H); IR(KBr) ν: 3381 (N-H), 1638 (C =O) cm-1; MS (ESI)m/z 429.06 ([M+H]+)。
化合物8b,淡黄色固体,产率12.0%, m.p.:204.9 ~205.5 ℃;1H NMR (CD3OD, 400 MHz): δ 8.52 (d, J = 1.6 Hz, 2H), 7.70 (d, J = 4.8 Hz, 2H), 7.54(dd, J = 3.2 Hz, 2H), 7.45-6.95 (m, 3H), 4.76 (s, 2H);IR (KBr) ν: 3385 (N-H), 1636 (C =O) cm-1; MS(ESI) m/z 478.96 ([M+H]+)。
化合物8c,淡黄色固体,产率21.9%, m.p. :204.9 ~205.3 ℃;1H NMR ((CD3)2SO, 400 MHz):δ 8.43-8.42 (m, 2H), 7.71-7.69 (m, 2H), 7.62-7.61(m, 2H), 7.25 (d, J = 8.0 Hz, 2H), 6.82-6.76 (m, 2H),5.74 (s, 2H), 1.23 (s, 9H); IR (KBr) ν: 3384 (N-H),1639 (C =O) cm-1; MS (ESI) m/z 467.57 ([M+H]+)。
化合物8d,淡黄色固体,产率24.8%, m.p. :194.3 ~195.1 ℃;1H NMR ((CD3)2SO, 400 MHz):δ 8.43 (d, J = 1.6 Hz, 2H), 7.70-7.61 (m, 5H), 7.29(d, J = 8.8 Hz, 2H), 6.91 (d, J = 8.8 Hz, 2H), 5.82 (s,2H); IR (KBr) ν : 3385 (N-H), 1636 (C =O) cm-1;MS (ESI) m/z 468.06 ([M+Na]+)。
化合物8e,淡黄色固体,产率44.4%, m.p. :187.6 ~189.0 ℃;1H NMR ((CD3)2SO, 400 MHz):δ 8.44-8.43 (m, 1H), 7.69-7.61 (m, 8H), 7.29 (t, J =8.0 Hz, 1H), 6.97 (d, J = 8.8 Hz, 2H), 5.82 (s, 2H); IR(KBr) ν: 3383 (N-H), 1637 (C =O) cm-1; MS (ESI)m/z: 433.10 ([M+Na]+)。
2.2 小杯法测定目标化合物的除草活性
采用小杯法测试了化合物8(a-e)对双子叶杂草反枝苋和单子叶杂草马唐的除草活性,以商品化除草剂丙炔氟草胺为阳性对照。如表2 所示,在浓度为200 mg/L 时,化合物8(a-e)对反枝苋和马唐的根茎抑制率都大于80%,表明它们对反枝苋和马唐具有良好的除草活性,其中,化合物8b 和8d 具有最好的除草活性,对反枝苋和马唐的根茎抑制率达到90%以上,具有比丙炔氟草胺更优异的除草活性,尤其是8b 对马唐和反枝苋的根茎抑制率达到了95%以上,在所有化合物中具有最高的除草活性。根据除草活性测试结果,对目标化合物的构效关系进行了初步研究,结果表明R1和R2取代基对化合物的除草活性具有很明显的影响,不同取代基化合物的除草活性顺序如下:2,4-Cl>4-Cl>4-F>4-(CH3)3>H。所设计的目标化合物具有良好的除草活性,1,2,4-三唑酰胺分子骨架适用于除草活性分子设计,氯原子取代基更有利于提高化合物的除草活性。
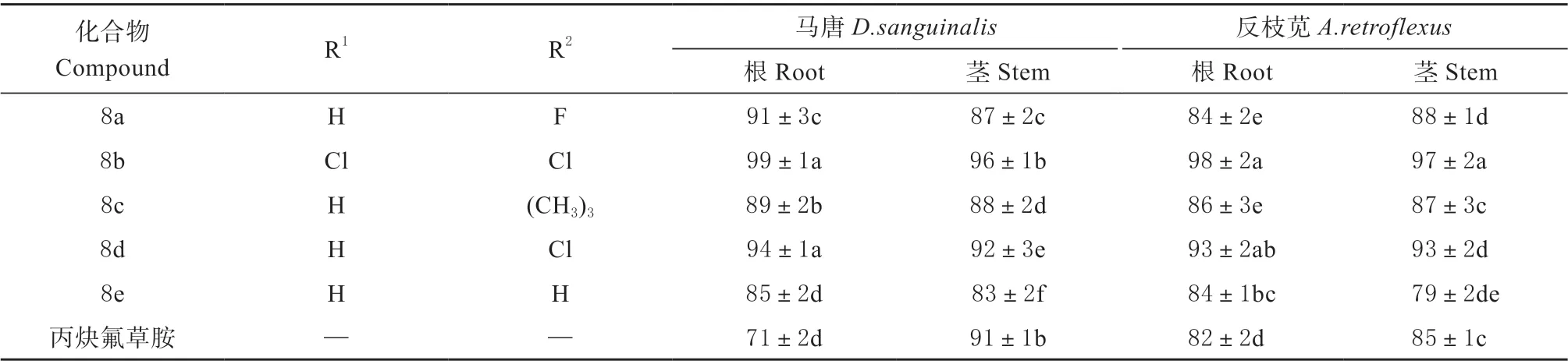
表2 目标化合物8 (a-e)的除草活性(小杯法,抑制率/%)Table 2 Structure and herbicidal activity of compounds 8(a-e) at 200 mg/L(small cup method,inhibition rate%)
2.3 荧光结合实验
为了研究目标化合物对转酮醇酶的抑制活性,在0.01 mol/L DMF/PBS 混合溶液中测试了拟南芥转酮醇酶与化合物8b,8d 和8e 的荧光结合实验,其中拟南芥转酮醇酶的浓度固定为 0.35 g/L, 随后逐渐增大目标化合物的浓度(c = 0 ~20 mg/L)。如图2所示,在加入目标化合物之前,拟南芥转酮醇酶呈现了较强的荧光,当在上述溶液中分别加入化合物8b,8d 和8e 后,体系的荧光强度会发生不同程度的降低,随着溶液中化合物的浓度逐渐增大,荧光强度降低更加显著。
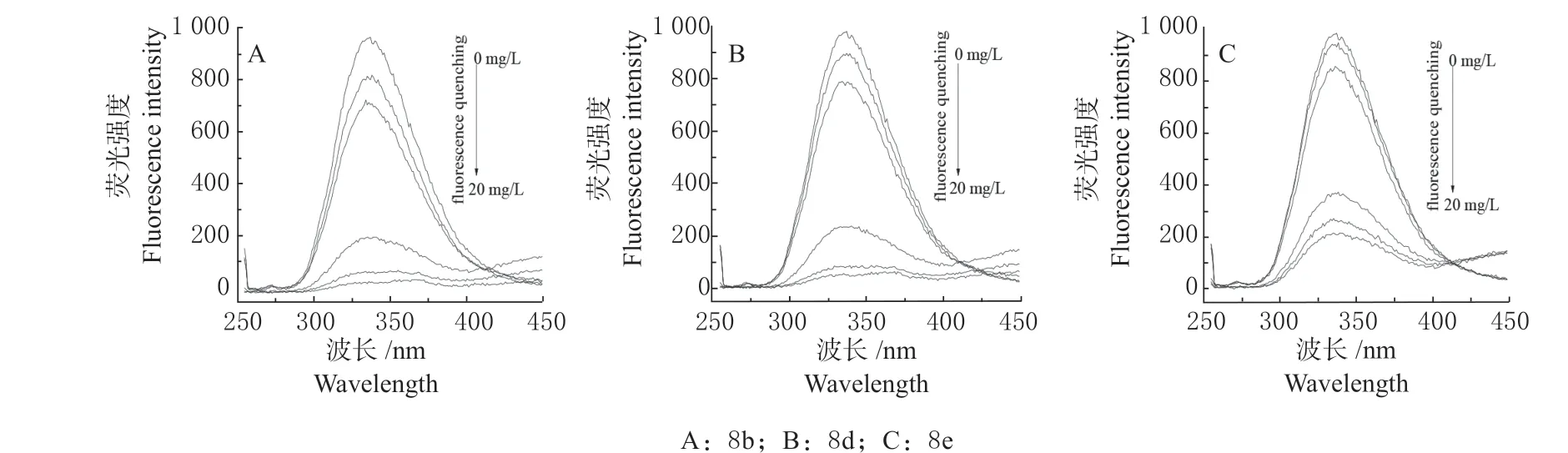
图2 拟南芥转酮醇酶(0.35 mg/mL)与不同浓度化合物结合的荧光光谱变化(λex = 250 nm, λem = 336 nm)Fig. 2 Fluorescence spectra change of At TK (0.35 mg/mL) with different concentrations of compound (λex = 250 nm, λem = 336 nm)
当在体系中分别加入相同量的化合物8b,8d 时,转酮醇酶的荧光强度会发生显著的降低,这表明化合物8b,8d 与拟南芥转酮醇酶具有更强的亲和力,这可能是由于它们分别与转酮醇酶形成了更稳定的络合物,所以能够更强结合转酮醇酶。但是,当在体系中加入相同量化合物8e 时,转酮醇酶的荧光强度降低程度较小,表明化合物8e 与转酮醇酶亲和力较弱,与此酶发生了弱结合。化合物8b,8d 与转酮醇酶形成了更稳定络合物,进一步导致它们对此酶产生更强的抑制活性和更强的结合亲和力[7,20],并且化合物8b,8d 对测试杂草具有最高的除草活性,因此,化合物8b 和8d 有潜力作为新型转酮醇酶抑制剂类除草活性先导化合物,可以继续对其进行结构优化。
3 讨论与结论
杂环类化合物具有毒性低、活性高、用量少、选择性好等特点[12,21],被广泛应用于新农药创制,其中噻吩、1,2,4-三唑、嘧啶都是非常重要的杂环,例如,壬基氯是一种含有噻吩部分的除草剂,能够有效防除水稻、大豆和其他作物农田的多种杂草[23]。酰胺和硫醚是具有良好生物活性的官能团[7,17],因此,本研究基于除草剂新靶标转酮醇酶,根据农药分子合理设计原理对前期发现的转酮醇酶抑制剂5aw 进行了结构优化,通过酰胺键和硫醚键将噻吩、嘧啶、苯氧乙酸等活性亚结构拼接,设计合成了5个1,2,4-三唑酰胺类化合物8(a-e)。在化合物的合成过程中,酰氯中间体化学性质极为活泼,与含有质子氢的物质接触就会立即发生反应,因此,中间体酰氯与胺类化合物必须在无水二氯甲烷或乙腈等非质子性溶剂中发生反应,才能合成得到目标化合物1,2,4-三唑酰胺类化合物8(a-e)。
为了兼顾田间危害情况和生物学分类,本试验选取禾本科杂草马唐和阔叶杂草反枝苋为供试植株[7],活性测试结果表明,8b 和8d 对马唐和反枝苋的根茎抑制率达到90%以上,除草活性明显优于对照药剂丙炔氟草胺,因此,1,2,4-三唑酰胺是具有良好除草活性的分子骨架,氯原子取代基有利于提高化合物的除草活性。荧光结合实验表明,化合物8b,8d 与拟南芥转酮醇酶亲和力更高,这可能是由于它们分别与转酮醇酶形成了更稳定的络合物,从而导致它们对此酶产生更强的抑制活性和结合亲和力[7,20],因此,化合物8b 和8d 有潜力作为转酮醇酶抑制剂类除草活性先导化合物,值得进一步结构优化。

