玉米转录因子ZmMYC7 对ZmLOX9 的调控作用研究
李 薇,张玮煜,庞 茜,刘鹏飞,张 康,邢继红,曹宏哲,董金皋
(华北作物改良与调控国家重点实验室/河北省植物生理与分子病理学重点实验室,河北农业大学,河北 保定 071000)
茉莉酸(JA)被认为是植物应对生物和非生物胁迫防御反应的重要激素[1]。在JA 信号通路中,JA 引起的主要信号转导过程基本上都和bHLH 转录因子有关[2]。MYC2 是其中研究的最透彻的,而且被认为是JA 信号通路中的核心原件[3]。水稻OsMYC2 具有调节光依赖性幼苗表型,影响水稻抵抗白叶枯病菌(Xanthomonas oryzae)的能力[4-5]。番茄SlMYC2 在MeJA 诱导的果实抗病和抗氧化过程中都发挥着正调控作用[6]。草莓FaMYC2 在MeJA 诱导的果实花青素和木质素积累中起到正调控作用[7]。MYC2 对于JA 信号途径中次生代谢物积累的调控也是必不可少的,如TcMYC2a 在中国红豆杉中转导JA 信号并调节紫杉醇生物合成[8]。
转录因子MYC2 通过调控JA 信号通路中各种基因的表达来行使其功能。拟南芥中,AtMYC2 可以调控抗病相关基因PDF1.2、CHIB、PR4、ORA59等的表达,进而影响植物对病原菌的防御反应[3,9]。柑桔PtrMYC2 通过转录调节PtrBADH-1来调节冷诱导的甘氨酸甜菜碱合成[10]。烟草中NtMYC2 通过识别尼古丁生物合成基因的启动子区域G-box 元件从而介导尼古丁生物合成[11]。
脂氧合酶(Lipoxygenase,LOX)属于氧化还原酶,是JA 合成途径中的关键酶,广泛参与植物的生长、发育以及应对生物和非生物胁迫[12]。在番茄中的研究证实,受到外伤后番茄SlMYC2 通过直接作用于TomLoxD启动子G-box 元件,进而激活TomLoxD基因的表达[13]。本实验室前期研究发现,玉米ZmMYC7 在调控玉米抵抗禾谷镰孢(Fusarium graminearum)侵染中发挥重要的作用,但是其调控机制尚未明确。生物信息学分析发现,玉米ZmLOX9的启动子包含G-box 元件,推测ZmLOX9有可能是ZmMYC7 的直接靶基因。因此,本研究利用qRT-PCR 技术和酵母单杂交技术,对玉米JA信号途径关键转录因子ZmMYC7 与ZmLOX9关系进行研究,以期为阐明ZmMYC7 对ZmLOX9基因的调控关系奠定基础。
1 材料和方法
1.1 试验材料
玉米自交系B73、酵母单杂交载体pGADT7 和pAbAi、大肠杆菌感受态Trans 5α、酵母菌株Y1H Gold 由河北省植物生理与分子病理学重点实验室/河北农业大学真菌毒素与植物分子病理学实验室保存并提供。ZmMYC7的EMS 诱变突变体myc7-80-9、myc7-80-12、myc7-76-8由中国农业科学院生物技术研究所张春义教授和齐鲁师范学院路小铎教授提供。禾谷镰孢PH-1 菌株由南京农业大学周明国教授提供。玉米种子无菌水浸湿24 h,在河北农业大学实验田中播种和生长。
1.2 生物信息学分析
玉 米ZmLOX9(Gene ID:Zm00001d027893)序列由MaizeGDB 网站(https://www.maizegdb.org/)下载,使用NCBI 在线Blast 工具(https://blast.ncbi. nlm.nih.gov/Blast.cgi)查找其同源基因。利用MEGA7.0软件进行序列的多重比对并构建系统进化树。利用PlantCARE 网 站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对ZmLOX9基因启动子进行顺式作用元件分析。
1.3 玉米茎部禾谷镰孢接种
将禾谷镰孢接种在CMC 培养基上,28 ℃培养5 d 后,收集禾谷镰孢的分生孢子制备悬浮液(106个/mL)。将分生孢子悬浮液(50 μL)注射于6 叶期的自交系B73 和ZmMYC7突变体的茎基部。分别在0、1、2、3 d 取样,液氮速冻后,-80 ℃保存备用。
1.4 RNA 提取与qRT-PCR 分析
使用OMEGA Plant RNA Kit 提取自交系B73和ZmMYC7突变体接种样品的总RNA,使用M5 Sprint qPCR RT kit with gDNA remover 进行反转录合成其cDNA。使用ZmLOX9的qRT-PCR 特异性引物(见表1),以自交系B73 和ZmMYC7突变体植株的cDNA 为模板,按照2X M5 HiPer SYBR Premix EsTaq 说 明 书 进 行qRT-PCR 分 析。qRTPCR 程 序 为95 ℃ 15 s 变 性,56 ℃ 20 s 退 火,72 ℃ 45 s 延伸,45 个循环。每个qRT-PCR 单独重复3 次。

表1 qRT-PCR 特异性引物Table 1 Specific primers used in qRT-PCR
1.5 酵母单杂交载体(Y1H)构建
以玉米B73 cDNA 为模板,利用特异性引物扩增ZmMYC7基 因CDS 序 列(2 118 bp),PCR 产物回收后与克隆载体pCR8 连接,连接产物转化大肠杆菌感受态Trans 5α,阳性克隆鉴定后,与酵母单杂交载体pGADT7 进行同源交换重组,得到ZmMYC7-pGADT7 载体。利用ZmLOX9启动子的特异性引物对ZmLOX9启动子(561 bp)进行扩增,扩增产物回收后与克隆载体pMD19-T 连接,连接产物转化大肠杆菌感受态Trans 5α,阳性克隆鉴定后,pLOX9-pMD19-T 和pAbAi 载体分别酶切后连接,得到pLOX9-pAbAi 载体。利用同样的方法,进行ZmLOX9启动子G-box 的单碱基突变载体pLOX9(m)-pAbAi 和G-box 敲 除 载 体pLOX9(ΔGbox)-pAbAi 的构建。
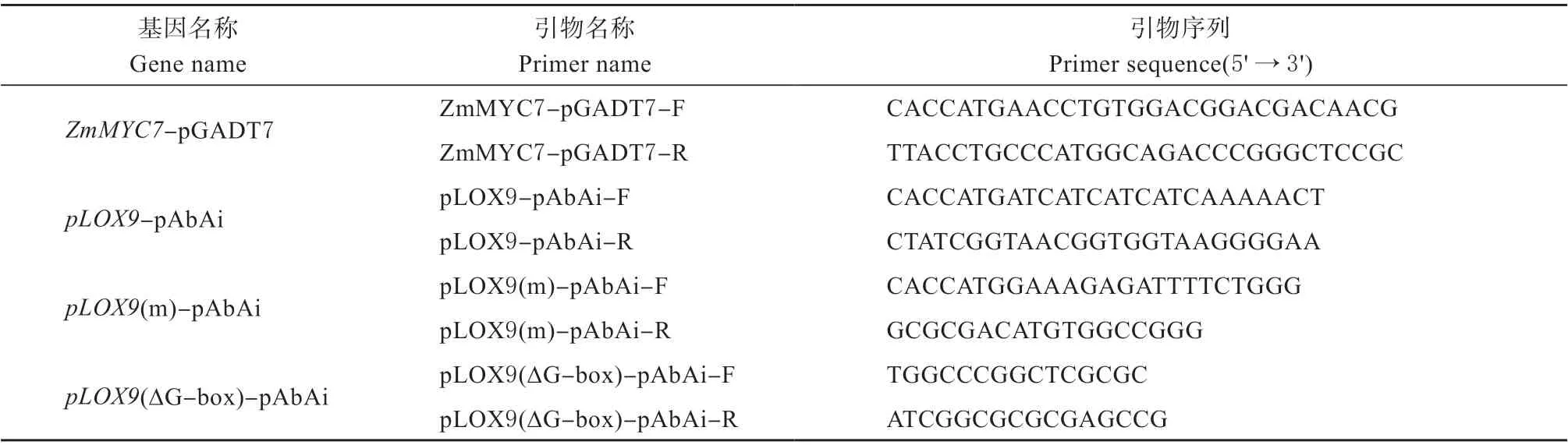
表2 酵母单杂交载体构建所用引物Table 2 Primers used in yeast one-hybrid
1.6 酵母单杂交(Y1H)试验
对pLOX9-pAbAi、pLOX9(m)-pAbAi、pLOX9(ΔG-box)-pAbAi 和pAbAi 质 粒 进 行Bstb I单酶切并纯化酶切产物。将纯化的酶切产物与ZmMYC7-pGADT7 质粒两两组合共转Y1H Gold 酵母感受态细胞,转化产物涂布于SD/-Leu 缺陷培养基上,28 ℃培养2 ~3 d 后长出单菌落。挑取各组合的单菌落进行扩大培养至OD600≈0.1 后,梯度稀释10 倍、100 倍,点于含200 ng/mL 金担子素A(AbA)的SD/-Leu 缺陷培养基上,28 ℃培养3 ~4 d,观察菌落生长情况。
2 结果与分析
2.1 玉米ZmLOX9 的系统进化分析
玉 米ZmLOX9(Gene ID:Zm00001d027893)位于1 号染色体16 843 797 ~16 850 001 bp 处,包括8 个外显子,7 个内含子,转录本全长为950 个氨基酸残基。将玉米ZmLOX9 的氨基酸序列输入NCBI 进行Blast,利用MEGA7.0 软件将查找到的同源序列构建系统发育树。发现ZmLOX9 与高粱(Sorghum bicolor)的SbLOX6 相似度最高,序列一致性达到99%(图1)。
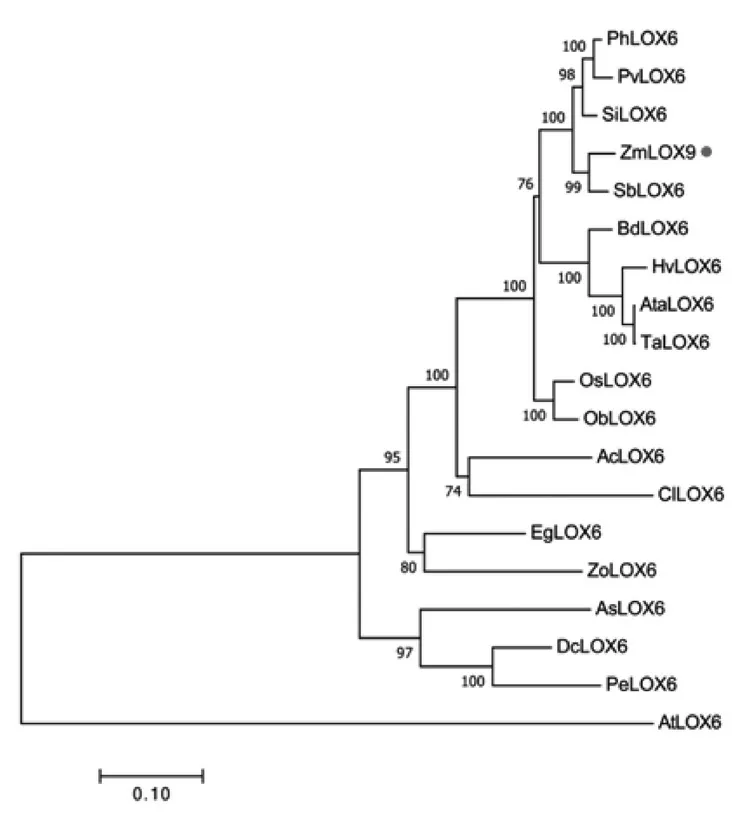
图1 ZmLOX9 系统进化分析Fig.1 Phylogenetic analysis of ZmLOX9
2.2 玉米ZmLOX9 启动子顺式作用元件分析
利用PlantCARE 网站对ZmLOX9基因启动子(561 bp)进行顺式作用元件分析。结果发现,ZmLOX9启动子区域含有MYC 转录因子结合的关键基序G-box(图2 红色箭头),由此推测,ZmLOX9基因可能受转录因子ZmMYC7的直接调控。除此之外,ZmLOX9启动子区域还含有启动子核心元件TATA-box,逆境相关元件STRE、MYB、DRE core,ABA 响应元件ARE,分生组织表达相关元件CAT-box(图2),说明ZmLOX9可能在玉米的防御和抵抗逆境过程中发挥作用。
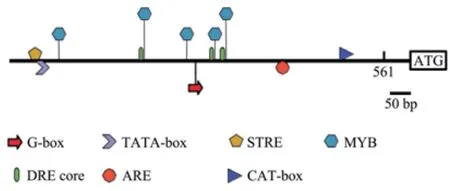
图2 ZmLOX9 启动子顺式作用元件分析Fig.2 Analysis of cis-elements in ZmLOX9 promoter
2.3 ZmMYC7 突变影响ZmLOX9 的表达
利 用qRT-PCR 技 术, 检 测ZmMYC7突 变 体myc7-80-9、myc7-80-12和myc7-76-8接 种 禾 谷 镰 孢后ZmLOX9基因的表达情况。结果发现,自交系B73中ZmLOX9基因的表达量随接种时间的延长呈显著上调,而在myc7-80-12、myc7-76-8突变体中ZmLOX9的表达量一直维持在较低水平,且显著低于自交系B73。myc7-80-9突变体中ZmLOX9的表达量在0 d时高于B73,但接菌之后明显降低,其基因表达趋势与自交系B73 明显不同(图3)。这一结果说明ZmMYC7的突变在很大程度上抑制了ZmLOX9的表达,表明ZmMYC7 正调控ZmLOX9基因的表达。

图3 ZmMYC7 突变体中ZmLOX9 表达分析Fig.3 Relative expression levels of ZmLOX9 in ZmMYC7 mutants
2.4 ZmMYC7 与ZmLOX9 的酵母单杂交(Y1H)载体构建
以玉米B73 cDNA 为模板,利用特异性引物扩增ZmMYC7基因CDS 序列(2 118 bp),利用Gateway 技术进行ZmMYC7-pGADT7 载体的构建,双酶切验证获得了目的条带,表明载体构建成功(图4A、B)。以pLOX9特异性引物进行ZmLOX9启动子(561 bp)片段的扩增,利用双酶切技术进行靶基因pLOX9-pAbAi 酵母单杂交载体的构建。同时,利用双酶切技术进行ZmLOX9启动子G-box 的单碱基突变载体pLOX9(m)-pAbAi 和G-box 敲除载体pLOX9(ΔG-box)-pAbAi 的构建(图4C、D)。
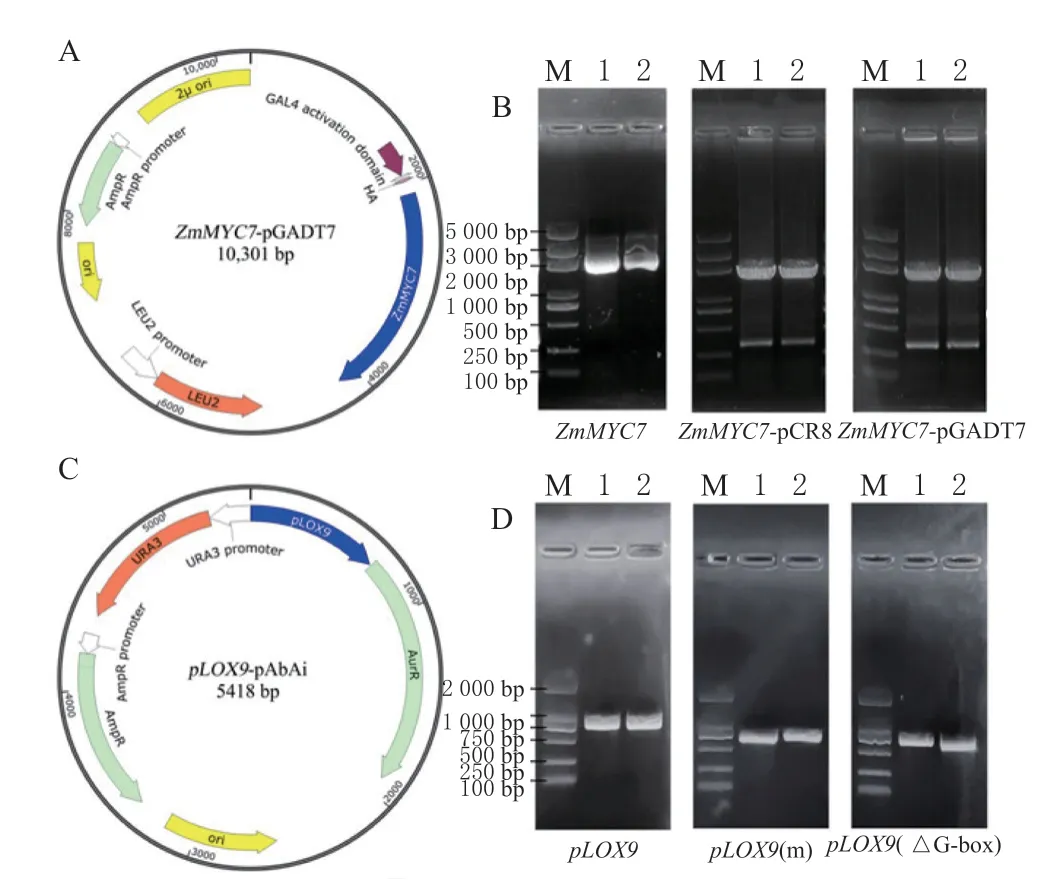
图4 ZmMYC7 与ZmLOX9 的酵母单杂交载体构建Fig.4 Construction of Y1H vectors of ZmMYC7 and ZmLOX9
2.5 酵母单杂交(Y1H)验证ZmMYC7 识别ZmLOX9启动子
利用酵母单杂交试验, 检测ZmMYC7 对ZmLOX9基因启动子区G-box 元件的结合作用。结 果 发 现, 共 转 化pLOX9-pAbAi 与ZmMYC7-pGADT7 组合的酵母可以在含AbA 的SD/-Leu 缺陷培养基上正常生长,而ZmLOX9启动子G-box的单碱基突变载体pLOX9(m)-pAbAi、G-box 敲除载 体pLOX9(ΔG-box)-pAbAi 以 及 空 载 体pAbAi与ZmMYC7-pGADT7 的组合均不能在含AbA 的缺陷培养基上生长(图5)。这一结果表明在酵母中ZmMYC7 可以结合ZmLOX9基因的启动子区,并且这一结合作用依赖于ZmLOX9基因启动子区的G-box 元件,同时说明了ZmLOX9是ZmMYC7 的直接下游靶基因。

图5 酵母单杂交验证ZmMYC7 结合ZmLOX9启动子的G-boxFig.5 ZmMYC7 interacts with the G-box of ZmLOX9 promoter by Y1H assay
3 讨论与结论
JA 在植物生长、发育以及防御应答过程中起着至关重要的作用。转录因子MYC2 是植物JA 信号网络调控的关键位点,MYC2 属于bHLH 类转录因子家族成员[14],在MYC2 氨基酸序列C 端存在bHLH 结构域,由15 ~20 个碱性氨基酸组成,可识别其靶基因启动子中的G-box(5'-CACGTG-3')和G-box 变体,并调节JA 通路的不同分支[15]。在拟南芥中,AtMYC2 负调控ERF1和ORA59,进而抑制防御相关基因PDF1.2的表达[14,16,17]。番茄中,MYC2 通过直接调控转录因子ERF.C3,进一步上调病原菌响应标记基因PR-SH2[18]。ZmMYC2过表达的拟南芥植株对灰葡萄孢的抗性显著提高,表明ZmMYC2 可能参与植物的抗病过程[19]。本实验室前期研究发现,玉米中的MYC2 同源基因ZmMYC7在玉米抵抗禾谷镰孢侵染过程中发挥重要的调控作用,但是ZmMYC7 调控玉米抗病的机制尚未明确。
脂氧合酶(Lipoxygenase,LOX)又名脂肪氧化酶[20],广泛存在于植物体中,参与多种代谢活动[21]。脂氧合酶是一类重要的含非血红素铁的蛋白,在植物不同发育阶段存在着不同的类型,可参与催化脂质降解,调控营养器官生长等生理生化反应。如AtLOX3 和AtLOX4 是拟南芥育性和花朵发育所必需的[22],MdLOX 与苹果果实软化相关[23-24],茶树CsLOX 基因家族参与茶叶的香气形成。
LOX 在植物抵抗生物和非生物胁迫过程中也发挥着重要的作用。AtLOX2基因已被证实参与JA 途径[25],OsLOX1在水稻受损伤和褐稻虱侵害后,其表达量明显增高。当花生受到JA 诱导、外伤或黄曲霉侵染时,AhLOX1基因的表达会显著提高,而过表达AhLOX2和AhLOX3基因,会提高花生抵御黄曲霉侵染的能力。番茄植株中TomLoxD 的过表达能够显著增加内源JA 的含量,使植株更耐高温胁迫,对真菌的抵抗力更强。在玉米中尚未见到有关ZmLOXs与JA 途径存在关系的报道。本研究发现,ZmMYC7突变后ZmLOX9的表达水平显著下调,表明ZmMYC7 对ZmLOX9具有调控作用。本研究进一步利用酵母单杂交技术确定了ZmLOX9基因的启动子区能够被转录因子ZmMYC7 结合,且G-box 元件是ZmMYC7 结合的重要位点,由此推测ZmLOX9在玉米抵抗禾谷镰孢侵染过程中发挥重要功能。

