花生TCP 家族基因鉴定及其在侧枝发育中的表达分析
张靖男,韦丽君,陈娟娟,杨鑫雷,穆国俊,侯名语,崔顺立,刘立峰
(河北农业大学 华北作物改良与调控国家重点实验室/华北作物种质资源教育部重点实验室/河北省种质资源实验室,河北 保定 071001)
花生是世界重要的油料作物之一,同时也是人类重要的优质植物油脂和蛋白质来源。目前,有关花生转录因子家族的鉴定与分析已有一些进展,如bHLH[1]、WRKY[2]、bZIP[3]等,其中与bHLH家族蛋白具有相似DNA 结构域的转录因子家族——TCP 转录因子[4],则在花生中鲜见报道。TCP 是由玉米的Teosinte branched1(TB1)、金鱼草的Cycloidea(CYC)和水稻的Proliferating cell factors(PCF1 和PCF2)4 个基因的首字母组合而成[5]。其中,TB1 基因与植物的顶端优势有关,CYC 基因对花序的对称结构有重要作用,PCF 则与水稻PCAN 基因的启动子结合相关[6]。前人研究表明,TCP 转录因子广泛参与植物激素合成和信号转导[7]、形态建成[8]和逆境胁迫应答[9]。TCP 基因家族已在拟南芥(24 个)和水稻(21 个)[10]、玉米(43 个)[11]、大 豆(54 个)[12]、陆 地 棉(74个)[13]等作物中被鉴定,且部分基因的分子功能已清楚。如拟南芥AtTCP1 基因通过调节DWF4 的表达来调节BR 的生物合成[14];AtTCP20 能够调控叶片的衰老[15];水稻OsPCF7 基因能够调控水 稻 株 高 及 分 蘖[16];玉 米GRMZM2G120151、GRMZM2G148022和GRMZM2G089361可能参与调控分生组织细胞分裂周期,从而影响器官发育[17];TCP 家族基因可能影响大豆的花序形态建成及侧枝数[18];陆地棉GhTCP14在纤维伸长期的细胞中表达量受外源生长素上调表达[19]。鉴于此,本研究通过侧枝发育转录组测序及生物信息学方法,对花生TCP 家族基因进行全基因组鉴定、理化性质分析、保守结构域分析、系统进化分析及在侧枝发育的不同时期的转录表达分析,为进一步研究花生TCP 转录因子的功能及其调控机制提供理论基础。
1 材料与方法
1.1 材料
供试材料花生品种‘冀花5 号’(直立型)和‘M130’(匍匐型)由河北农业大学花生育种组提供,种植于河北农业大学创新实践园,催芽盆栽。待2品种的第1 对侧枝长出后的5、10、15、20、25、30 d,每个时期分别取3 株混样(3 次生物学重复)样品(每份样品由3 株混样),液氮速冻,存放于-80 ℃冰箱,送至北京百迈客生物科技有限公司进行转录组测序。
1.2 方法
1.2.1 花生TCP 基因家族鉴定 从Peanutbase 网站下载四倍体花生和野生二倍体花生基因组蛋白序列;同时,从Pfam 数据库下载隐马尔可夫模型文件(PF03634),通过在线工具HMMER(https://www.ebi.ac.uk/Tools/hmmer/)进行TCP 蛋白序列搜索,并在Pfam 数据库中进行序列比对和确认。
1.2.2 花生TCP 家族基因生物信息学分析 依据各成员在花生基因组中的物理位置,依次命名[20];通 过TAIR(https://www.arabidopsis.org/) 下 载 拟南芥TCP 家族成员,采用MEGA-X(https://www.megasoftware.net/)进行花生和拟南芥TCP 家族成员的多序列比对,邻接法构建系统进化树;利用MEME(http://meme-suite.org/tools/meme)在线预测保守基序;采用GSDS 2.0[21]绘制基因结构图;通过Expasy (http://www.expasy.org/tools/protparam)在线网站对各成员的氨基酸数量、分子量大小、等电点等理化性质进行预测;利用Cello(http://cello.life.nctu.edu.tw/)进行亚细胞定位预测;通过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线预测各基因启动子区顺式作用元件,采用GSDS2.0 绘制顺式作用元件图。
1.2.3 花生TCP 家族基因表达分析 以‘冀花5 号’和‘M130’第1 对侧枝不同生长时期的转录测序FPKM 值作为基因表达衡量标准进行表达分析。采用R 语言绘制基因表达热图。
2 结果与分析
2.1 花生TCP 家族基因的全基因组鉴定
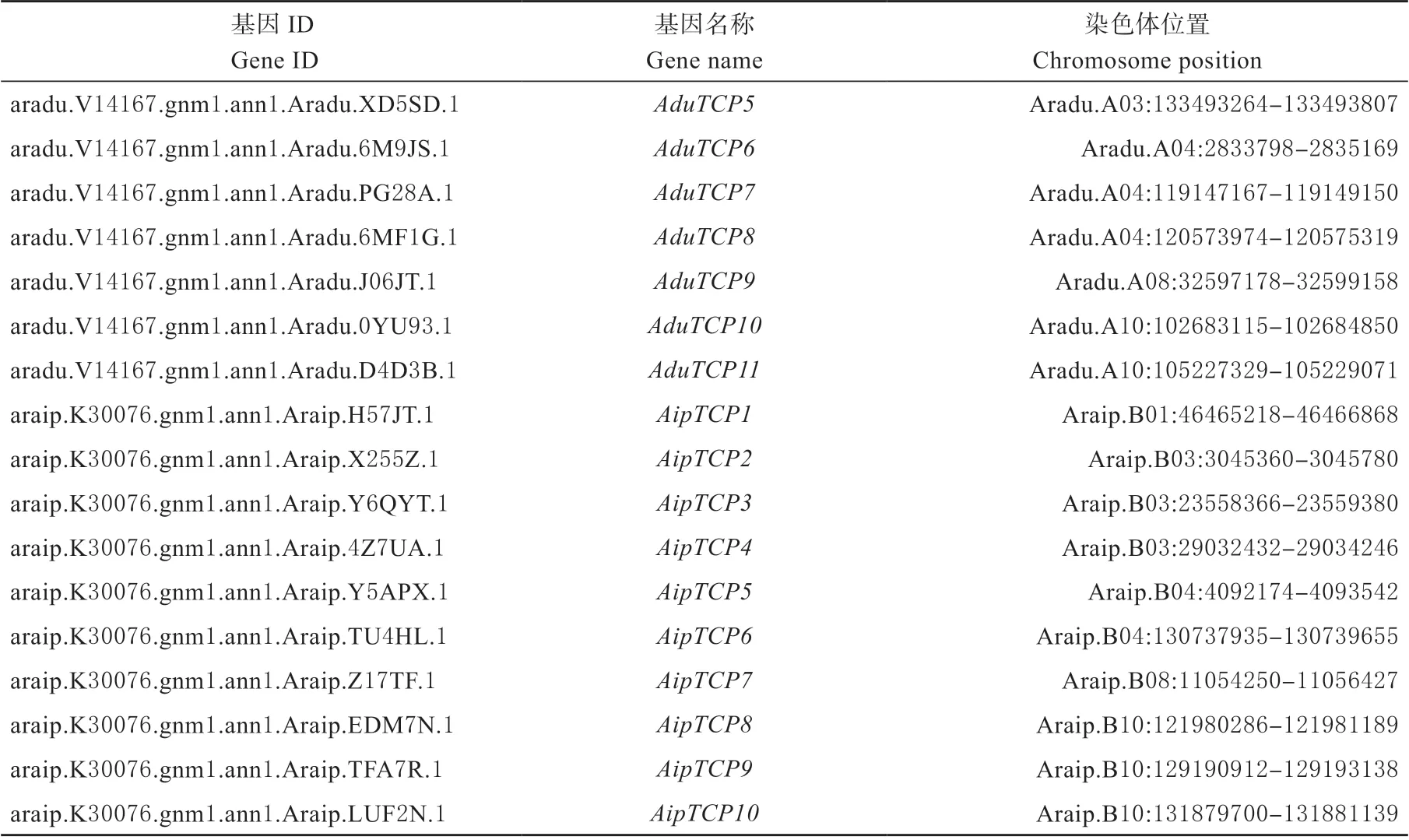
全基因组共获得51 条保守域完整的序列,除TCP 保守域外,还在部分成员发现R 域。研究分别在AABB、AA 与BB 各基因组中获得30 个(AhTCP1 ~AhTCP30)、11(AduTCP1 ~AduTCP11)和10 个(AipTCP1 ~AipTCP10)TCP 家 族 成 员(表1)。结果显示,30 个AhTCPs 位于14 条染色体上,其中染色体13 上分布最多,为4 个。11 个AduTCPs 位于6 条染色体上,其中染色体A03 和A04 分布最多,为3 个。10 个AipTCPs 位于5 条染色体上,其中染色体B03 和B10 上最多,为3 个。

表1 花生TCP 基因家族染色体位置信息Table 1 Chromosome position information of TCP gene family in peanut
续表:
2.2 TCP 家族基因的系统进化分析
通过对花生和拟南芥TCP 家族成员的系统进化分析发现(图1),家族成员在2 物种内相对保守。51 个花生TCP 家族成员聚为ClassⅠ和ClassⅡ两类,又在ClassⅡ划分为CYC/TB1 和CIN 2 个亚类。其中,AhTCPs 在ClassⅠ、CYC/TB1 与CIN 等亚类分别含有12 个、10 个和8 个家族成员;AduTCPs 在各亚类分别含有4 个、3 个和4 个家族成员;AipTCPs分别含有2 个、3 个和5 个家族成员。研究发现部分包含R 域的成员聚在ClassⅡ中。
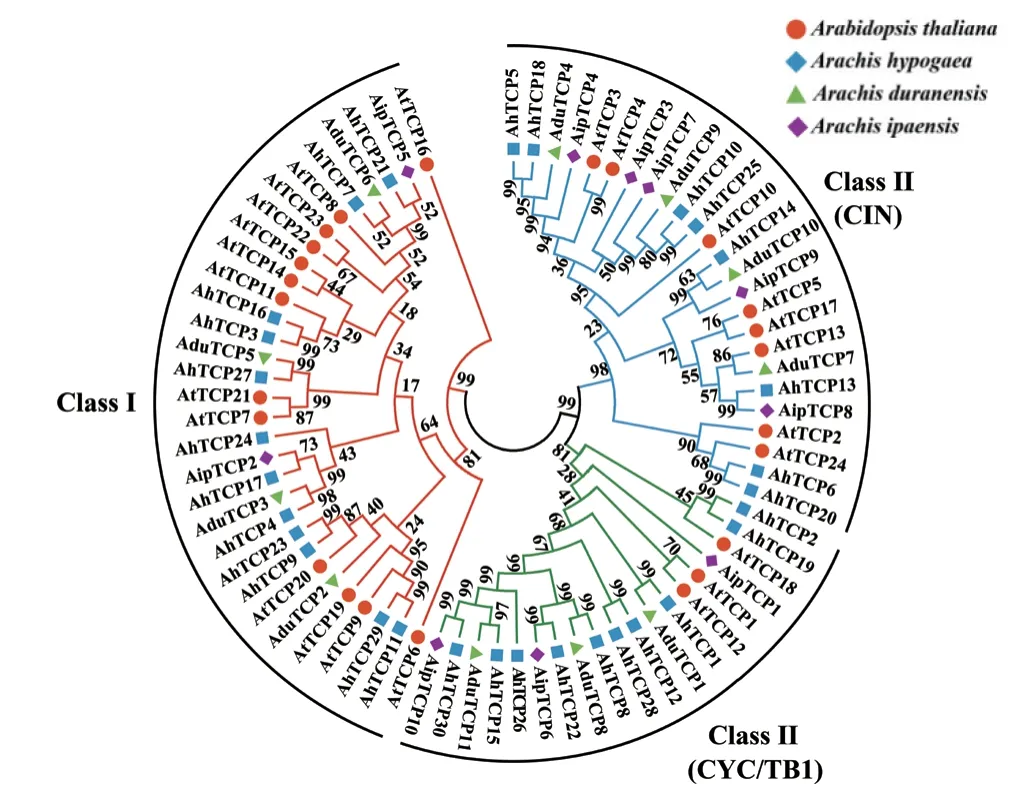
图1 花生和拟南芥TCP 基因家族进化树Fig .1 Phylogenetic analysis of TCP gene family between Arabidopsis and peanut
2.3 基因结构与Motif 分析
基因结构分析发现,AhTCPs 含有1 ~6 个外显子,其中以1 个外显子(10 个)和2 个外显子(9 个)成员居多(图2a)。AduTCPs 含有1 ~5个外显子(图2b),其中AduTCP4、AduTCP10最多,为5 个;AipTCPs 含有1 ~7 个外显子(图2c),其中AipTCP9最多,为7 个。通过对Motif的比较发现(表2,图3),所有AhTCPs 都存在Motif1-AABB,Motif2-AABB 存 在 于Class Ⅱ的AhTCP2、AhTCP19、AhTCP12、AhTCP28、AhTCP8、AhTCP22、AhTCP15、AhTCP30、AhTCP20、AhTCP6这10 个成员内,Motif3-AABB仅存在于Class Ⅰ,Motif4-AABB 分布于部分成员,Motif5-AABB 仅存在于CYC/TB1;AA 基因组中,Motif1-AA 存在于除AduTCP5外的所有AduTCPs中,Motif2-AA 仅 存 在 于AduTCP8和AduTCP11中,Motif3-AA 存在于所有AduTCPs 中,Motif4-AA 和Motif5-AA 仅存于ClassⅡ;BB 基因组中,Motif1-BB 存 在 于 除AipTCP9外 的AipTCPs 中,Motif2-BB 仅 存 在 于AipTCP6和AipTCP10中,Motif3-BB 仅存于CIN 亚组,Motif4-BB 存在于除AipTCP1 外的所有AipTCPs 中,Motif5-BB 仅存在于ClassⅠ。综上可知,Motif1 构成TCP 保守域,Motif2 构成R 域。
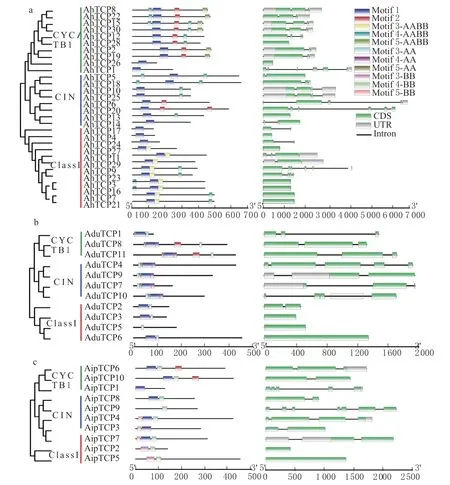
图2 花生TCP 家族基因结构图Fig. 2 Gene structure of TCP family genes in peanut

表2 花生TCP 基因家族Motif 预测及序列信息Table 2 Motif prediction and sequence information of TCP gene family in peanut
2.4 理化性质及亚细胞定位预测分析
理化性质预测分析发现(表3):AhTCPs 的氨基酸数目在131 ~658 之间,平均分子量为43.53 kD,分别多于AA(83 ~456,30.16 kD)和BB(127 ~455,33.67 kD)基因组的氨基酸数目和平均分子量大小。
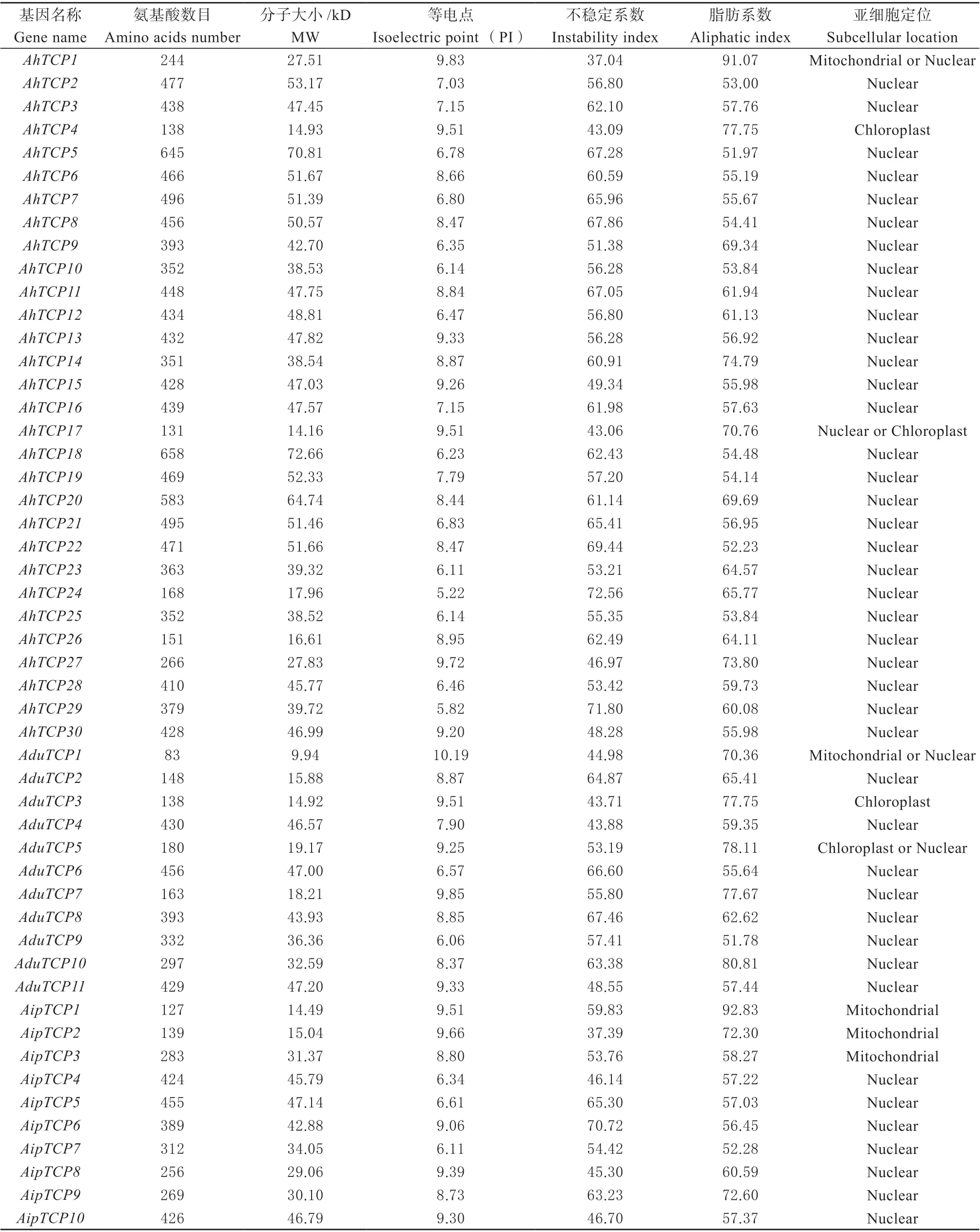
表3 花生TCP 蛋白理化性质、二级结构及亚细胞定位Table 3 Physicochemical properties, secondary structure and subcellular location of TCP proteins in peanut
2.5 启动子区顺式作用元件分析
家族成员上游2 000 bp 启动子区顺式作用元件预测发现:AA、BB、AABB 基因组分别发现77、75 和94 种顺式作用元件,其中22 种顺式作用元件与激素响应、植物生长发育和逆境胁迫等相关(图3)。与激素响应相关的家族成员,分别有24 个存在脱落酸反应元件(ABRE)、19 个有生长素应答元件(AuxRR-core 和TGA-element)、44 个有乙烯反应元件(ERE)、26 个有赤霉素反应元件(GAREMotif、P-box 和TATC-box)、27 个有水杨酸反应元件(TCA-element)以及30 个有MeJA 反应调控元件(CGTCA-Motif 和TGACG-Motif);与植物生长发育调控元件相关的家族成员,分别有15 个存在与分生组织表达相关调控元件(CAT-box 和CCGTCC-box)、20 个存在与昼夜节律调控相关元件(circadian)、17 个存在参与胚乳表达的调控元件(GCN4_Motif)、20 个存在玉米醇溶蛋白调控元件(O2-site);与逆境胁迫响应元件相关家族成员,分别有43 个存在厌氧诱导元件(ARE)、15个存在低温响应元件(LTR)、24 个存在干旱诱导元件(MBS)、10 个存在防御应激元件(TC-rich repeats)、28 个存在伤口应激元件(WUN-Motif)。
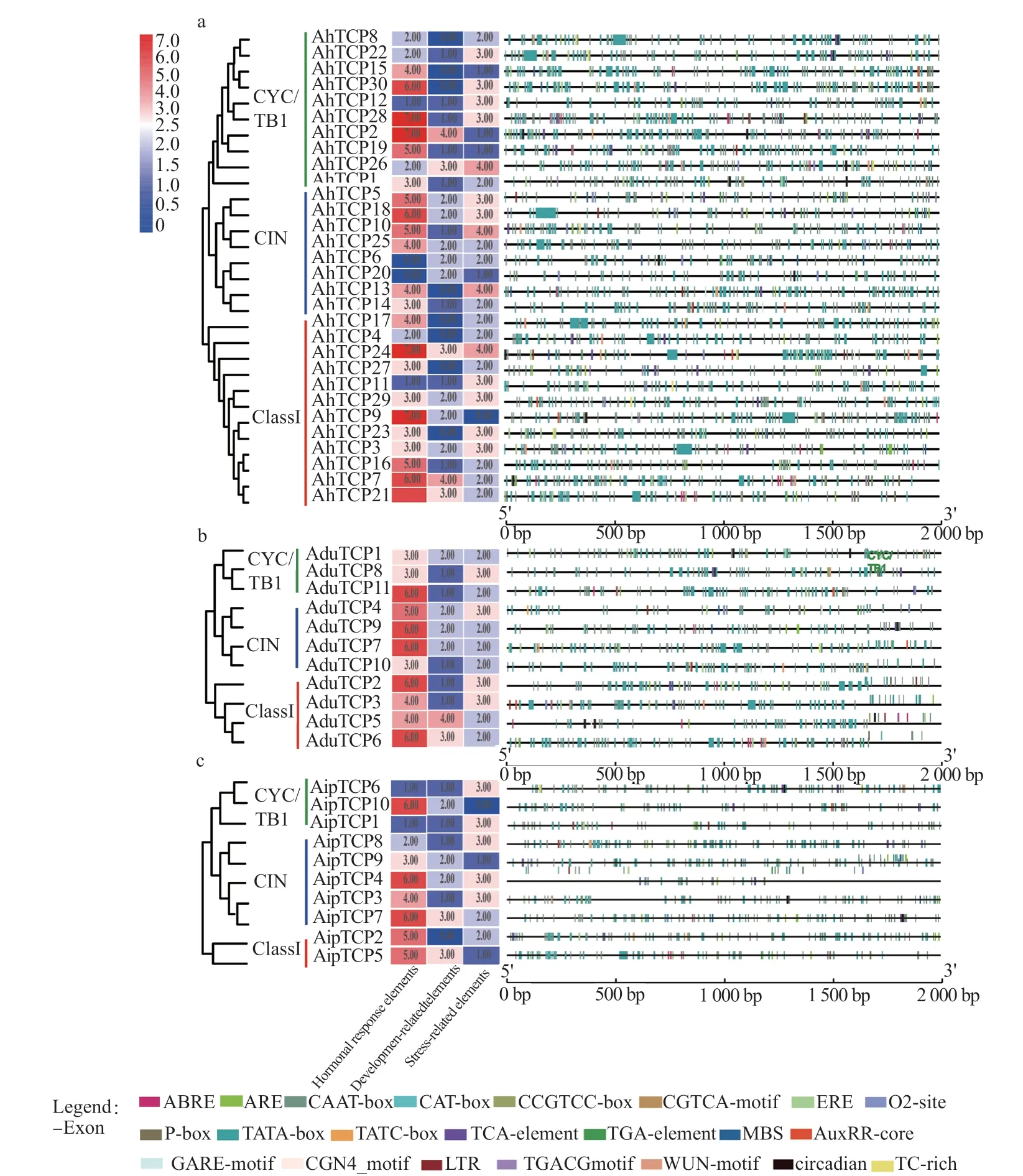
图3 花生TCP 基因家族顺式作用元件分析Fig .3 The analysis of cis-acting elements of TCP gene family in peanut
2.6 花生TCP 基因表达分析
AhTCPs 在‘冀 花5 号’‘和M130’的6 个侧 枝 发 育 时 期(5、10、15、20、25 和30 d)的表达模式分析结果显示(图4),30 个AhTCP 基因共检测到24 个基因,其中AhTCP1、AhTCP4、AhTCP5、AhTCP17、AhTCP25和AhTCP26尚未在转录组中检测到。第Ⅰ组中AhTCP12、AhTCP13、AhTCP14、AhTCP15、AhTCP28和AhTCP30具有相似的表达特征,6 个基因在两品种的6 个生长时期中普遍低水平表达。第Ⅱ组中AhTCP3、AhTCP7、AhTCP16、AhTCP21和AhTCP27具 有相似的表达特征,5 个基因在2 品种的6 个生长时期中普遍高水平表达,其中以AhTCP27表达水平最高。第Ⅲ组中,AhTCP2、AhTCP6、AhTCP8、AhTCP9、AhTCP11、AhTCP19、AhTCP20、AhTCP22、AhTCP23和AhTCP29表达水平均较高。而AhTCP18在2 品种中表达趋势一致,呈现出先降低后升高的表达模式;AhTCP10和AhTCP25在‘冀花5 号’中呈现出先降低后升高的趋势,而在M130呈现逐步降低的趋势。
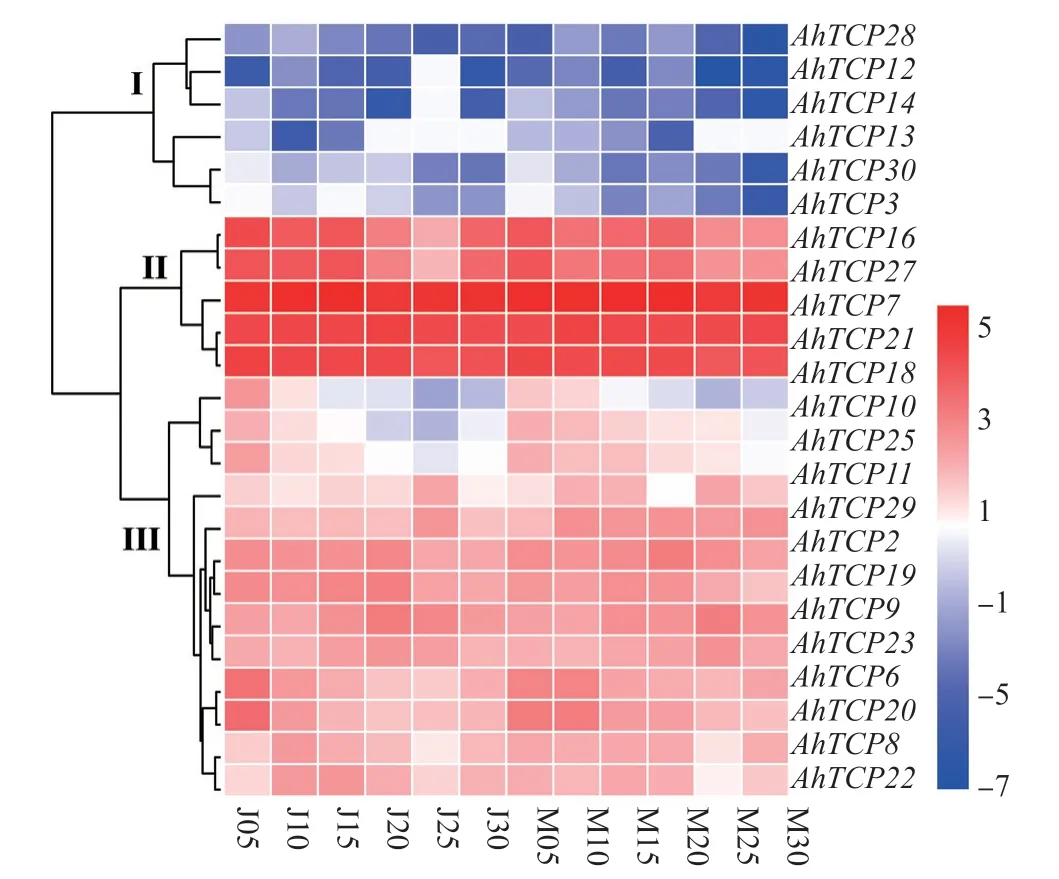
图4 AhTCPs 基因在栽培种花生侧枝发育中的转录表达模式Fig. 4 Transcriptional expression pattern of AhTCPs in the lateral branch development of the cultivated peanut
3 讨论
随着高通量测序技术的完善,大量物种完成了基因组测序,TCP 转录因子已在多个植物种被鉴定,其家族成员数目不尽相同[10-14]。本研究通过全基因组鉴定获得51 个花生TCP 转录因子家族成员,被划分为两类3 组,与拟南芥TCP 基因家族分类一致[10];其中ClassⅠ大部分家族成员仅具有编码序列(CDS),内含子数目较ClassⅡ家族成员少,说明花生TCP 基因在进化中序列呈现高度保守状态,与Yao 等[10]研究结果相符。TCP 氨基酸序列与bHLH 氨基酸序列存在较大差异,Marc 等[5]认为这可能是趋同进化的结果;启动子顺式作用元件预测结果中存在与激素响应、生长发育、胁迫应答元件,相关研究结果与Ling 等[22]一致。大量研究表明,拟南芥中的AtTCP11基因参与维管束后生木质部导管分子的分化和形成[23];AtTCP20基因调控植物生长发育、茉莉酸 (JA) 生物合成及叶片衰老[24];AtTCP22基因负向调控叶片衰老,并与AtTCP15基因存在功能冗余现象[25],而花生TCP 家族基因上游2 000 bp 启动子区内的多种顺式作用元件的存在,可推测TCP 家族基因也参与花生生长发育的多个生物学进程。
本 研 究 中AhTCP11、AhTCP29和AtTCP9被划分到ClassⅠ中,具有较高的序列同源性,推测AhTCP11和AhTCP29可能具有类似AtTCP9调控叶片衰老和根系发育[25]的功能;AhTCP5、AhTCP18与AtTCP3、AtTCP4被划分到ClassⅡ中,且具有较高的同源性,推测其可能作为microRNA 的靶基因参与花生叶片发育[26];AhTCP2、AhTCP19与AtTCP18(TB1 同系物)[27]被划分到ClassⅡ(CYC/TB1)中,且序列同源性较高。水稻OsTB1基因[28]和高粱SbTB1 基因[29]均属于TB1,与拟南芥AtTCP18序列高度同源,过表达后抑制腋芽的发育,减少分蘖的总数,进而影响植物的分枝发育。本研究通过对不同株型花生品种侧枝发育转录表达分析,发现AhTCP2、AhTCP18和AhTCP19在2 品种不同侧枝发育时期存在表达差异,推测3 个基因可能具有调控花生侧枝发育,改变植物形态的作用,其生物学功能有待进一步验证。另外,AhTCP3和AhTCP16基因与AtTCP11[27]基因具有的高同源性,推测AhTCP3和AhTCP16可能参与木质部细胞的形成 与 分 化;AhTCP23和AhTCP9与AtTCP20[28]具有较高的同源性,推测AhTCP23和AhTCP9调控花生叶片衰老。

