基于KASP 标记研究光周期基因Ppd-1 对二系杂交小麦亲本抽穗期的作用
陈现朝,刘江峰,张风廷
(北京市农林科学院 杂交小麦研究所,北京 100097)
杂交小麦具有大幅度提高小麦产量的潜力,而制种产量是二系杂交小麦品种走向市场的主要限制因素之一[1]。二系杂交小麦亲本发育进程不一致,年度间抽穗期差异较大,是导致其制种产量不稳的主要因素之一。研究二系杂交小麦亲本抽穗期的遗传和环境因素作用,对筛选抽穗期稳定的材料并通过播期协调其发育进程,从而稳定二系杂交小麦的制种产量具有重要的科学意义。
小麦抽穗期和开花期相关的基因有春化基因(Vernalization, Vrn)、光周期基因(Photoperiod,Ppd)和早熟基因(Earliness per se, EPS),其中春化基因Vrn-1和光周期基因Ppd-1是决定小麦抽穗期和开花期的关键基因[2]。迄今已有多个研究对Vrn-1和Ppd-1在小麦中的组成和分布进行检测[3-7],及其在小麦抽穗期和开花期的作用进行探索[8-10],结果表明春化和光周期等位基因的组成、分布和作用与品种特性和生态区域相适应。此外,Padovan 等研究表明通过播期等栽培措施可以提高小麦的适应性[11]。Rasheed 等利用春化基因和光周期基因的KASP 功能标记对不同国家和地区的小麦抽穗期进行鉴定[12]。KASP 标记以其简便高效方式对基因的SNP 位点变异检测,逐渐成为小麦种质资源鉴定、评价和筛选的主要技术手段[13-14]。
目前,二系杂交小麦亲本年度间抽穗期和开花期差异较大且不稳定,已成为二系杂交小麦大面积制种亟需破解的科学问题。前期,本团队已经对245 份亲本春化基因和光周期基因的组成、分布进行研究[15],但光周期基因Ppd-1在抽穗期的作用亟待阐明。本研究利用光周期基因Ppd-1的6组KASP 功能标记对453 份二系杂交小麦亲本进行检测,以播种到抽穗的时间和生长度日为指标,研究Ppd-1对二系杂交小麦亲本抽穗期的作用,分析Ppd-1不同单体型的亲本抽穗期稳定性。以期通过光周期基因Ppd-1的分子标记辅助鉴定并筛选抽穗期稳定的材料,结合播期协调其发育进程,为获得制种产量稳定的二系杂交小麦亲本组合奠定科学基础。
1 材料和方法
1.1 供试材料
本试验于2018—2019 年和2019—2020 年在北京市农林科学院河南邓州杂交小麦产业化实验基地进行(32.68°N,112.08°E)。供试材料共453 份,其中二系杂交小麦骨干光温敏不育系94 份(在邓州地区常年10 月25 日播种,不育度大于95%),骨干恢复系359 份(均为本所改良的高恢复力材料)。
1.2 测定项目与方法
1.2.1 田间试验设计及表型调查 2018 年和2019年,39 和55 份不育系分别于10 月13 日和19 日播种,154 和205 份恢复系分别于10 月19 日和27日播种。每个材料种植2 行,每行30 粒,1.5 m 行长,行距25 cm。实验材料采用随机区组设计,设置2 个重复。施用小麦专用复合肥,N ∶P ∶K 为25 ∶14 ∶7,化肥全部基施,按照一般大田管理。参照宋彦霞等方法进行抽穗期的田间调查[16]。播种到抽穗的时间计算公式:HD=H-S,其中HD、H和S分别为抽穗期、抽穗日期、播种日期。抽穗期差值计算公式:△HD=HDS-HDR,其中HDS 和HDR 分别为不育系和恢复系的抽穗期。
1.2.2 光周期基因Ppd-1检测 参照Rasheed[12]等研究设计本研究所需的6 组KASP 标记引物见表1。根据KASP 标记引物设计要求,FAM引物和HEX 引物5′ 端分别含有特异性接头,G A A G G T G A C C A A G T T C A T G C T 和GAAGGTCGGAGTCAACGGATT,可与荧光标记结合用于荧光检测,具体引物序列信息如表1 所示。田间剪取实验材料叶片。利用植物基因组DNA 提取试剂盒(天根生化科技有限公司,北京)分别提取453 份供试小麦材料基因组DNA,以供试小麦材料基因组DNA 为模板,分别采用6 组引物进行PCR 扩增。反应程序为:94 ℃ 预变性,15 min;94 ℃ 变性20 s,61 ~55 ℃(选用Touchdown 程序,每循环降低0.6 ℃)1 min,扩增10 个循环;94 ℃变性20 s,55 ℃ 延伸1 min,继续扩增26 个循环。用LGC 公司开发的SNP viewer 2.0 软件读取检测数据。试验结果剔除单体型杂合和缺失样本,用Excel统计不育系和恢复系材料中Ppd-D1、Ppd-B1和Ppd-A1基因单体型的频率。

表1 检测 Ppd-D1、Ppd-B1 和Ppd-A1 等位基因的引物信息Table 1 Primers for detecting different alleles of Ppd-D1, Ppd-B1, and Ppd-A1

1.3 数据处理
采用Microsoft Excel 2019 对数据进行整理,利用SPSS25.0(LSD)软件对数据进行统计描述、显著比较和方差分析。
2 结果与分析
2.1 Ppd-D1、Ppd-B1 和Ppd-A1 的组成及分布
鉴定结果(表2)发现供试材料以光周期敏感 型Ppd-D1b、Ppd-B1b和Ppd-A1b为 主。 6 个标 记TaPpdDD001、TaPpdDI001、TaPpdDD002、TaPpdBJ001、GS100-1027IND 和GS105-1117IND在供试材料检测到7 个等位基因,分别为Ppd-D1的3 个 野 生 型,Ppd-B1 的Non-truncated 型 以 及Ppd-A1的GS-105 型和2 个光周期敏感型。此外供试材料中光周期敏感型单体型在不育系中的比例大于恢复系,但2018—2019 年度基因位点不育系中Ppd-A1基因 GS100-1027IND 标记检测比例为87.18% 小于恢复系的93.51%。由表3 可知,供试材料包含39 种光周期基因单体型,其中Ⅰ型只在恢复系存在,占供试恢复系的37.88%;Ⅱ~Ⅴ 和ⅩⅠ 型在不育系和恢复系都存在,占供试不育系和恢复系的75.53% 和38.44%,其余单体型只在部分材料中存在,占供试不育系和恢复系的24.47%和23.96%。

表2 Ppd-D1、Ppd-B1 和Ppd-A1 等位基因在不育系和恢复系的组成和分布Table 2 Alleles composition and distribution of Ppd-D1, Ppd-B1, and Ppd-A1 in sterile lines and restorer lines
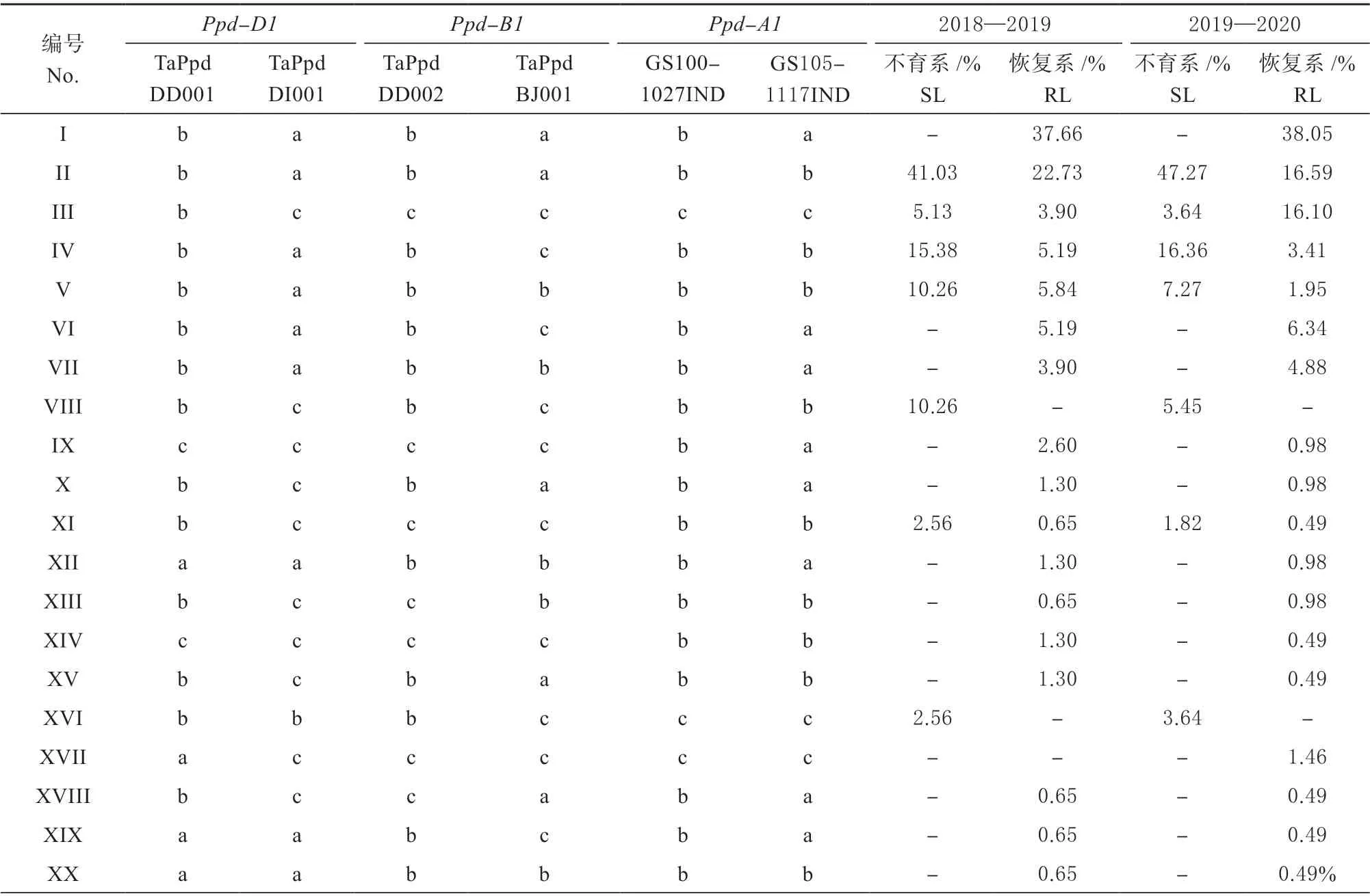
表3 Ppd-D1、Ppd-B1 和Ppd-A1 单体型的组成和分布Table 3 Distribution of Ppd-D1, Ppd-B1, and Ppd-A1 haplotype combinations
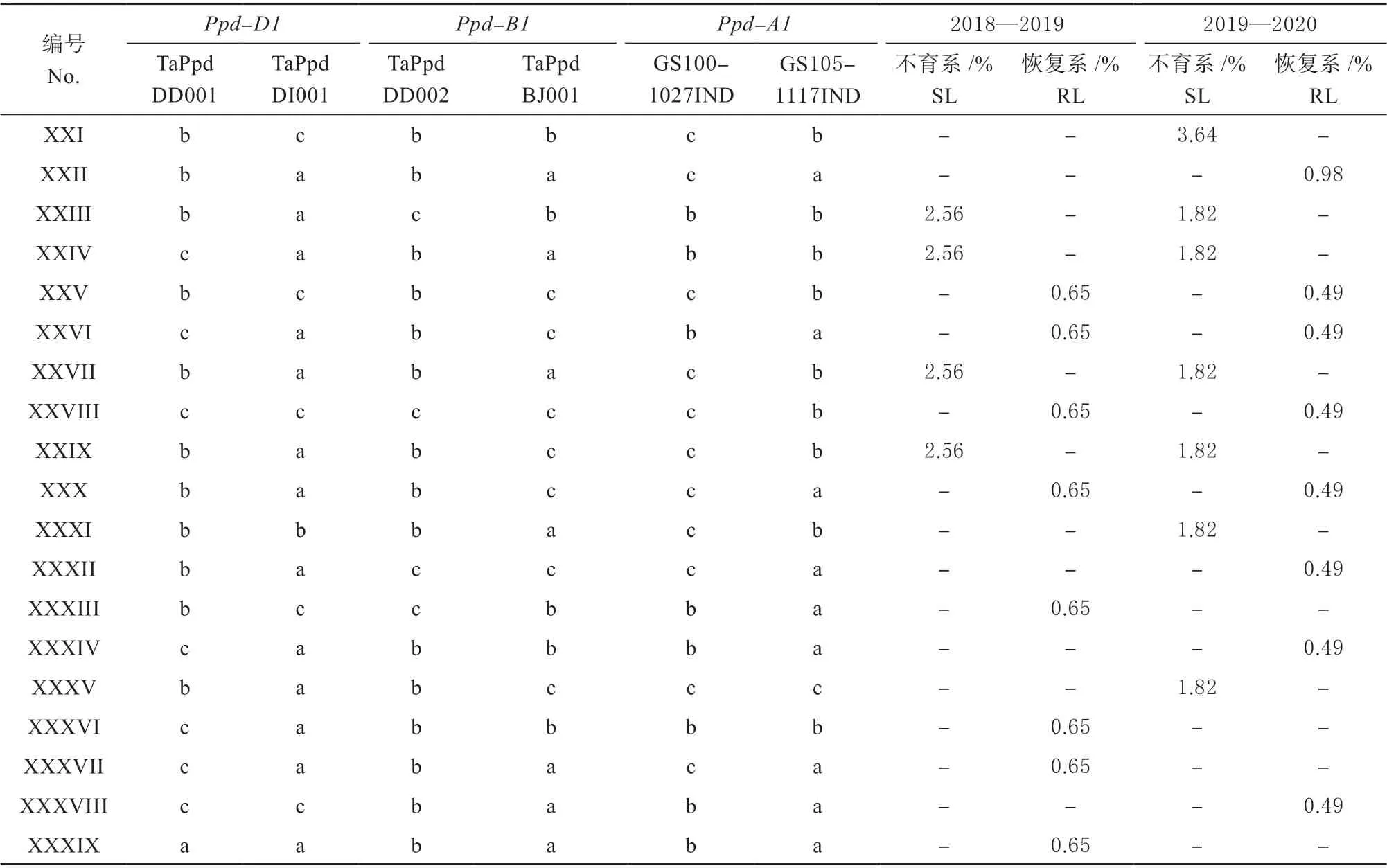
续表:
2.2 播期和光周期基因Ppd-1 对二系杂交小麦亲本抽穗期的作用
选择不育系和恢复系中Ⅱ、Ⅲ、Ⅳ和Ⅴ,播种到抽穗的时间和生长度日为指标对抽穗期的变异来源进行方差分析(表 4)。由表 4 可知播期对二系杂交小麦亲本抽穗期的作用大于光周期基因,其中播期间播种到抽穗的时间和生长度日差异达到极显著水平(P<0.01),光周期基因不同单体型之间播种到抽穗的时间和生长度日差异均不显著。

表4 抽穗期和生长度日的方差分析Table 4 Analysis of variance of heading date and growth degree day
由表3 可知ⅩⅠ 在总材料中比例小,无法对其单体型间进行显著性比较分析。2018—2019 年和2019—2020 年2 个年度选择不育系和恢复系中Ⅱ、Ⅲ、Ⅳ和Ⅴ为材料,对其播种到抽穗的时间和生长度日进行显著性比较分析(表 5)。由表5 可知年度和单体型间生长度日比播种到抽穗的时间更稳定。2018—2019 年度不育系比恢复系抽穗期多2.2 d,且差异显著(P=0.03),2019—2020 年度不育系比恢复系少0.07,差异不显著。2018—2019 年度不育系比恢复系生长度日多 36.7 ℃·d,且差异极显著(P=0.006),2019—2020 年度不育系比恢复系生长度日多 24.5 ℃. d,且差异显著(P=0.046)。
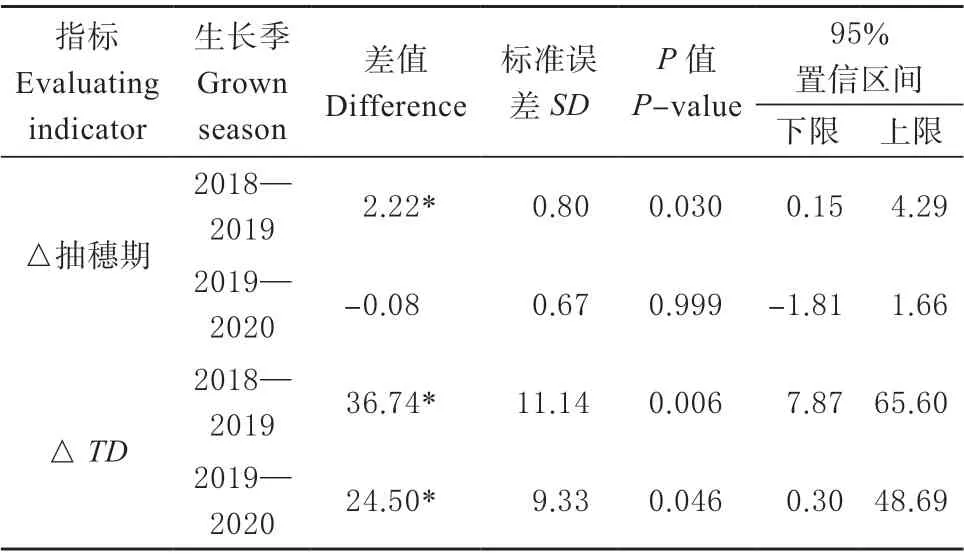
表5 不育系和恢复系抽穗期和生长度日显著性比较Table 5 Comparison of significance of heading time and growth degree day between male sterile and restorer lines
为进一步阐明不同单体型的亲本抽穗期稳定性,本研究在2018—2019 年和2019—2020 年2 个年度下,选择Ⅱ、Ⅲ、Ⅳ和Ⅴ4 个单体型的不育系和恢复系为材料,对其播种到抽穗的时间和生长度日进行显著性比较分析(表 6),结果表明组合间播种到抽穗的时间差值不稳定,而播种到抽穗的生长度日差值因组合不同而表现不同。由表6 可知不育系和恢复系抽穗期差值 2018—2019 年度均大于2019—2020 年度,且组合间和年度间抽穗期差值不稳定。就组合间生长度日差值而言,其中单体型Ⅲ的组合在两个年度差异较大;而单体型Ⅱ的组合(Ⅱ×Ⅲ除外)在两个年度间稳定性好,而Ⅱ×Ⅱ在两个年度生长度日稳定分别为32.94 ℃·d和32.79 ℃·d,达到极显著和显著水平。单体型Ⅳ的组合(Ⅳ×Ⅲ除外)在两个年度间稳定性好,但不显著。单体型Ⅴ的组合稳定性较差。

表6 不同单体型间不育系和恢复系抽穗期和生长度日差异比较Table 6 Comparison of heading date and growth degree day differences between male sterile lines and restorer lines among different genotype combinations
3 讨论
3.1 小麦光周期基因Ppd-1 的组成和分布
小麦光周期的组成和分布与光照反应和环境因素有关,迄今已有多个研究对小麦光周期基因Ppd-D1、Ppd-B1和Ppd-A1的分布和作用进行研究[3-6]。其中Yang 等发现中国小麦品种中光周期不敏感基因Ppd-D1a自北向南比例逐渐增多的趋势[3],该基因与本研究中Ppd-D1的TaPpdDD001标记检测的基因位点相同,但二系杂交小麦不育系和恢复系等位基因以Ppd-D1b为主,其比例分别为 97.87% 和 91.92%。Guo 等 对Ppd-D1基 因 在国内外小麦品种的分布进行研究,发现其单体型遍布世界各地,但不同单体型分布与麦区的经纬度有关[4]。Bentley 等分布对世界各国的小麦品种对光周期基因Ppd-B1和Ppd-A1等位基因分布和功能进行研究,发现供试材料以光周期敏感型Ppd-B1b和Ppd-A1b为主[5-6]。二系杂交小麦亲本中光周期基因Ppd-D1、Ppd-B1和Ppd-A1的单体型组成和分布与上述研究结果不尽相同,一方面由于不同研究的材料来源和组成不同,研究结果自然会有所差异。另一方面,这可能与二系杂交小麦不育系在北京(可育)、邓州(不育)两地进行穿梭育种,人工定向选择光周期敏感的不育系,造成其群体中春化基因和光周期基因频率与常规小麦不同[19]。
3.2 光周期基因Ppd-1 在小麦抽穗期的作用
小麦发育既受春化和光周期基因调控,也受的光照和温度影响[20]。本研究表明播期对二系杂交小麦亲本抽穗期的作用大于光周期基因Ppd-1。这可能与二系杂交小麦骨干亲本光周期基因以光周期敏感的基因单体型为主有关,已有多个研究表明发现Ppd-D1对二系杂交小麦亲本抽穗期作用最大,Ppd-B1和Ppd-A1次之[21-23]。本研究中供试材料组Ⅱ光周期基因单体型稳定性最好,而Ⅲ和Ⅴ光周期基因单体型抽穗期稳定性较差。Ⅲ光周期基因为光周期不敏感型Ppd-D1a,受环境条件作用显著,组合间抽穗期稳定性差;而组Ⅱ和组Ⅴ光周期基因为光周期敏感型Ppd-D1b,其抽穗期稳定性较好。因而,为筛选小麦抽穗期稳定的小麦,应进一步通过分子标记辅助鉴定筛选组Ppd-D1b的小麦。
由于年度间或不同播期小麦发育进程温度变化不稳定和光照时长的差异,以小麦播种到抽穗的时间即抽穗期为小麦发育进程的指标不够准确,本文比较不同光周期基因型播种到抽穗的时间和生长度日也对此进一步进行验证,而且相同光周期基因型下播种到抽穗生长度日较抽穗期更稳定。同时,小麦阶段发育所需的基础温度因品种或发育阶段有所不同[17],本研究利用0 ℃作为小麦播种到抽穗基础温度不够准确,因而,本文中不同基因型小麦播种到抽穗间的生长日温在年度间有所变动。
3.3 光周期基因Ppd-1 在二系杂交小麦制种的意义
二系杂交小麦制种亲本年度间抽穗期和开花期差异较大且不稳定,不能满足制种实验的要求。研究发现二系杂交小麦制种产量与组合亲本的抽穗期和开花期显著相关[15]。研究不同光周期基因单体型亲本抽穗期和开花期的作用,为分子标记辅助鉴定抽穗期和开花期稳定的小麦提供科学依据。本研究发现而Ⅱ×Ⅱ在两个年度生长度日稳定分别为32.94 ℃·d 和32.79 ℃·d,达到极显著和显著水平。该单体型在二系杂交小麦制种亲本比例偏低,需进一步加强分子标记辅助鉴定和筛选抽穗期和开花期稳定的小麦研究工作。

