柿单宁酶PsnTanA 异源表达及酶学特性表征
卢海强,陈 伟,田洪涛,谷新晰,谷子林
(1.河北农业大学 食品科技学院,河北 保定 071000;2.河北农业大学 动物科技学院,河北 保定 071000)
单宁酶(EC 3.1.1.20)是一类能够水解单宁酯键和缩酚酸键酶的总称[1],广泛分布在植物,动物和微生物中[2-3]。目前,单宁酶已表现出了巨大应用价值,如茶经单宁酶处理后,可有效控制“茶乳”的形成,增强茶的口感和风味[3-4]。单宁酶可以提升果汁的澄清度,降低果汁的苦涩及增强果汁的生物活性等效果[6]。除此之外,单宁酶在饲料和废水处理也有着巨大应用[7-8]。目前商品化的单宁酶主要来自曲霉,如黑曲霉[9]和米曲霉[10]等。然而,这些单宁酶也存在一些不足,如较差的缩合单宁降解效率及较高的温度敏感性,这些因素限制了单宁酶的应用领域。
随着基因工程技术的发展,目前重组菌构建越来越受到关注,单宁酶重组菌也越来越多,如Kanpiengjai 等人从乳酸菌中克隆了碱性单宁酶基因并在大肠杆菌BL21(DE3)中重组表达[11];Kumar等人从肺炎克雷伯菌中克隆了单宁酶基因并在大肠杆菌BL21(DE3)中重组表达[12]。然而,目前只有少数单宁酶得到了详细的表征和商业化应用,远远不能满足单宁酶相关研究和应用的需要。2020 年Dai等人首次从植物体内发现了单宁酶[13],丰富了现有单宁酶资源,而该单宁酶的相关性质尚未见报道。
本研究拟依据大肠杆菌密码子偏好性,优化并合成柿树单宁酶基因;在大肠杆菌表达系统进行单宁酶生产,利用Ni-NTA 亲和层析对产物进行分离纯化,并对重组单宁酶PsnTanA 进行酶学性质表征,为柿树单宁酶PsnTanA 的理论和应用研究提供一定的指导。
1 材料与方法
1.1 材料与试剂
大肠杆菌(Escherichia coli)BL21(DE3) 由本课题组保存;PCR 反应试剂购自大连宝生物有限公司,硫酸卡那霉素(Kan),琼脂糖凝胶回收试剂盒,质粒提取试剂盒购自北京索莱宝科技有限公司;蛋白标准分子量Marker 购自河北瑞帕特生物科技有限公司;罗丹宁,没食子酸正丙酯购自上海源叶生物科技有限公司;Ni-NTA 购自上海碧云天生物技术有限公司,其他试剂均为国产分析纯。
1.2 仪器与设备
酶标仪 Bio-RAD;SDS-PAGE 电泳设备 北京君意东方电泳设备有限公司。立式高速低温离心机HITACHI 公司;JY88-IIN 超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 柿树单宁酶密码子优化及基因合成 使用GenSmart™ Codon Optimization 工具(https://www.genscript.com/)对柿树单宁酶基因(MK381274.1)进行稀有密码子分析及优化,由南京金斯瑞生物科技有限公司合成并连接至pET30a 表达载体。
1.3.2 生物信息分析 采用SWISS-MODEL(http://swissmodel.expasy.org/interactive)软件对单宁酶PsnTanA 进行同源建模,并利用Pymol 软件进行可视化分析。使用 Vector NTI 11.0 软件计算单宁酶PsnTanA 的基本参数。
1.3.3 重组菌的构建与诱导表达 表达质粒经热激转化至E. coilBL21(DE3)感受态细胞,随后挑取单菌落接种于LB 液体培养基中振荡培养,当发酵菌液OD600达到0.6 左右时添加IPTG 试剂的进行诱导。诱导培养结束后,取培养液,8 000 r/min 条件下离心10 min,收集细胞沉淀,并用PB 缓冲液(0.2 mol/L,pH 7.0)重悬后超声破碎,超声条件为:超声5 s,间歇6 s,超声功率0.3 kW,20 次。细胞破碎液离心后收集上清,即为粗酶液样品。
1.3.4 重组单宁酶的纯化及SDS-PAGE 分析 采用Ni-NTA亲和层析方法进行重组酶PsnTanA的纯化。将粗酶液注入平衡好的Ni 柱,用9 mL PB 缓冲液分3 次加入洗涤杂蛋白,分别用3 mL 含20,40,80,100,200 和300 mmol/L 咪唑的洗脱液进行洗脱处理,收集各部分洗脱液,测定单宁酶酶活性。利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)检测各组分的纯化效果。采用Bradford 方法测定蛋白质浓度。
1.3.5 单宁酶酶活力的测定 参考Sharma 等[14]的方法进行单宁酶活性的测定:取适当稀释酶液(100 μL)与没食子酸丙酯溶液(400 μL,1.25 mmol/L,pH 6.0) 混 匀,30 ℃反 应10 min 后 加 入300 μL罗丹宁甲醇溶液(50 mmol/L)终止反应,加入溶液KOH(200 μL,0.5 mol/L)进行显色,随后在520 nm 波长处测定吸光度。定义每分钟生成1 μmol没食子酸所需的酶量为1 个酶活力单位(U)。
1.3.6 温度和pH 对重组单宁酶活性的影响 以没食子酸正丙酯为底物,在0 ~80 ℃的温度的条件下测定重组酶PsnTanA 活性变化规律;在40 ℃或50℃条件下处理0、5、10、20、30 和60 min 后,测定重组单宁酶活性变化规律;将重组酶PsnTanA 在pH 2.0 ~12.0 条件下测定重组酶PsnTanA 活性变化规律;在不同pH 2.0 ~12.0 缓冲液中,0 ℃保温1 h 后测定重组酶PsnTanA 活性变化规律。
1.3.7 金属离子及化学试剂对重组单宁酶活性的影响 在酶反应体系中分别加入不同金属离子或不同化学试剂,使其浓度分别为1 mmol/L 和5 mmol/L(或体积浓度1%和5%)进行反应,进行活性的测定。
1.3.8 重组单宁酶底物特异性及动力学常数的测定 参考上述活性测定方法,分析重组酶PsnTanA 对没食子酸甲酯(MG)、没食子酸乙酯(EG)、没食子酸正丙酯(PG)和表没食子儿茶素没食子酸酯(EGCG)的底物的水解能力。称取1.0 g 茶(红茶、绿茶)或谷物(高粱、绿豆)研磨成粉末状,料水比(w/v)为1∶50,煮沸,冷却至适当温度,加入单宁酶(以U 为单位添加),在单宁酶的最适反应温度下反应1 h,煮沸5 min 灭酶活,测定没食子酸。在最适条件下,以PG(0.25 ~5 mmol/L)为反应底物,基于Lineweaver-Burk 方法计算重组单宁酶PsnTanA 的Km 和Vmax 值。
1.3.9 数据分析与统计 上述试验均重复3 次,并利用GraphPad Prism 8.0 软件对数据进行统计分析,数据结果采用平均值±标准误差表示。
2 结果与分析
2.1 单宁酶PsnTanA 的生物信息学分析
柿树单宁酶PsnTanA 的基因全长912 bp,编码303 个氨基酸和1 个终止密码子。经分析野生型柿树单宁酶基因中含有30 个大肠杆菌稀有密码子和5处连续稀有密码子(CCC CCC、GGA CCC、GGG AGG、ACG GGG 和AGA GGG)。优化后,该基因共有21 个稀有密码子进行了同义密码子的替换,并消除了连续稀有密码子。CAI(Codon Adaptation Index)值和GC 含量由此前的0.62 和60.20%分别改变为0.76 和57.11%,基因序列优化前后的一致性为78.3%。
经三维结构模拟分析可知(见图1),单宁酶PsnTanA 由2 个结构域组成,分别是α/β 水解酶折叠域和Lid 结构域。α/β 水解酶折叠核心域或由8 个β 折叠片和5 个α 螺旋组成,其中2 个α螺旋位于8 个β 折叠的凹侧(α2 和α17),3 个位于凸面(α3、α4 和α12)。Lid 结构域则由2 个平行的β 折叠和1 个反平行的β 折叠组成。单宁酶PsnTanA 催化三联体残基为S164、D245 和H278,具有保守活性位点基序“G-X-S-X-G”,而与微生物来源单宁酶中普遍存在的“CS-D-HC”保守基序存在差异[15]。Dai 等人构建了柿树单宁酶G76A和G77A 突变体,发现突变体不再具有单宁酶活性,证明了Gly-Gly 氧阴离子洞在催化水解过程具有关键的作用[13]。Ser164 位于底物口袋底部特征性的“亲核肘”位置,处于β8-α4 的loop 结构顶部,这允许亲核氨基酸残基有效地呈递给底物,并将酶-底物中间体定位在氧阴离子洞的氢键距离内,从而使过渡态的稳定。
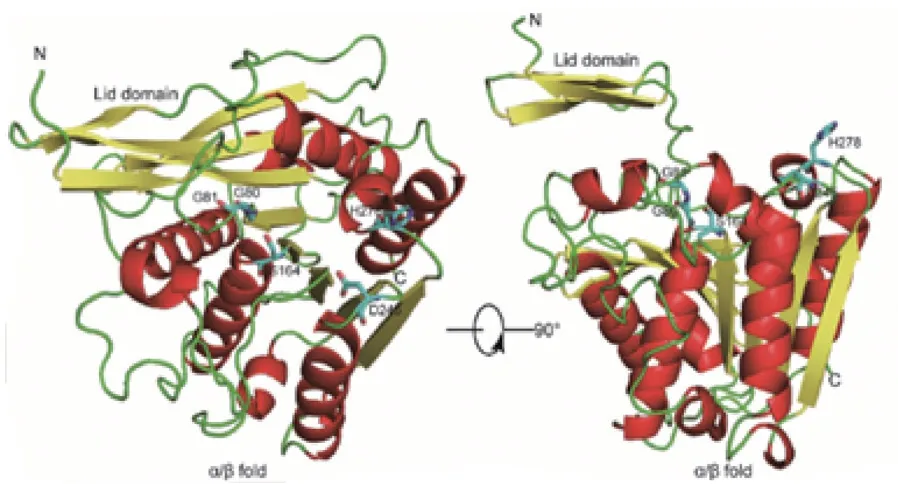
图1 柿单宁酶PsnTanA 的 三维结构模拟Fig. 1 The overall structure of tannase PsnTanA from persimmon
2.2 重组酶PsnTanA 的纯化及SDS-PAGE 分析
发酵液菌体经超声波破碎处理后,采用镍柱亲和层析方法进行重组蛋白的纯化。经测定,当洗脱液为40 mmol/L 咪唑时,收集到的单宁酶活性最高。经SDS-PAGE 分析(见图2),泳道1 为细胞破碎液上清,泳道2 为纯化的重组蛋白,表观分子量约为39 kD,其比酶活力为1.08 U/mg。本研究中,重组酶PsnTanA 采用融合表达His 标签策略进行异源表达,继而增大了酶蛋白分子量,类似的现象也有报道[16]。
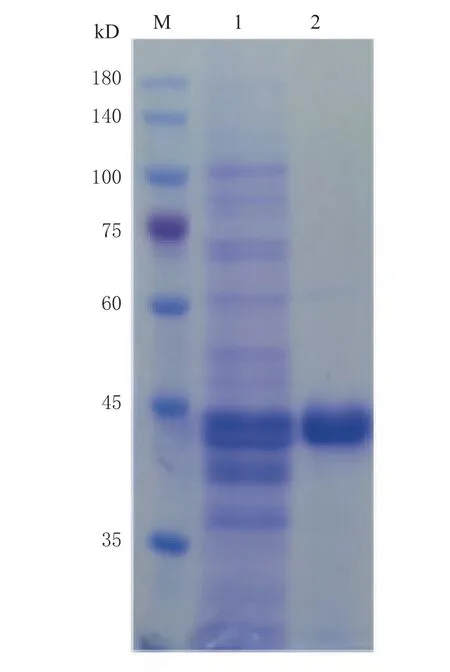
图2 重组单宁酶PsnTanA 的SDS-PAGE 分析Fig. 2 The SDS-PAGE analysis of purified recombinant tannase PsnTanA
2.3 单宁酶PsnTanA 的酶学性质分析
2.3.1 温度和pH 对重酶活力的影响 如图3A 所示,单宁酶PsnTanA 在0 ~70 ℃范围内均表现出一定的活性,50 ℃时活性最高,在40 ~50 ℃的温度范围酶活力维持在76.9%,随着反应温度的增加,重组单宁酶活性急剧下降,70 ℃仅残留10%左右的酶活力。重组酶PsnTanA 在40 ℃温度条件下处理60 min 后,酶活力仍保持80.0%以上,该酶表现出较好的温度稳定性;随着处理温度的提升,酶的温度耐受性随之减弱,如在50 ℃温度条件下处理60 min后,酶活力保持在10.0%左右(图3D)。
由 图3B 可 知, 重 组 酶PsnTanA 在pH2.0 ~12.0 范围内均表现出活性,pH 7.0 反应条件下,PsnTanA 的酶活力最大,而pH8.0 条件下,PsnTanA的酶活力降至20.3%。经重组酶PsnTanA 的pH 稳定性测定结果(图3C)可知,该酶在pH6 ~12 之间具有较好的稳定性,残余酶活力大于60%,在酸性条件下,重组酶的稳定性较差。
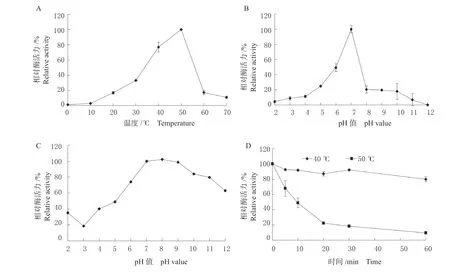
图3 重组单宁酶PsnTanA 的酶学特性Fig. 3 Enzymatic properties of the recombinant tannase PsnTanA
2.3.2 金属离子和化学试剂对酶活力的影响 经测定低浓度(1 mmol/L)的Ca2+对PsnTanA 无抑制作用,Na+、K+、Li+及Mg2+在1 和5 mmol/L 的浓度下,对PsnTanA 酶活力有轻度抑制作用,残余酶活力保持在70% 以上。Al3+对PsnTanA 酶活力有中度抑制作用,重金属离子Ag+、Mn2+、Zn2+、Cu2+和Fe3+对PsnTanA 酶活力有重度抑制作用。在5 mmol/L 的浓度下Ag+、Zn2+、Cu2+和Fe3+可使PsnTanA 酶活力丧失90%以上,其中Cu2+几乎完全抑制PsnTanA 的酶活力(见表1)。
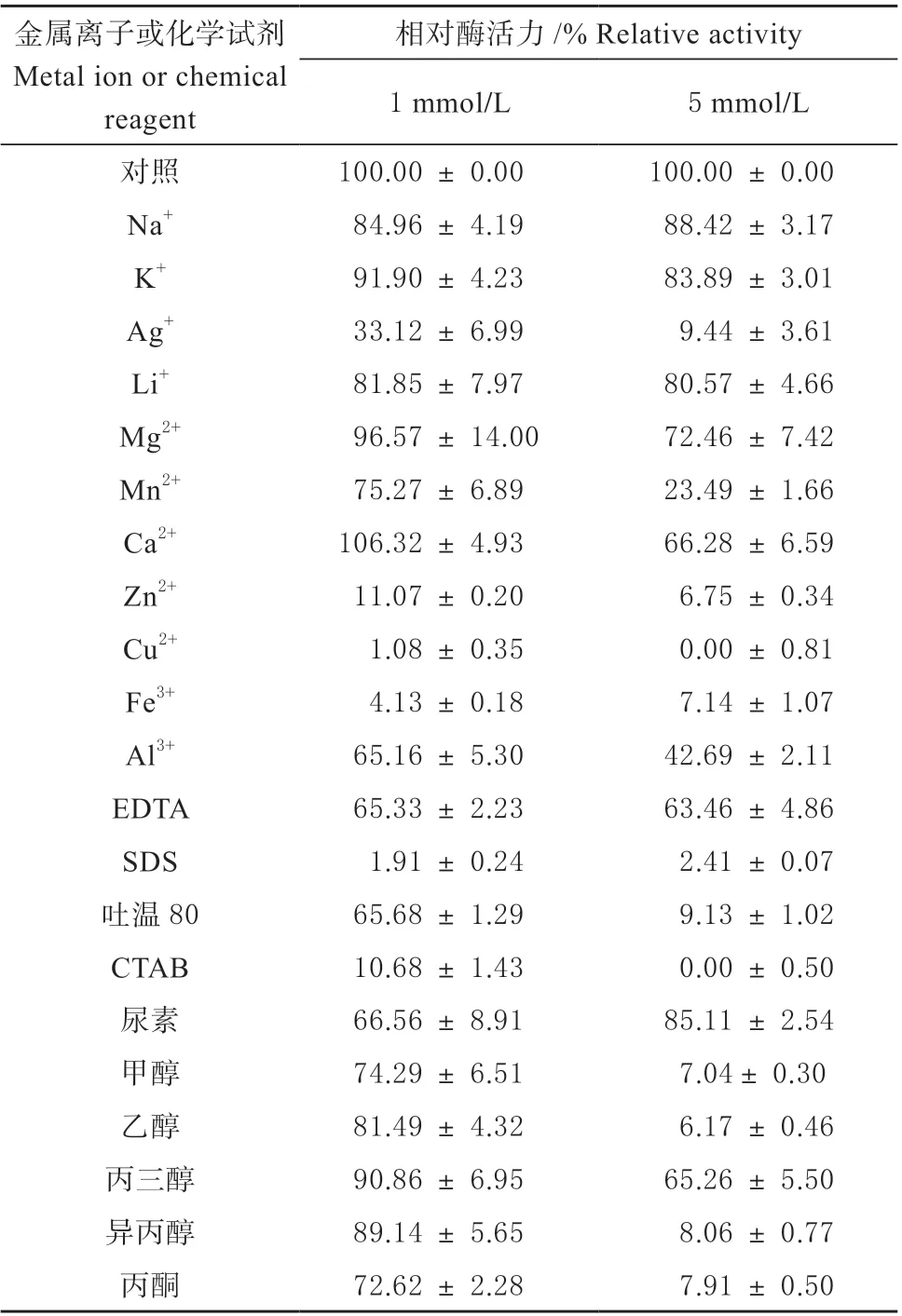
表1 金属离子和化学试剂对单宁酶PsnTanA 的影响Table 1 Effect of metal ions and chemical reagents on the activity of tannase PsnTanA
化学试剂对重组酶PsnTanA 均表现出不同程度的抑制作用,并且多数试剂添加量越大抑制作用越强,只有尿素在高浓度下抑制作用反而减弱。螯合剂EDTA 抑制了PsnTanA 约35% 的酶活力;表面活性剂SDS、吐温80 和CTAB 的抑制作用最强,几乎完全抑制了PsnTanA 的酶活力;5%的甲醇、乙醇、异丙醇及丙酮可抑制90%以上的酶活力。
2.4 单宁酶PsnTanA 的底物谱和动力学参数
经测定,单宁酶PsnTanA 随着底物酯链的增加而活性降低,且该酶对合成底物(MG、EG 和PG)表现出比天然底物(EGCG)更高的活性。以PG 为底物,重组酶PsnTanA 的Km 值和Vmax 值分别为1.71 mmol/L 和2.56 mmol/(L·min)。本研究进一步测定了该酶在绿茶、红茶、高粱及绿豆中的降解能力(图4)。重组酶PsnTanA 可有效降解绿茶中的单宁物质,使得单宁酸的含量提高了40%左右(绿茶含7.5 μg/mL),然而类似的现象并未在红茶的酶解中发现。除此之外,该酶对高粱中的单宁有表现出了高效的降解,使得没食子酸含量增加了42.2 μg/mL。同样,重组酶对绿豆中的单宁也显示出了较好的降解能力。

图4 重组单宁酶PsnTanA 的底物特异性Fig. 4 The substrate specificity of the recombinant tannase PsnTanA
3 结论与讨论
柿树与大肠杆菌的遗传密码子使用频率存在较大差异,因此,参照大肠杆菌的密码子偏好性优化PsnTanA 的野生型基因,替换了21 个大肠杆菌稀有密码子,改善了密码子偏性状况,CAI 值由0.62 提高至0.76,更接近于理想值1.0[17],这为该酶的成功表达提供了保障。
重组酶PsnTanA 最适反应温度为50 ℃,在40 ~55 ℃反应时,该酶可表现出约80 % 以上的酶活力,当温度大于60 ℃后,酶活力急剧下降。Kanpiengai 等人报道的戊糖乳杆菌单宁酶LpTanBA-7 的最适反应温度同样为50 ℃,LpTanBA-7 在50 ℃下酶活力半衰期为30 min。重组酶PsnTanA 在50 ℃温条件下处理10 min 后,酶活力保持在49.0%,在40 ℃温度条件下处理60 min后,仍保持80.0%的酶活力。pH 值影响活性位点氨基酸残基的质子化和去质子化,而影响酶的催化效率和稳定性[18]。多数真菌单宁酶在酸性环境中有较高酶活力,最适pH 值在pH 4.5 ~6.0 的范围内[19];而大多数细菌来源的单宁酶则在pH 值7.0 ~8.0 的范围内具有较高酶活力[20]。鲁顿葡萄球菌单宁酶pH 值为7.0,同重组单宁酶PsnTanA 一样在酸性环境中酶活力较低,但经过固定化后鲁顿葡萄球菌单宁酶酶活力提高了35%[21]。酶经固定化材料包埋后,固定化酶在液体环境中的暴露减小,溶液中pH的变化对固定化酶活性的影响较小。因此,单宁酶PsnTanA 的固定化应是提高该酶特性的策略之一。
金属离子和化学试剂对重组酶PsnTanA 的酶活力均表现出不同程度的抑制,其中金属离子的抑制作用尤为显著,如Cu2+和Fe3+几乎完全使PsnTanA活性丧失。类似的现象在黄蕾等[22]、Kanpiengjai等等人研究中均有发现[11]。推测这很可能是由于金属离子与酶活性部位的巯基、色氨酸残基和或羧基相结合,继而阻碍了酶与底物结合而生成产物。
本研究实现了柿树单宁酶PsnTanA 在大肠杆菌中的异源表达,重组酶 PsnTanA 最适反应温度和最适pH 分别为50 ℃和7.0 ,该酶对高粱中的单宁有较好的降解效果,本研究有利于柿树单宁酶PsnTanA 理论和应用研究的进一步开展。

