感染期血清外泌体在伯氏疟原虫红内期肝损伤中的作用
黄丽,张鑫,黎广智,王永飞,李小波,金小宝,黄博,3*
(1.广东药科大学广东省生物活性药物研究重点实验室,广东 广州 510006;2.暨南大学生命科学技术学院,广东 广州 510632;3.广东药科大学生命科学与生物制药学院,广东 广州 510006)
疟疾是全球三大传染病之一,广泛流行于热带、亚热带及温带边缘等地区,其严重影响流行区人口的健康和生命,并长期制约当地社会经济发展。据WHO《World Malaria Report 2021》,2020 年全球疟疾发病人数估计2.41 亿,死亡人数估计62.7万[1]。疟疾的临床症状复杂多变,轻者出现发烧、出汗和寒冷等,重者出现急性肾损伤、肺水肿、黄疸、贫血、甚至死亡[2]。肝脏参与疟疾感染进程,一方面作为红外期肝细胞内裂体增殖所必需的器官,另一方面作为红内期肝脏中的红细胞内裂体增殖所致宿主致病和死亡的主要参与器官[3]。疟疾感染导致的肝损伤是一种发生率较高、但尚未受到足够重视的并发症[4]。临床研究发现,疟疾患者的肝脏出现不同程度的损伤(包括肝肿大、黄疸、转氨酶升高和门脉内炎性细胞浸润等)、甚至肝功能衰竭和肝细胞坏死等[4-5]。动物实验发现,感染鼠源性疟原虫(P. bergheiANKA)的小鼠肝脏出现充血、疟色素沉积、肝细胞空泡样变性和萎缩以及微血管堵塞等[6]。尽管已有研究提示疟疾肝损伤与高虫荷、氧化应激、疟色素沉积、炎症细胞浸润和免疫细胞功能异常相关[5],然而其损伤机制尚未完全阐明。疟原虫具有复杂的生活史和多种免疫逃避策略等独特的生物学特征,深入研究疟原虫-宿主间的相互作用将有助于阐明疟疾肝损伤的致病机理,为探索新的治疗方案或研发有效的疟疾疫苗提供新方向。
外泌体(exosome)是一种细胞分泌到胞外的、直径为30~100 nm 的多囊泡体,其携带lncRNAs、microRNAs、蛋白质和脂质等多种成分,介导细胞间短/长距离的通讯并调控细胞功能[7]。越来越多的研究发现,包括疟原虫、阴道毛滴虫、弓形虫和锥虫等多种寄生虫均可分泌外泌体[8]。寄生虫源性外泌体具有传递毒力因子、抗药基因和分化因子功能,在寄生虫的繁殖和致病,调控宿主免疫应答等方面发挥重要作用,从而实现寄生虫-寄生虫间和寄生虫-宿主之间的相互作用等[8]。已有研究表明,恶性疟原虫(P.falciparum)感染人体后,感染疟原虫红细胞(infectedred blood cells,iRBC)分泌的外泌体数量明显增加,且与患者的病理损伤程度呈正相关[9],提示疟原虫源性外泌体可能参与疟原虫侵袭和疟疾发病过程。然而,Martin-Jaular 等[10]发现感染约氏疟原虫(P. yoelii17X)小鼠血浆外泌体可以诱导小鼠机体产生高水平的IgG2a和IgG2b,进而增强小鼠抵抗P.yoelli17X感染能力。可见,疟原虫源性外泌体在疟原虫-宿主间的相互作用中的生物学功能复杂,其在红内期肝损伤中作用的报道较少。因此,本文利用P.bergheiANKA 感染昆明小鼠模型,研究感染P. bergheiANKA 小鼠血清外泌体对红内期肝组织病理损伤的调节作用,并探讨分析其潜在的致病机制。
1 材料与方法
1.1 实验动物和虫株
雌性昆明小鼠,6 周龄,体质量约20 g,由广东省实验动物中心提供,生产许可证号SCXK(粤)2021-0093。小鼠饲养于广东药科大学实验动物中心,采用SPF 级小鼠标准饲料和高压灭菌水喂养。P. bergheiANKA 株由广州中医药大学科技产业园有限公司惠赠,并于液氮中冷冻长期保存。
1.2 感染期血清外泌体的提取和鉴定
共计12 只雌性昆明小鼠经腹腔注射1.0×106个P.bergheiANKA 寄生红细胞(iRBC)/只。当红细胞原虫感染率达约40%时,乙醚麻醉小鼠,眼球取全血,1000 r/min离心3 min收集血清。按照血清型总外泌体分离试剂盒说明书(No. 4478360#, Invitro‐gen)富集感染小鼠的血清外泌体。具体步骤如下:血清经3000 r/min 离心30 min,弃沉淀。将5 mL 外泌体分离试剂加入10 mL 上清液,12000 r/min 离心30 min,收集外泌体沉淀,并加入PBS(50 μL)重悬沉淀。TEM 负染色观察外泌体的形态:将5 μL分离后的感染小鼠血清外泌体重悬于PBS(40 μL)中,涡旋均匀。取10 μL 重悬液滴加铜网上室温沉淀5 min,接着滴加10 μL 乙酸双氧铀溶液铜网上染色2 min,FEI Tecnai G2 Sprit Twin TEM(FEI, USA)观察。Western blot 检测感染期血清外泌体表面的CD9 和CD63 表达:BCA 法测定外泌体或感染红细胞裂解物的蛋白浓度,50 μg 蛋白(外泌体或感染红细胞裂解物)依次进行SDS-PAGE电泳、转膜、5%脱脂奶粉封闭、一抗(anti-mouse CD9,稀释倍数1∶1000;antimouse CD63,稀释倍数1∶1000;BD Biosciences,USA)4 ℃孵育过夜、二抗(anti-mouse antibodies conjugated with horseradish peroxidase,稀释倍数1∶5000;Jackson Immunoresearch Labs Inc., USA)室温孵育1 h、ECL A/B 混合液显色、曝光、凝胶图像保存,应用Alpha 软件分析目标蛋白的灰度值。以β-actin蛋白为内参照。
1.3 实验分组
将48 只雌性昆明小鼠随机分为4 组:正常对照组(即Control 组,8 只)、外泌体组(即Exos 组,8 只,每天每只鼠经尾静脉注射50 μg 外泌体)、感染组(即Pb组,16 只,每只鼠经腹腔注射106个iRBC)和感染+外泌体组(即Pb+Exos 组,16 只,每只鼠腹腔感染106个iRBC,且感染后每天每只鼠经尾静脉注射50 μg 外泌体)。当小鼠呈现共济失调、瘫痪、抽搐、昏迷等神经系统功能障碍的症状时,且在24 h内死亡,即可判断为脑型疟模型小鼠。记录各组小鼠的脑型疟发生率和生存时间。薄血膜吉姆萨染色法计数红细胞原虫感染率:取尾静脉血制备薄血膜片,经甲醇固定,吉姆萨染色,流水冲洗和自然晾干,在光学显微镜(×1000)下血球计数仪检测红细胞原虫感染率。红细胞原虫感染率=100%×iRBC数/红细胞总数。
1.4 H&E染色观察肝脏病理变化
于感染后第9 天,取各组小鼠肝组织,10%(φ)中性多聚甲醛溶液中固定48 h,经梯度乙醇脱水、常规石蜡包埋后,切成5 μm 厚度的切片。经苏木素-伊红(H&E)染色后光学显微镜下(Leica, Germany)观察肝组织病理学变化情况(×100),并计算肝组织的炎症点密度(即炎症点/视野)。
1.5 免疫组化染色与观察肝组织M1 型巨噬细胞标识物iNOS表达
感染后第9 天的肝组织切片依次经二甲苯脱蜡,梯度乙醇复水,柠檬酸盐缓冲溶液微波炉加热修复抗原,3.0%H2O2阻断内源性过氧化物酶,山羊血清室温封闭,一抗[兔源iNOS 抗体(Affinity,稀释比1∶200)]4°C孵育过夜,二抗[山羊抗兔IgG(H+L)HRP(Affinity,稀释比1∶200)]室温孵育50 min,DAB 显色,苏木素复染,中性树胶封片,置于普通光学显微镜下(×400)观察拍照,计算iNOS 染色阳性细胞数目。
1.6 qPCR 检测肝组织促炎症/抑炎症细胞因子的mRNA表达量
取各组感染后第9天的肝组织约100 mg置于1 mL Trizol 液中,按照试剂盒说明书提取组织总RNA(No. 9109#, TaKaRa)。按 照PrimeScriptTM1st Strand cDNA Synthesis Kit 说明书(No.6210B#,TaKaRa)将1 μg RNA 逆转录为cDNA,使用SYBR®Premix Ex Taq TM(2×)试剂盒方法在CFX96 Touch实时荧光定量PCR系统(BIO-RAD,USA)中测定肝组织促炎症/抑炎症细胞因子的mRNA表达量。qPCR反应体系:1.0 μL的模板cDNA,5.0 μL2×SYBR PremixExTaq,0.5μL上引物,0.5 μL下引物,并加灭菌蒸馏水至10 μL。qPCR 反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火20 s,70 ℃延伸5 s,43 个循环;70 ℃延伸10 min。促炎症/抑炎症细胞因子和内参β-actin 的引物序列见表1。采用2-ΔΔCt法计算细胞因子的mRNA相对表达量。

表1 qPCR反应的基因及其引物序列Table 1 Primer sequences of target genes used for qPCR assays
1.7 统计学分析
应用GraphPad Prism 5 软件对数据进行统计学分析,实验数据以表示。两组间比较采用独立样本的t检验,多组间比较应用one-way ANOVA 检验。采用Log-Rank test 和a time-series analysis test法分别分析两组间生存时间(即半数生存期)和每天红细胞原虫感染率。P<0.05 为差异有统计学意义。
2 结果
2.1 感染期血清外泌体的提取和鉴定
TEM 结果显示(图1A):感染期血清外泌体呈典型的“杯盘”形态特征,其颗粒直径为30~150 nm,与经典外泌体结构高度一致;Western blot检测到感染期血清外泌体的CD9和CD63表达呈阳性,而感染红细胞裂解物罕见或未见CD9和CD63表达(图1B)。上述结果表明:利用血清型总外泌体分离试剂法成功富集感染期血清外泌体。
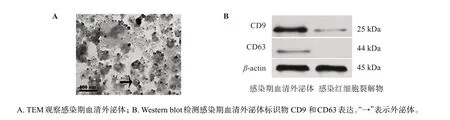
图1 感染期血清外泌体的鉴定Figure 1 Characterization of serum-derived exosomes from infected mice
2.2 感染期血清外泌体对感染小鼠生存时间、脑型疟发生率和红细胞原虫感染率的影响
Control组和Exos组小鼠正常存活,且未见任何异常症状和原虫血症。然而,Pb组小鼠在感染后第7 天出现死亡,第22 天全部死亡。感染+外泌体组(Pb+Exos)小鼠在第7 天出现死亡,第18 天小鼠全部死亡(图2A)。Pb组和Pb+Exos 组均发生脑型疟模型小鼠,且小鼠出现脑型疟症状时间均为感染后第7~9 天。与Pb组相比,Pb+Exos 组小鼠的脑型疟发生率显著上调(27%vs48%,P=0.002,图2B),而半数生存期显著下调(17.5 dvs11.5 d,P=0.005,图2A)。薄血膜吉姆萨染色显示:与Pb组相比,Pb+Exos 组小鼠红细胞原虫感染率在感染后第3~18 天差异均无统计学意义(图2C)。

图2 感染期血清外泌体对感染小鼠的生存时间(A)、脑型疟发生率(B)和红细胞原虫感染率(C)的影响Figure 2 Effect of serum-derived exosomes from infected mice on the survival time (A), cerebral malaria incidence (B), and para‐sitemia(C)in P.berghei ANKA-infected mice
2.3 感染期血清外泌体对小鼠肝组织病理变化的影响
H&E 染色显示(图3):Control组和Exos组小鼠肝组织结构清晰、正常,肝细胞形态结构完整,肝索以中央静脉为中心呈放射状分布,罕见或未见炎性细胞浸润。然而,Pb组小鼠肝脏结构紊乱,可见大量炎症细胞浸润和未被降解的疟色素。与Pb组相比,Pb+Exos组小鼠的肝脏坏死区域显著增加,伴随显著增多的炎性细胞聚集和浸润(~12 个炎症点/视野vs~30 个炎症点/视野,P=0.002),差异有统计学意义。
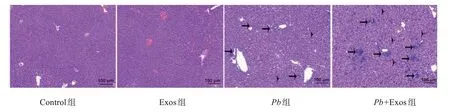
图3 感染期血清外泌体对感染小鼠肝组织病理损伤的影响Figure 3 Effect of serum-derived exosomes from infected mice on histopathological change of liver tissues in P. berghei ANKAinfected mice(HE,100×)
2.4 感染期血清外泌体对小鼠肝组织M1 巨噬细胞极化的影响
免疫组化结果显示(图4):Control 组或Exos 组的小鼠肝组织罕见或未见M1 型巨噬细胞标记物iNOS 表达。Pb组小鼠肝组织的iNOS 表达呈现阳性,且与Control 组相比显著增加,差异有统计学意义(P<0.01);此外,Pb+Exos 组肝组织M1 型巨噬细胞极化标记物iNOS的表达水平与Pb组相比显著增加,差异有统计学意义(P<0.05)。上述结果表明感染期血清外泌体可促进感染小鼠肝组织的巨噬细胞增殖和M1极化。

图4 感染期血清外泌体对感染小鼠肝组织M1型巨噬细胞标识物iNOS表达的影响(免疫组化,400×)Figure 4 Effect of serum-derived exosomes from infected mice on the expression of iNOS in liver tissues of P. berghei ANKAinfected mice
2.5 感染期血清外泌体对小鼠肝组织促炎症/抑炎症细胞因子表达水平的影响
qPCR 检测显示(图5):Exos组小鼠肝组织的促炎症细胞因子(TNF-α、IL-1β和IL-6)和抑炎症细胞因子(IL-4 和IL-10)的mRNA 表达水平与Control组相比差异均无统计学意义(P>0.05)。与Control 组相比,Pb组小鼠肝组织TNF-α(P<0.001)、IL-1β(P<0.001)、IL-6(P=0.003)、IL-4(P<0.001)和IL-10(P<0.001)等基因mRNA 表达水平均显著上调。此外,与Pb组相比,Pb+Exos 组小鼠肝组织TNF-α(P=0.003)、IL-1β(P=0.035)和IL-6(P=0.006)的mNRA表达水平显著上调,而IL-4(P=0.010)和IL-10(P=0.007)表达水平显著下调。
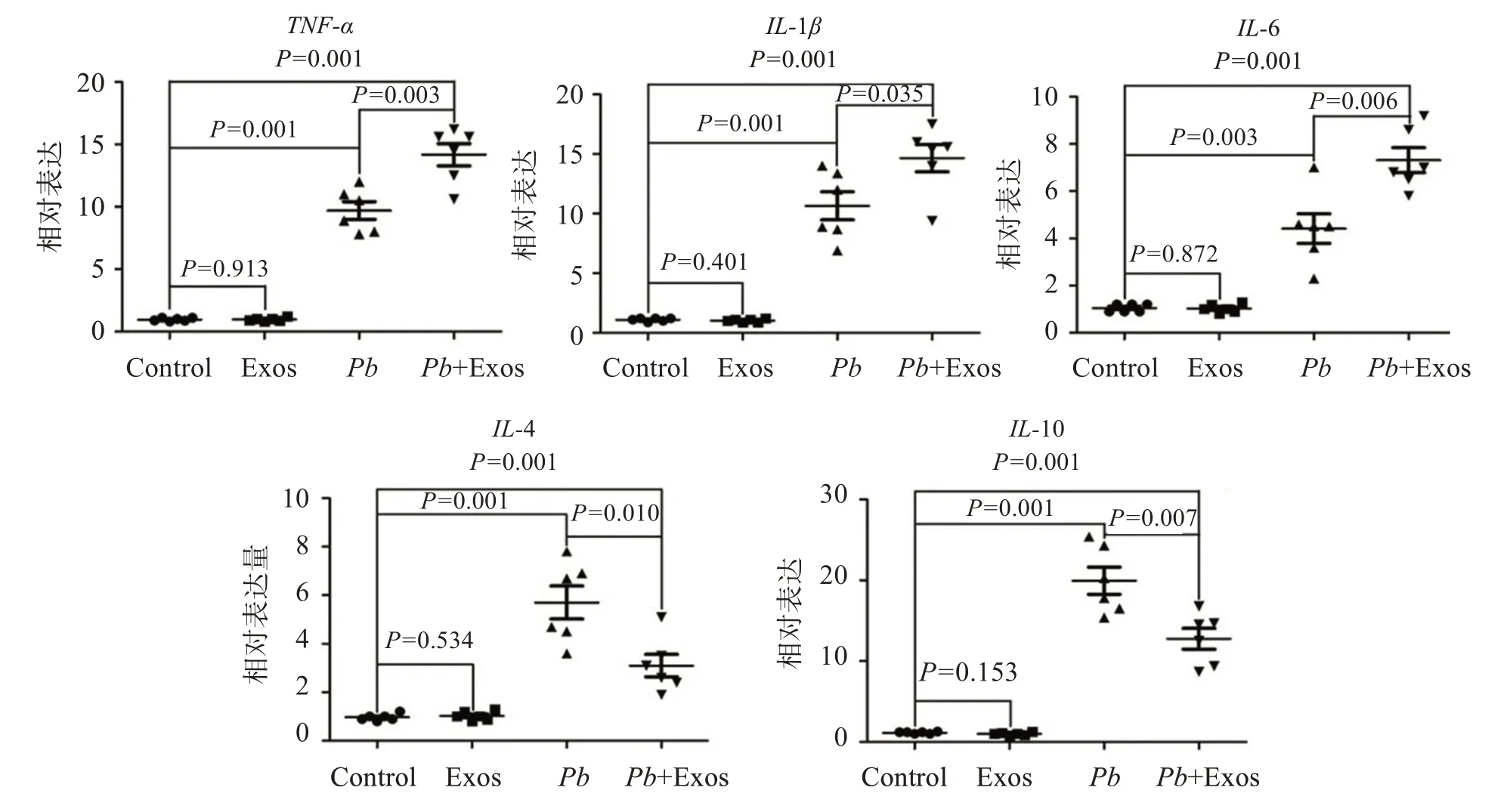
图5 感染期血清外泌体对感染小鼠肝组织促炎症/抑炎症细胞因子mRNA表达水平的影响Figure 5 Effect of serum-derived exosomes from infected mice on the expression of pro-inflammatory/anti-inflammatory cytokine mRNA in liver tissues of P.berghei ANKA-infected mice
3 讨论
疟疾肝损伤是一种发生率较高、但尚未受到足够重视的并发症,且其损伤机制尚未完全阐明。作为固有免疫细胞的重要组成部分,肝组织中的巨噬细胞严格调控疟原虫的感染进程,一方面非特异性吞噬、清除感染疟原虫的红细胞和抑制疟原虫释放到血液,另一方面因其异常激活诱导过度的炎症反应加重红内期肝组织的病理损伤[11]。已有研究表明肝组织中的CD68+阳性巨噬细胞可作为子孢子突破窦周屏障实现侵袭肝脏的主要载体之一[12]。越来越多的研究证实巨噬细胞分化为M1 型(促炎症作用)和M2 型(抑炎症及促修复作用),而一旦巨噬细胞M1/M2 型极化失衡,将导致多种疾病的发生、发展和转归[13-14]。感染P.bergheiANKA的小鼠小肠组织的CD68+阳性巨噬细胞的数量明显升高,而巨噬细胞M1 型极化则加重感染小鼠的小肠组织病理损伤[15]。然而,关于巨噬细胞M1 型极化在疟原虫红内期肝组织病理损害作用及其调控因素的相关报道较少见。
尽管Martin-Jaular 等[10]发现感染P. yoelii17X小鼠血浆外泌体诱导BALB/c 小鼠机体产生较高水平的IgG2a 和IgG2b,发挥增强BALB/c 小鼠抵抗P.yoelli17XL 感染的作用。然而,本研究结果显示尾静脉注射感染期血清外泌体后,感染P. bergheiANKA 昆明小鼠的存活时间显著缩短、脑型疟发生率显著升高,以及肝组织的病理损伤明显加重。可见,疟原虫源性外泌体的生物学功能复杂,其损伤或保护宿主作用可能与疟原虫虫种、宿主遗传背景和外泌体来源有关。已有研究证实激活的M1 型巨噬细胞产生大量TNF-α、IL-1β和IL-6 等促炎症因子,而激活M2 型巨噬细胞后可释放大量的IL-4 和IL-10 等抑炎症因子[16]。进一步的研究表明TNF-α、IL-1β和IL-6等促炎症因子,尽管在疟疾感染早期扮演促进杀死疟原虫的关键作用,但其过度活化则导致疟疾的病理损伤[17-18]。此外,IL4 和IL-10 被认为是一类可抵抗由Th1细胞因子驱动的致命疟疾损伤反应的抗炎症因子[19]。本研究结果显示,感染期血清外泌体可上调肝组织M1 型巨噬细胞数量和促炎症因子(TNF-α、IL-1β和IL-6)的mRNA 表达水平,下调抑炎症因子(IL-4 和IL-10)mRNA 表达水平。同时,既往研究表明受脑型疟模型小鼠血浆外泌体刺激后,巨噬细胞分泌更多的TNF-α 及促进其受体超家族蛋白CD40 的表达[20]。此外,人源性疟原虫虫株(包括P.falciparum、P.vivax和P.malariae等)感染红细胞释放的外泌体或类似物与未感染红细胞相比提高10倍多,且其刺激外周血单核细胞和巨噬细胞释放促炎症因子,呈现出强烈的促炎症反应[21]。Barker 等[22]发现脑型疟模型小鼠(即C57BL/6 小鼠感染P.bergheiANKA)血浆外泌体的miR-155表达量较非脑型疟模型小鼠(即BALB/c小鼠感染P.bergheiANKA)显著升高。此外,Cohen 等[23]和Opadokun等[24]发现脑型疟模型小鼠(即CBA 小鼠感染P.bergheiANKA)血浆外泌体的miR-146a表达量较非脑型疟模型小鼠(即CBA 小鼠感染P. yoelii)显著上调。进一步研究发现miR-155 或miR-146a可分别诱导巨噬细胞M1 极化和M2 极化[25]。本研究结果提示,感染期血清外泌体诱导P. bergheiANKA 感染小鼠肝组织出现强烈的促炎症反应和加重红内期肝组织病理损伤,其原因可能与外泌体经miR-155 或miR-146a 分别促进巨噬细胞M1 极化或抑制巨噬细胞M2 极化有关。然而,感染期血清外泌体靶向调控M1 极化的作用机制有待深入研究。本研究存在一些不足之处:(1)本文缺乏正常小鼠血清外泌体对照组,以及未分离iRBC 源性外泌体;(2)本文未深入研究感染血清外泌体靶向调控巨噬细胞M1 极化的作用机制。因此,本课题组将在后期研究中检测正常小鼠血清外泌体与感染期血清外泌体的microRNAs 和蛋白表达的差异,探讨外泌体靶向调控巨噬细胞M1极化的作用机制。
综上所述,本文利用感染期血清外泌体初步探讨了疟原虫-宿主间的相互作用,研究结果提示感染期血清外泌体加重红内期肝脏病理损伤,其原因可能与促进肝脏组织巨噬细胞增殖和M1 极化有关,但其详细机制有待阐明。本研究结果可能为后续以感染期血清外泌体为靶点的疟疾肝损伤治疗提供了新思路。
——外泌体与老年慢性疾病相关性的研究进展

