基于经济学证据分析人乳头瘤病毒疫苗纳入免疫规划的可行性
周大创 马爱霞
宫颈癌是世界上最常见的女性癌症之一,据统计,2018年全球约有宫颈癌569 847 例新发病例和311 365 例死亡案例,其中超过85%新发和死亡病例发生在欠发达国家或地区,严重威胁女性生命健康[1]。人乳头瘤病毒(human papilloma virus, HPV)是已知的宫颈癌主要致病因素,HPV 持续感染是宫颈癌发生的必要条件,也是肛门癌、阴茎癌和尖锐湿疣等疾病发生的主要原因[2]。
在我国,宫颈癌的发病率和死亡率高居妇科恶性肿瘤第2 位,每年新发病例约10 万,发病逐渐趋于年轻化,而且大多数病例发病时已到中晚期,即使治愈也可能出现病情进展或复发,但宫颈癌又是唯一病因明确、可早期预防治疗、有望彻底根除的癌症。因宫颈癌疾病进展周期较长,存在较长的癌前可变期,可以通过早期宫颈癌筛查有效发现癌前病变进而避免宫颈癌的发生,但现有的筛查手段敏感度和特异度均不是非常高,难以准确发现癌前病变进而规避疾病的发生[1]。
接种HPV 疫苗相比于筛查可以更为有效地预防宫颈癌的发生,而且一次接种即可获得几近终生的免疫效果。自2016年起,二价(可预防HPV-16、HPV-18)、四价(可预防HPV-6、HPV-11、HPV16、HPV-18)和九价(可预防HPV-6、HPV-11、HPV16、HPV-18、HPV-31、HPV-33、HPV-45、HPV-52、HPV-58)HPV 疫苗先后在我国获批上市,但因疫苗价格与可及性问题致使目前疫苗接种率仍然偏低,截至2019年,全球已有90 多个国家将HPV 疫苗纳入了国家免疫规划,世界卫生组织(WHO)建议公共卫生服务决策者应当在充分考虑成本获益的基础上进行科学决策[1]。目前,我国已有将HPV 疫苗纳入医保报销或全国免疫规划的呼声,也有相关卫生经济学者所发表的药物经济学评价证据予以佐证,但尚无关于HPV 疫苗纳入报销的预算影响分析研究,药物经济学评价注重成本-效果分析,强调卫生资源配置的效率,但卫生决策者常需要在有限的资源下进行判断,更强调可支付性。因此尽管药物经济学评价结论已较为稳健,但相关卫生费用支出是否在可支付范围内仍需探讨,因此本研究将对HPV 疫苗在我国上市以来中国女性接种HPV 疫苗的相关卫生经济学或药物经济学评价进行系统分析,并建立预算影响分析模型,探讨HPV 疫苗纳入报销体系的可负担性,以期为卫生决策提供经济学证据。
1 资料与方法
1.1 HPV 疫苗的经济学评价
检索PubMed、The Cochrane Library、中国期刊全文数据库和万方数据知识服务平台等数据库中中国女性接种HPV 疫苗经济学评价相关文献。中文检索式为“宫颈癌预防OR 宫颈癌疫苗OR HPV 疫苗AND 经济学评价OR 成本-效果分析OR 成本-效用分析”,英文检索式为“China OR Chinese AND Cervical cancer vaccine OR HPV vaccine AND Pharmacoeconomics OR Cost-effectiveness OR Cost-utility”。
纳入标准:1)发表时间为2016年1月至2021年7月;2)语种为中文或英文。排除标准:1)非中、英文文献;2)个案报告、讲座、综述、会议、评论等;3)非药物经济学或卫生经济学评价研究;4)干预措施中无HPV 疫苗接种;5)研究对象并非中国女性。
1.2 预算影响分析
构建预算影响分析模型,根据HPV 疫苗纳入报销体系前后接种人数的变化以及模拟期限内患病人数的变化与治疗费用等,计算出两种情境下年度预算总额,并做出比较,进而计算出九价HPV 疫苗进入医保目录与九价HPV 疫苗不进入报销体系的年度预算差额,因本研究模拟期限等与以往的其他药品预算影响分析研究不同,考虑到报销相关单位关注的是当年的报销金额情况,但模拟期限内的平均费用差额尤其是治疗费用的减少也具有参考意义,因此本研究对平均费用差额以5%的贴现率进行贴现处理,测算九价HPV 疫苗纳入报销后对卫生费用支出的影响。模型主要以基本的发病率和病死率开展模拟,因疫苗不同于常规药品,HPV 疫苗的保护期限大多为终生,基于上述背景,模型模拟期限设定为60年,从第2年即2021—2025年目标人群开始接种HPV 疫苗,分别报告2021—2025年的预算影响和60年的总体预算影响。未接种疫苗人群每年感染该疾病的风险为该年龄的疾病发病率;接种疫苗人群每年感染该疾病风险为发病率×(1-疫苗有效率)+发病率×疫苗有效率×引起该疾病的HPV 不在疫苗保护范围内的概率。
研究有两种对比方案,即九价HPV 疫苗纳入报销体系与九价HPV 疫苗不纳入报销体系,根据HPV疫苗纳入报销体系前后接种人数的变化,计算出模拟期限内人群的患病与死亡以及相应的治疗成本等,继而得出两种情境下的医保年度预算总额,作出比较,计算出九价HPV 疫苗纳入报销体系与九价HPV 疫苗不纳入报销体系每年的年度预算差额。
为模型模拟的顺利进行,本研究作出以下假设:
1)假设从2020年起,参加基本医疗保险的人群每年增加0.27 个百分点;2)假设每年城镇职工基本医疗保险(UEBMI)和城乡居民基本医疗保险(URRBMI)的报销比例不变,分别为70%和75%;3)假设疾病相关治疗费用均可报销;4)假设所有疫苗模拟期限内签发量满足需求;5)假设HPV 疫苗进入报销后,每年接种比例会有一定提升;6)假设研究期限内疫苗持续存在保护力,不会有所衰减;7)假设宫颈癌筛查的方式与覆盖率研究期限内不会有较大改变;8)假设所有研究对象均为健康无HPV感染史女性;9)假设从2021年开始,目标人群开始接种HPV 疫苗,共接种5年,如果二价、四价和九价HPV 疫苗均未纳入报销体系,则未接种疫苗的目标人群中每年疫苗接种率为10%,如有HPV 疫苗纳入报销体系,默认将产生激励效果,则未接种疫苗的目标人群中每年接种率保持在15%。
2020年上半年,二价HPV 疫苗市场份额为5.9%,四价为59.2%,九价为34.9%。如果所有HPV疫苗均未纳入报销体系,则假定市场份额不发生较大变化,假定在九价HPV 疫苗进入医保目录后,第一年市场份额将增加8%,之后每年增长4%,2025年即结束接种,二价HPV 疫苗、四价HPV 疫苗和九价HPV 疫苗市场份额将为1.9%、35.2%和62.9%。
本研究角度为支付方角度,故成本界定时仅考虑医疗服务中产生的直接医疗成本,不考虑直接非医疗成本(如营养费、交通费)、间接成本(如生产力损失)以及隐形成本(如患者疼痛不适)。成本计算主要考虑可报销的成本,包括药品成本、医疗服务利用成本(包括静脉输液费用、诊查费用、检查检验费用以及给药相关的住院、门诊费用)、用药期间不良事件处理成本,报销相关参数见表1。
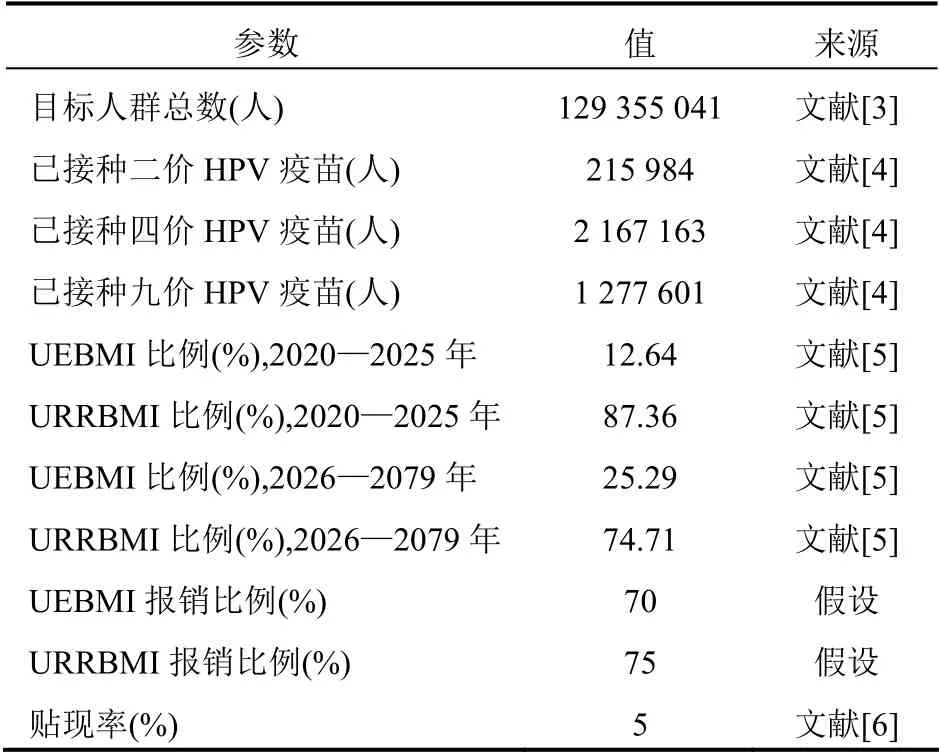
表1 基本医疗保险参保人数及比例
因HPV 所引起疾病较多,仅考虑宫颈癌可能有所误差。因此本研究将考虑宫颈癌、外阴癌、阴道癌、肛门癌、头颈癌、口腔癌、口咽癌和喉癌以及尖锐湿疣的发生与治疗,疾病诊断率假定为80%,接受治疗率假设为90%,疾病相关治疗成本与疫苗相关成本见表2~3。引起该疾病的HPV 在疫苗保护范围内的概率因篇幅所限,故不予详细展示。疫苗相关成本来源于米内网(https://3g.menet.com.cn),疫苗接种及管理费用因缺乏准确数字,故来源于实地调研费用单的数据。因HPV 疫苗上市时间较短,而且安全性较高,极少发生需要治疗的不良反应,因此,暂不考虑疫苗的不良反应治疗费用。
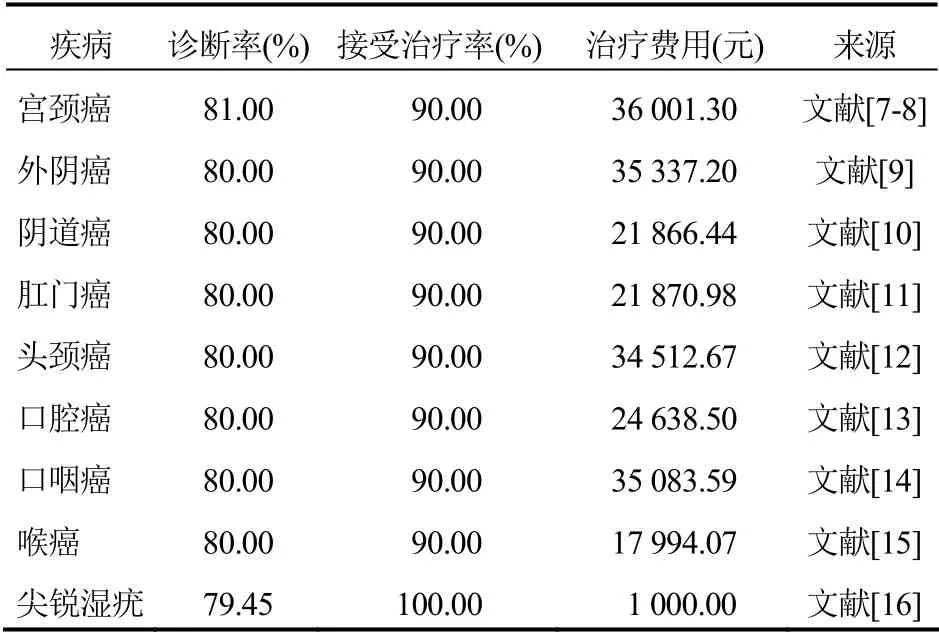
表2 HPV 相关疾病治疗成本
单因素敏感性分析结果显示,对平均差额影响最大的因素为疫苗未纳入报销每年接种率、疫苗纳入报销后每年接种率和九价HPV 疫苗费用/剂。见图1。
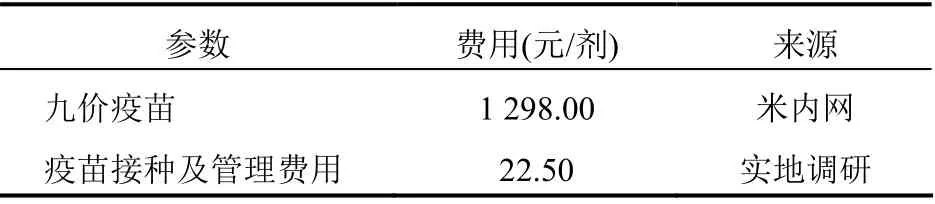
表3 疫苗相关成本
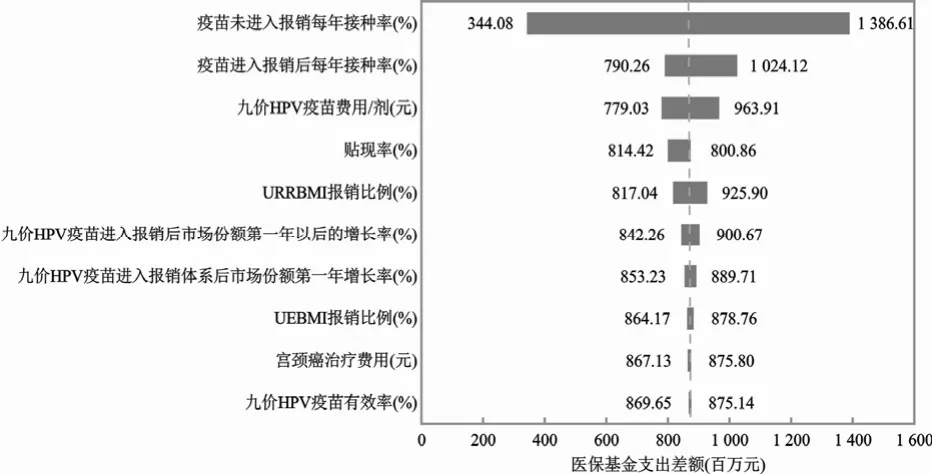
图1 单因素敏感性分析飓风图
2 结果
2.1 药物经济学评价结果
初检出相关文献105 篇,经逐层筛选后,最终纳入9 篇文献[1,7-8,16-21]。文献筛选流程见图2。
图2 文献筛选流程
2.2 预算影响分析结果
模拟期限内,由于接种疫苗使得发病率降低,治疗费用相应减少,九价HPV 疫苗不进入报销体系平均每年报销体系用于HPV 疾病治疗的相关费用支出为32 760 万元,进入报销体系则为120 975 万元,平均每年支出费用差额为88 215 万元;九价HPV 疫苗不进入报销体系平均每年医疗费用报销体系支出为32 760 万元,进入报销体系则为26 932.9 万元,每年平均节约报销体系基金58.27 百万元。将九价HPV疫苗纳入报销体系,接种疫苗的5年期间,预算将分别增加1 491 674、1 384 367、1 275 752、1 168 266和1 063 816 万元。
3 结论
本研究对2016—2021年中国女性接种HPV 疫苗的经济学评价研究进行检索,纳入11 个研究中4 个研究显示接种HPV 疫苗相比于不接种具有显著经济性和有效性[1,8,18,21];2 个研究显示疫苗联合筛查相比于单独筛查更具有效性和经济性[17,19];3 个研究显示疫苗联合筛查为诸多预防策略中经济性最优策略[7,16,20]。
本研究以2020年作为基线年,选取九价HPV疫苗适宜接种人群即16~26 岁人群作为研究对象。采用静态比例模型,通过流行病学数据对疾病治疗费用和疫苗费用进行长期测算,评估疫苗纳入报销体系的预算影响分析,结果显示,九价HPV 疫苗进入报销将会使报销基金显著增加,但在接种疫苗后,报销用于HPV 疾病治疗的支出将逐渐降低,总体来说,平均每年预算将增加88 215 万元,但可以显著降低HPV 相关疾病的感染风险和疾病负担。单因素敏感性分析结果显示平均每年预算差额结果较为稳定,在这种情况下,应当分析报销基金的短期可负担性。
4 建议
宫颈癌的发病率较高,大多数患者发病时已到了中晚期,而且治愈患者仍有可能出现病情进展或复发。但宫颈癌是一种可防可治的恶性肿瘤,接种HPV 疫苗相比于筛查,可以更为有效地规避宫颈癌的发生,而且一次接种即可获得几近终生的免疫效果。
HPV 疫苗上市仅10 余年,接种人群达到宫颈癌高发年龄可能需要数10年时间,因此对宫颈癌的预防效果目前仍缺乏真实世界数据予以佐证。但早已接种该疫苗的部分发达国家HPV 流行率显著下降,已在一定程度上佐证了疫苗的有效性[22]。HPV 疫苗的安全性已在上市前的临床试验和真实世界接种中进行了严格论证,疫苗主要不良反应为局部红肿、疼痛及发热、头痛、疲倦、晕厥、肌肉关节疼痛等,以局部红肿为常见,通常轻微,可自行缓解[23-24]。目前,在我国开展的随机对照试验已显示了HPV 疫苗的有效性和安全性[25-26]。尽管宫颈癌严重的疾病负担以及HPV 疫苗的安全有效性已被广泛证明,但决定该疫苗是否纳入报销体系,是否纳入国家免疫规划,还应考虑其可接受性、经济性、公平性和财政可负担性等因素,因此本研究提出以下建议。
4.1 加大宣传力度,提高接种意愿
尽管有研究显示我国女性HPV 疫苗接种意愿较高,但仍有研究显示年轻女性对HPV 疫苗的安全性和有效性仍然存疑[27-28]。有研究显示农村地区接种意愿明显低于城市地区[29],在欠发达地区,比起宣传专业知识,宣传“疫苗预防宫颈癌”更为直接有效,宣传“HPV 疫苗安全,不会影响生育能力”有助于引导正确舆论导向[30]。基于以上信息,应有针对性地对不同对象采取不同的宣传,在欠发达地区应采取更为直接有效的宣传手段,着重于宫颈癌的高发生率和严重的疾病负担以及HPV 疫苗对于宫颈癌的有效预防上,而对于已有一定相关知识储备基础的年轻女性,应着重于宣传疫苗的安全性和有效性,以真实世界接种数据呈现或将更具说服力。
4.2 疫苗联合筛查,规避癌症发生
HPV 疫苗不仅可以有效预防HPV 感染进而有效预防宫颈癌的发生,还对其他HPV 相关疾病如头颈癌、外阴癌、阴道癌和生殖器疣等疾病有显著的预防效果。苏格兰等地随着二价HPV 疫苗接种覆盖率的提高,宫颈病变的检出率显著下降,澳大利亚和比利时等地在接种疫苗后生殖器疣的发病率也有了显著降低。尽管HPV 疫苗接种使得宫颈病变的检出率显著下降,但并不应仅着重于提高HPV 疫苗接种率而忽视提高筛查的覆盖率,已有相关研究显示,疫苗联合筛查相比于单独筛查或疫苗,在规避宫颈癌发生方面更为有效[16]。
4.3 基于经济学证据考虑HPV 疫苗纳入报销
《药物经济学评价指南2020》认为所有应用于公共决策的药物经济学评价都应提供全社会角度的评价结果,HPV 疫苗接种的药物经济学评价最终将应用于公共卫生决策。但目前检索结果显示,并未从全社会角度出发,考虑疾病间接成本与疫苗接种保护的较为全面的经济学评价。预算影响分析结果显示将疫苗纳入报销体系长期来看具有收益,但大范围接种的短期可负担性问题仍需斟酌考虑,可以鼓励有条件的地区进行相关探索,逐步推广HPV 疫苗适龄人群的接种。
综上所述,HPV 疫苗安全性与有效性良好,我国女性大范围接种后可以降低HPV 对生命健康的威胁,降低卫生体系在预防宫颈癌和HPV 相关疾病治疗方面的支出,如若可以将其纳入免疫规划,对于消灭宫颈癌,维护女性生命健康安全具有重要意义。

