大豆豆粕及赤小豆膳食补充对鼠伤寒沙门氏菌 侵染小鼠肠道炎症的影响
李 萍,苏佳丽,杜欣军,王 硕
(1.食品营养与安全国家重点实验室,天津科技大学食品科学与工程学院,天津 300457; 2.天津市食品科学与健康重点实验室,南开大学医学院,天津 300071)
膳食成分会显著调节肠道菌群,影响肠道代谢功能[1].目前大量研究表明膳食中的多糖、纤维以及一些植物提取物等均有一定的抑菌作用.Sweeney等[2]发现海藻多糖可以促进乳酸杆菌的生长,抑制鼠伤寒沙门氏菌的繁殖.另一项研究[3]发现可发酵纤维菊粉可以抑制艰难梭菌的繁殖.Parson等[4]发现食用可溶性车前草纤维可以防止鼠伤寒沙门氏菌入侵鸡的肠黏膜.此外,还有研究表明槟榔[5]、茶籽壳[6]、石榴 皮[7]、黑豆花色苷[8]、绿茶和葡萄籽[9]等均对一些致病菌有显著的抑制作用.
豆科在中国有172个属,其中食用类最常见的是大豆和赤小豆.大豆也称为黄豆,为双子叶植物纲豆科大豆属,其种子含有丰富的蛋白质.大豆异黄酮[10]在抑菌、免疫方面有显著作用.将大豆中的油榨取之后所剩下的大豆豆粕是一种优质的蛋白饲料,常被添加进动物饮食中.赤小豆也称为赤豆、朱豆,为双子叶植物纲豆科豇豆属,其作为药食同源的物质之一,主要含有黄酮类化合物和膳食纤维等物质,现代药理研究表明其具有抗氧化、增强免疫力、抗菌、降血压、降血脂、调节血糖等多种作用[11].研究[12]表明,赤小豆乙醇提取物可以减轻醋酸性结肠炎大鼠的体质量损失,降低相应炎症指标水平,保护大鼠的结肠免受损伤.Park等[13]采用体外与体内实验验证了赤小豆提取物可以改善小鼠败血症的死亡情况,调节炎症水平.大豆和赤小豆中的成分均被报道有抑菌、增强免疫力等功能,可能对食源性致病菌侵染导致的肠炎有一定的缓解作用.
鼠伤寒沙门氏菌是一种常见的全球食源性病原体,几乎可以侵染一切动物,可引起多种人畜疾病,包括急性肠胃炎、菌血症及肠外局部感染[14].经过研究相关数据,沙门氏菌感染比其他任何细菌病原体感染造成的死亡人数都多,大多数沙门氏菌病通过食物传播,其中鼠伤寒沙门氏菌通常在牛、猪和鸡中被发现,人类通常通过食用未煮熟或受污染的食物而感 染[14-15].在沙门氏菌的感染病例中,鼠伤寒沙门氏菌约占三分之一,且鼠伤寒沙门氏菌是从致命沙门氏菌感染患者体内分离出来的最常见的沙门氏菌血清 型[15].鼠伤寒沙门氏菌可以在多种宿主中引起肠道感染,尤其是温血动物感染大多由鼠伤寒沙门氏菌引起[16].鼠伤寒沙门氏菌ATCC14028可以通过口腔进入消化道,侵入小肠黏膜上皮细胞,随后定殖于肝脏和脾脏中,并通过血液传播到全身各个部位,引起机体不良反应[17].目前临床针对鼠伤寒沙门氏菌的感染主要使用抗生素药物进行治疗,如喹诺酮和头孢曲松等[18],但也因此出现了耐药性,而饮食干预作为新的防治手段,还没有应用到沙门氏菌侵染的疾病治疗中.BALB/c小鼠对沙门氏菌较为敏感,会患上一种类似人类伤寒的全身性致命疾病[19].目前针对结肠炎等胃肠道疾病的研究[20]主要通过葡聚糖硫酸钠诱导,本研究直接使用鼠伤寒沙门氏菌对BALB/c小鼠进行侵染,更直观地反映出人类受到致病菌侵染时的一系列免疫反应.小鼠基础饲料中含有一定量的大豆豆粕,而大豆和赤小豆中的成分均被报道有抑菌、增强免疫等功能,可能对鼠伤寒沙门氏菌侵染导致的肠炎有一定的缓解作用.因此,本研究使用玉米淀粉或者赤小豆代替豆粕部分,通过调整饲料中的豆类对小鼠进行膳食干预,探讨其对鼠伤寒沙门氏菌引起的急性肠炎的缓解作用.
1 材料与方法
1.1 材料
无特定病原体(specific pathogen free,SPF)级BALB/c雌性小鼠,6周龄,斯贝福(北京)生物技术有限公司,合格证号为SCXK(京)2019—0010;鼠伤寒沙门氏菌(Salmonella entericaserotype Typhimurium) ATCC14028,天津科技大学食品营养与安全国家重点实验室;小鼠饲料,纳瑞增(天津)生物科技有限公司.
芦丁,上海源叶生物科技有限公司;亚硝酸钠,阿拉丁试剂(上海)有限公司;硝酸铝,上海凛恩科技发展有限公司;氢氧化钠,国药集团化学试剂有限公司;乙醇,天津市百世化工有限公司;沙门氏菌显色培养基,青岛高科技工业园海博生物技术有限公司;玉米淀粉,南京甘汁园糖业有限公司;明胶(食品级),河南万邦实业有限公司;赤小豆,安徽燕之坊食品有限公司;大豆豆粕,纳瑞增(天津)生物科技有限公司;小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫检测试剂盒、小鼠白细胞介素-1β(interleukin-1β,IL-1β)酶联免疫检测试剂盒、小鼠白细胞介素-10(interleukin-10,IL-10)酶联免疫检测试剂盒,南京建成科技有限公司.
HCJ-4C型磁力搅拌水浴锅,苏州东鹏仪器制造有限公司;K480-22H型超声波清洗仪,昆山欧华超声科技有限公司;5424C150339型台式离心机,艾本德中国有限公司;LBI-250型生化培养箱,上海龙跃仪器设备有限公司;SCIENTA-48型高通量组织研磨机,宁波新芝生物科技股份有限公司;OHG-914385型电热恒温鼓风干燥箱,上海新苗医疗器械制造有限公司;MR–96A型酶标仪,赛默飞世尔科技(中国)有限公司.
1.2 实验方法
1.2.1 动物实验设计
实验选用50只SPF级6周龄的BALB/c雌性小鼠进行实验,小鼠每笼5只,在相对湿度60%~80%、温度(22±2)℃、光/暗周期12h/12h的环境中饲养,自由取食和饮水.所有小鼠进行基础饲料喂养适应1周,适应期结束后实验小鼠随机分为5组,每组10只,分别为淀粉正常组(starch control group,ST)、淀粉侵染组(starch infection group,STI)、大豆豆粕侵染组(soybean meal infection group,SBMI)、5%赤小豆侵染组(5% red bean infection group,5%RBI)、10%赤小豆侵染组(10% red bean infection group,10%RBI).淀粉正常组和淀粉侵染组继续喂食普通饲料,其余3组喂食相应饲料4周进行膳食干预,每周称量一次小鼠体质量并记录.在实验开始5周后每组选取状态最好的8只开始进行灌胃,侵染组灌胃鼠伤寒沙门氏菌的菌悬液,每只小鼠单次的灌胃菌数为1.0×107个,菌悬液体积为0.1mL,连续灌胃6d,正常组灌胃相同体积的生理盐水.其间每天记录小鼠体质量与死亡情况,在第3天与第6天对小鼠粪便中的鼠伤寒沙门氏菌进行计数.鼠伤寒沙门氏菌侵染结束后,对小鼠进行眼球取血并测定血清中的炎症因子,断颈后解剖小鼠,测量结肠长度并对结肠进行病理切片[21-22].
1.2.2 鼠伤寒沙门氏菌菌悬液的制备
从-80℃冰箱中取出鼠伤寒沙门氏菌ATCC 14028,在溶菌肉汤(lysogeny broth,LB)固体平板培养基上划线,放入37℃培养箱中培养18~20h;挑取单菌落置于LB液体试管培养基中,37℃、200r/min摇床过夜培养.将培养后的菌液以1∶100的比例转接至新的LB液体试管培养基中进行扩大培养,培养至对数期(A600=0.6~1)后,取部分菌液置于离心管中,4℃、10000r/min离心30s,弃去上清液后加入相同体积的无菌生理盐水重新悬浮,再次离心,重复两次以洗去培养基;再用生理盐水悬浮细菌,使菌体浓度为1.0×107mL-1(菌体浓度用平板计数确定)[21].
1.2.3 饲料的配方与制备方法
小鼠饲料配方见表1.
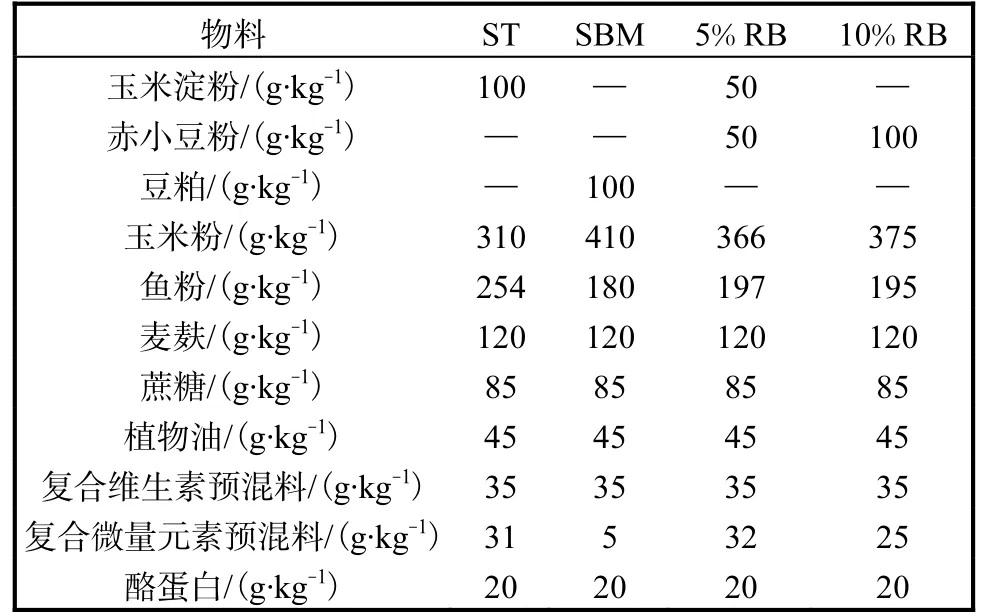
表1 小鼠饲料配方 Tab.1 Mouse feed formula
饲料制备时,按照表1称量好所有物料并混合,将预先制备好的食品级明胶水溶液(40g明胶在800mL常温水中浸泡3~4h,70℃水浴30min使其充分溶解)加到1000g饲料中搅拌,和成饲料面团.将和好的饲料面团搓成长度约为4~6cm、直径约为1cm的圆柱,放入烘箱60℃烘干.
1.2.4 小鼠饲料成分含量的测定
淀粉含量参照GB 5009.9—2016《食品安全国家标准 食品中淀粉的测定》中的酸水解法进行测定.脂肪含量参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中的索氏抽提法进行测定.蛋白质含量参照SN/T 3926—2014《出口乳、蛋、豆类食品中蛋白质含量的测定 考马斯亮蓝法》进行测定.膳食纤维含量参照GB 5009.88—2014《食品安全国家标准 食品中膳食纤维的测定》进行测定.
黄酮含量的测定[23]:以芦丁为标准品,采用NaNO2-Al(NO3)3-NaOH比色法在510nm下检测吸光度,得到标准曲线方程.将待测样品溶于20倍体积的80%乙醇溶液中,60℃水浴冷凝回流90min,超声提取20min,过滤;滤渣继续用80%乙醇溶液超声提取1次,记录滤液的总体积.取适量滤液,12000r/min离心10min,留上清液为样品溶液备用.吸取样品溶液2mL置于10mL容量瓶中,后续按照标准溶液的步骤操作,在510nm下检测吸光度.
1.2.5 生理生化指标的测定方法
鼠伤寒沙门氏菌涂板计数:取0.1g新鲜粪便用无菌生理盐水稀释10倍,研磨制成均匀的菌悬液,取适量涂布于预先制好的沙门氏菌显色培养基上,37℃培养48h后进行计数,计算每克粪便中鼠伤寒沙门氏菌的菌数(N).分别检测鼠伤寒沙门氏菌侵染第3天与第6天的粪便样本.
粪便黄酮含量的测定:参照1.2.4节中的方法进行测定.分别检测鼠伤寒沙门氏菌未侵染与侵染第6天的粪便样本.
结肠长度:在鼠伤寒沙门氏菌侵染结束后,解剖小鼠取结肠,并对其长度进行测量与记录.
小鼠血清炎症因子浓度的测定:使用ELISA试剂盒测定小鼠血清中TNF-α、IL-1β、IL-10的质量浓度,操作时严格按照试剂盒使用说明的步骤进行.其 中,血清在鼠伤寒沙门氏菌侵染结束后取得,为侵染第6天的样本.
肠道切片:肠道组织样本使用苏木精-伊红染色法(hematoxylin and eosin staining,HE)染色,即取3mm厚的组织样本进行脱水、石蜡包埋,取4μm厚的切片在HE染色后进行全景扫描.
1.3 统计学分析
使用GraphPad Prism 7.04进行统计分析,数据均以“平均值±标准差”表示.皮尔逊(Pearson)相关系数用于计算各因素之间的相关关系,*表示P<0.05,**表示P<0.01.
2 结果与分析
2.1 大豆豆粕与赤小豆饲料成分含量的对比
小鼠饲料中膳食成分的含量对比见表2.由表2可以看出:4种饲料中的主要膳食成分(淀粉、脂肪、蛋白质与膳食纤维)含量之间没有显著性差异;在黄酮含量上,ST饲料与SBM饲料之间没有显著性差异,而RB饲料的黄酮含量显著高于ST与SBM饲料的.

表2 小鼠饲料中膳食成分的含量对比 Tab.2 Comparison of dietary components in the feed of mice
2.2 小鼠生理生化指标的测定结果
2.2.1 小鼠饲养与灌胃侵染期间的体质量
在人们的日常饮食中,对鸡蛋、牛奶、猪肉、鸡肉、牛肉等食品的摄入是最为常见的,而这些都属于动物性食品。因此,加强动物检验检疫工作,减少动物性食品安全问题的发生,对保障人们的健康和国家的稳固发展具有重大意义[1]。
适应期与膳食干预期的小鼠体质量如图1所示.

图1 适应期与膳食干预期的小鼠体质量 Fig.1 Body weight of mice at the adaptive stage and the dietary intervention stage
从图1中可以看出:在前5周的适应与膳食干预期间,5组小鼠的体质量都呈上升趋势,组间无显著性差异.由表2可知:4种饲料的主要膳食成分大体一致,只有黄酮含量存在差异,说明黄酮含量的差异并未明显影响小鼠的体质量.
鼠伤寒沙门氏菌侵染期间的小鼠体质量如图2所示.从图2中可以看出:在灌胃期间,由于鼠伤寒沙门氏菌侵染小鼠肠道,所有鼠伤寒沙门氏菌侵染组小鼠的体质量均显著下降,SBMI组小鼠的体质量最先降低;由于赤小豆中含有可以抵抗鼠伤寒沙门氏菌的功能成分[24],使得RBI组小鼠的体质量在侵染初期维持平稳了一段时间,体质量损失发生的时间最晚.在侵染后期,由于小鼠体内鼠伤寒沙门氏菌的积累,使其不适反应更加强烈,活动缓慢,进食减少,使小鼠体质量出现下降趋势.因此可以推测,在鼠伤寒沙门氏菌侵染期间,摄入适量的赤小豆可以有助于短暂维持小鼠体质量,减缓侵染引起的不良反应.
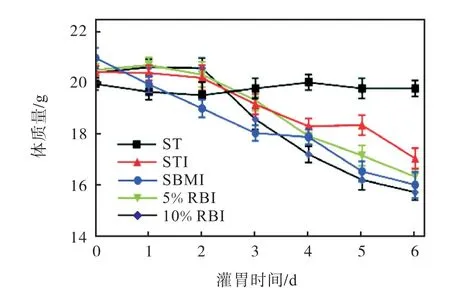
图2 鼠伤寒沙门氏菌侵染期间的小鼠体质量 Fig.2 Body weight of mice during S.Typhimurium infection
2.2.2 小鼠存活率
小鼠在受到鼠伤寒沙门氏菌侵染后,起初表现为进食量减少、行动迟缓及毛发失去光泽等症状;随着侵染次数的增加,小鼠会出现身体蜷缩、颤抖、腹泻甚至死亡等较为严重的症状.鼠伤寒沙门氏菌侵染期间小鼠的存活率如图3所示.从图3中可以看出:侵染结束,ST组没有发生死亡,STI组、SBMI组、10%RBI组死亡率均为50%,而5%RBI组存活率为75%,明显高于其他侵染组.这说明5%的赤小豆摄入在鼠伤寒沙门氏菌持续侵染过程中可以缓解小鼠的死亡情况.

图3 鼠伤寒沙门氏菌侵染期间小鼠的存活率 Fig.3 Survival of mice during S.Typhimurium infection
2.2.3 小鼠结肠长度
从图4中可以看出:未受侵染的ST组小鼠的结肠最长,受侵染小鼠的结肠均较短;从均值来看,SBMI组与5%RBI组小鼠的结肠长度可以达到与ST组的相近的状态,而STI组与10%RBI组小鼠的结肠均较短.但是,由于小鼠之间差异较大,误差较高,使得不同组之间在结肠长度上没有显著性差异.

图4 小鼠的结肠长度 Fig.4 Colon length of mice
2.2.4 小鼠粪便鼠伤寒沙门氏菌涂板计数结果
灌胃期间,由于对小鼠进行了鼠伤寒沙门氏菌的侵染,该菌在小鼠肠道中定殖,使得粪便中也存在该菌.使用小鼠粪便进行平板涂布,侵染第3天和第6天小鼠粪便的鼠伤寒沙门氏菌涂板计数结果如图5所示.
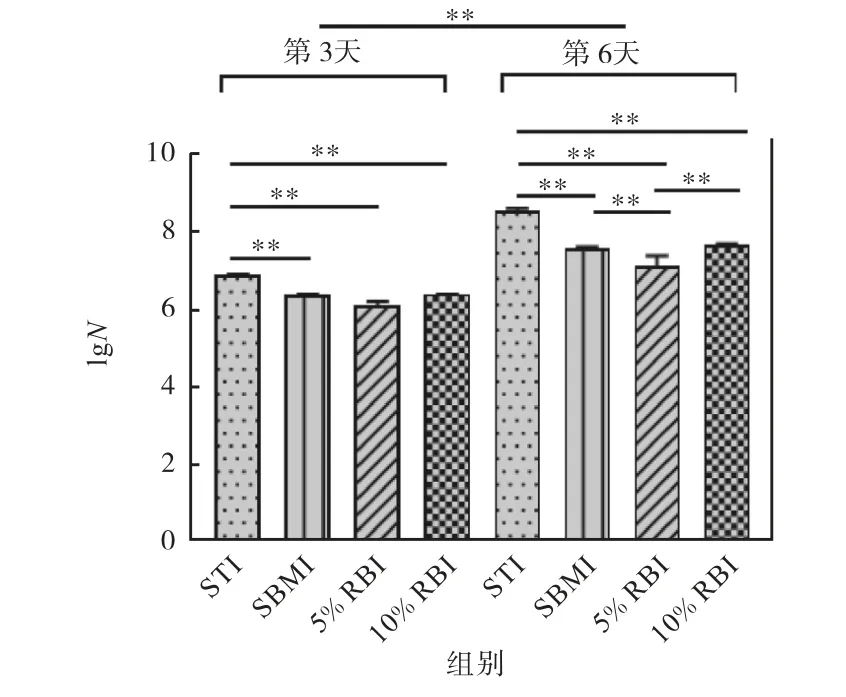
图5 侵染第3天和第6天小鼠粪便的鼠伤寒沙门氏菌涂板计数 Fig.5 Count of S.Typhimurium in feces of mice on day 3 and 6 after infection
由图5可以看出:与第3天相比,随着灌胃时间的增加,小鼠粪便中鼠伤寒沙门氏菌的含量在第6天明显增加,发生了数量级变化,而且STI组的鼠伤寒沙门氏菌数量均显著高于其他3组,说明STI组抵抗鼠伤寒沙门氏菌侵染能力最弱.在第6天,5%RBI组的菌含量显著低于其他3组,说明改善结肠炎的作用可能与减少鼠伤寒沙门氏菌在小鼠肠道中的定殖有关.而与STI组相比,10%RBI组虽然也表现出较少的鼠伤寒沙门氏菌定殖,但还是显著高于5%RBI组.结果表明,大豆和赤小豆的摄入均可以改善鼠伤寒沙门氏菌在小鼠肠道中的定殖,而5%赤小豆的摄入产生了更好的抑制效果.因此可以推测,适当的赤小豆摄入可以帮助小鼠抵御鼠伤寒沙门氏菌的侵染,但并不是越多越好.
2.2.5 小鼠粪便中总黄酮含量
研究[28]表明,黄酮类化合物具有抗病毒、抑菌、抗肿瘤、抗氧化、抗炎、降血脂等作用.侵染前后小鼠粪便中的总黄酮含量如图6所示.
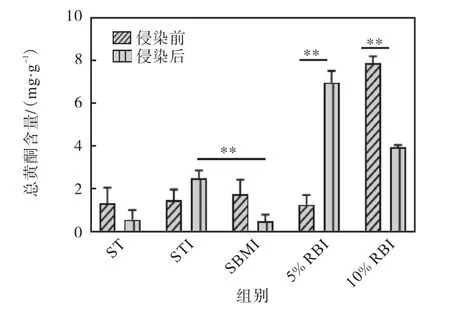
图6 侵染前后小鼠粪便中的总黄酮含量 Fig.6 Total flavonoid content in feces of mice before and after infection
从表2可以看出,ST饲料和SBM饲料中的黄酮含量极少,几乎没有,而5%RB饲料中的黄酮含量是前两者的7倍,10%RB饲料中的黄酮含量是前两者的14倍.由图6可知:RBI组的黄酮含量远高于其他组,STI组与SBMI组在侵染前没有明显的差异,而侵染后,SBMI组的黄酮含量显著低于STI组,且在侵染后5%RBI组的黄酮含量明显升高,10%RBI组却显著下降.因此,RB饲料对鼠伤寒沙门氏菌的抑制作用可能主要与黄酮的存在有关.有研究[29-30]表明,严重的沙门氏菌侵染会使宿主体内总超氧化物歧化酶(T-SOD)和过氧化氢酶(CAT)的含量降低,这可能导致宿主处于严重的氧化应激状态,肠道内的黄酮类化合物更容易被氧化分解.鼠伤寒沙门氏菌侵染后引起的肠道炎症,可能导致宿主吸收效率降低,从而表现为粪便中的黄酮含量升高.因此,粪便中的黄酮含量较侵染前升高或降低会受炎症程度的影响.SBMI组侵染前后,粪便中的黄酮含量无显著性差异,始终处于较低水平,但整体表现为降低的趋势,与10%RBI组表现类似.这可能是由于鼠伤寒沙门氏菌侵染导致小鼠肠道处于高氧化环境,使黄酮发生严重氧化,含量明显降低.而5%RBI组侵染前粪便中的黄酮含量与STI组之间无显著性差异,但5%RB饲料中的黄酮含量显著高于ST组和SBMI组,证明5%RB饲料中的黄酮大部分被小鼠吸收,而侵染后轻微的肠道炎症可能导致宿主吸收效率降低,从而表现出粪便中的黄酮含量升高.
从表2、图5和图6中可以看出:STI组与SBMI组由于其饲料中黄酮含量极低,黄酮在小鼠体内积累量减少,粪便检出量也较少;当鼠伤寒沙门氏菌侵染时,细菌正常定殖,数量增多,粪便中检出的鼠伤寒沙门氏菌浓度较高.相反,RBI组小鼠在一个月的膳食干预期摄入了较多的黄酮,帮助调节肠道,因此当鼠伤寒沙门氏菌侵染时,它可以帮助抵抗致病菌的侵害,粪便中的黄酮含量和鼠伤寒沙门氏菌计数恰好印证了这一点.然而,与5%RB饲料相比,10%RB饲料含有更高含量的黄酮,粪便中的黄酮含量也较高,但喂食10%RB饲料的小鼠并没有比喂食5%RB饲料的小鼠更能抵抗鼠伤寒沙门氏菌的侵染,反而粪便中鼠伤寒沙门氏菌数量更高.这可能是由于高含量的黄酮类化合物并没有让小鼠全部吸收,在侵染期间肠道的高氧化环境反而使其氧化损失.因此,摄入适量的黄酮可以更好地抵抗鼠伤寒沙门氏菌的侵染,但并不是越多越好,这进一步验证了之前的推断.
为了进一步了解疾病相关指标(死亡率、鼠伤寒沙门氏菌含量和体质量)与饲料膳食成分(淀粉、脂肪、蛋白质、膳食纤维和黄酮)之间的相关性,计算Pearson相关系数(相关系数为1,表示完全正相关;相关系数为-1,表示完全负相关;相关系数越接近于0,表示相关性越弱;相关系数的绝对值越大,表示相关性越强).Pearson相关系数结果如图7所示.

图7 皮尔逊相关系数 Fig.7 Pearson correlation coefficient
从图7可以看出:黄酮含量与死亡率、鼠伤寒沙门氏菌含量、体质量均为负相关,其中与鼠伤寒沙门氏菌含量和死亡率的相关性较强,与体质量的相关性相对较弱;膳食纤维含量与鼠伤寒沙门氏菌含量为负相关;淀粉、脂肪和蛋白质与小鼠其他疾病表现均为弱相关.这说明饲料中的黄酮类化合物可能帮助小鼠抵抗鼠伤寒沙门氏菌的侵染,减少死亡.
当然,赤小豆饲料对鼠伤寒沙门氏菌的抑制作用也并不能完全归因于黄酮的存在,一些其他的微量物质也可能会对其产生影响.例如锰[31]、锌[32]、铁[33]等微量元素作为人体必需的营养元素也可能在一定程度上影响致病菌侵染的进程,还有豆类中的皂苷、膳食纤维等物质也具有一定的抗菌活性[34-35].从图7中也可以看出,膳食纤维含量与鼠伤寒沙门氏菌含量呈负相关.
2.2.6 肠道切片
由于鼠伤寒沙门氏菌的侵染,细菌在肠道中定 殖,参与介导炎症反应,破坏肠道上皮细胞,导致肠道形态结构的完整性遭到破坏.对各组小鼠的结肠进行切片染色,观察其肠道形态,如图8所示.与ST组相比,STI组经鼠伤寒沙门氏菌侵染后绒毛结构松散,脱离肠壁,结肠内部无完整形态;而经过大豆豆粕和赤小豆膳食补充的小鼠基本保持着肠道完整性,绒毛排列相对整齐,肠壁无明显的损伤,其中5%RBI组小鼠的肠道内部形态结构最为完整,更接近于ST组.这进一步验证了大豆豆粕与赤小豆的膳食干预明显缓解了小鼠的肠道炎症,帮助小鼠维持肠屏障的完整性,减轻鼠伤寒沙门氏菌侵染导致的肠道损伤.

图8 小鼠结肠切片 Fig.8 Colon section of mouse
2.2.7 小鼠血清中炎症因子的浓度
肠道在受到严重创伤时会释放大量的TNF-α、IL-1β等促炎因子和IL-10等抗炎因子,小鼠血清中炎症因子的浓度可以反映小鼠肠道受损伤的严重程度[36-38].TNF-α在免疫反应中既可以作为促炎介质,引发强烈的炎症反应,又可以作为免疫抑制介质,抑制自身免疫性疾病的发展和肿瘤的发生,在维持免疫稳态中发挥重要作用[39].IL-1家族有4种拮抗因子与7种促炎因子,IL-1β作为促炎因子之一可以调节免疫、修复损伤[40].IL-10是一种作用广泛的抗炎细胞因子,可以抑制单核/巨噬细胞产生IL-1β、IL-6、TNF-α等.小鼠血清中炎症因子的质量浓度如图9所示.
从图9(a)和图9(b)可以看出:ST组小鼠未受侵 染,因此TNF-α和IL-1β的含量都极低,而STI组的含量均最高,这说明STI组的小鼠炎症最严重,鼠伤寒沙门氏菌的侵染使其产生了严重的炎症反应;SBMI组、5%RBI组与ST组小鼠的情况近似,说明大豆豆粕和赤小豆中的成分发挥了一定的作用,减轻了鼠伤寒沙门氏菌引起的炎症反应.IL-10作为抗炎因子,其含量越高则体内炎症越轻,由图9(c)可以看出其含量趋势与前两个促炎因子相反.这进一步验证了相比于ST饲料,SBM饲料与5%RB饲料更好地缓解了鼠伤寒沙门氏菌引起的肠道炎症反应.此外,从图9(b)和(c)还可以看出,5%RBI组的TNFα显著低于SBMI组的,而IL-10浓度显著高于SBMI组的,说明5%RB饲料不仅可以缓解鼠伤寒沙门氏菌引起的肠炎,还达到了比SBM饲料更好的效果.
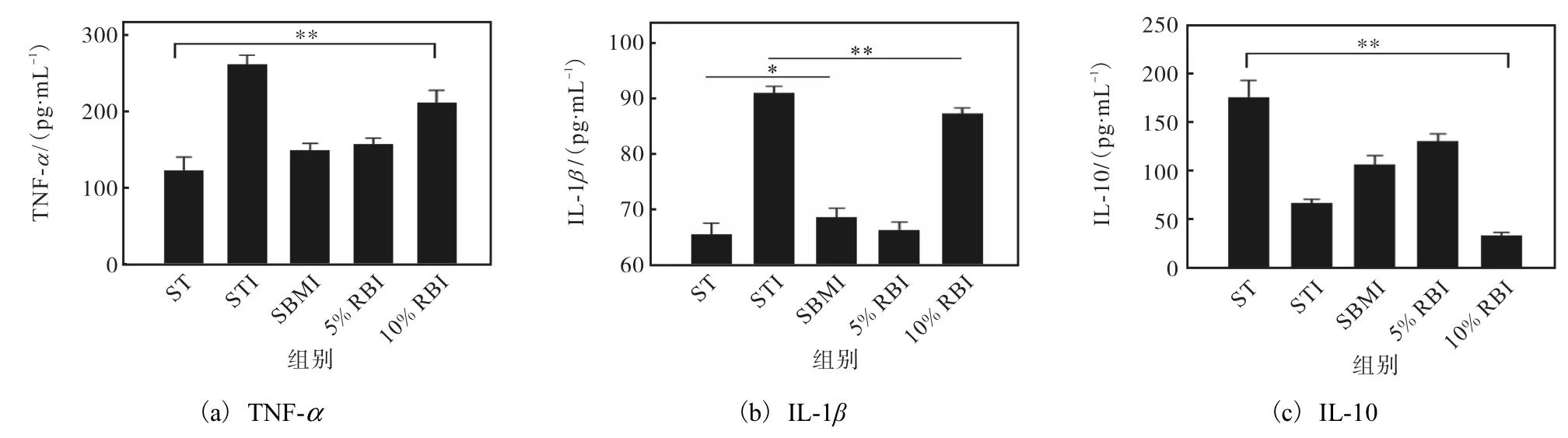
图9 小鼠血清中炎症因子的质量浓度 Fig.9 Concentration of inflammatory factors in mouse serum
黄酮类化合物可以在体内外不同程度地抑制肠道炎症.槲皮素是一种常见的抗氧化剂类黄酮,在体外能够下调骨髓源性巨噬细胞引起的炎症反应,同时可以通过抑制NF-κB通路调节DSS诱导的大鼠结肠炎[41].黄芩纯化物可以抑制TNF-α诱导的IEC-6细胞中NF-κB的激活,发挥抗炎作用[42].大豆异黄酮可以显著抑制雌激素受体α和NLRP3炎症小体的表达,改善DSS诱导的肠道炎症[43].根据以上研究推测,黄酮类化合物在缓解鼠伤寒沙门氏菌诱导的肠道炎症中发挥了重要作用.当然,赤小豆饲料对肠道炎症的抑制作用也并不能完全归因于黄酮的存在,一些豆类中的其他微量物质也可能会对肠道炎症产生影响,例如膳食纤维发酵产生的短链脂肪酸等[44-46].
3 结 论
本实验使用由鼠伤寒沙门氏菌侵染小鼠引起的肠道炎症模型探究了大豆豆粕及赤小豆对肠道炎症的影响,通过测定饲料成分中的膳食成分和黄酮含量、粪便中的鼠伤寒沙门氏菌含量、粪便中的黄酮含量、小鼠血清中炎症因子的质量浓度并对肠道切片观察,分析膳食干预对小鼠肠道炎症的改善作用.结果表明,当受到致病菌如鼠伤寒沙门氏菌侵染时,豆类中的营养物质和功能成分会对机体产生保护作用,削弱致病菌的侵染能力,减轻肠道炎症等不良影响.赤小豆减弱鼠伤寒沙门氏菌的侵染作用可能是包括膳食纤维在内的多种物质复合作用的结果,但其中的黄酮发挥了重要作用,适量摄入黄酮类化合物有助于抑制肠道致病菌的侵染.

