FSHR基因多态性与卵巢反应性及临床结局的相关研究
马卓群,杨怡卓,张蔓丽,穆莎,彭红梅*
(1.解放军医学院,北京 100853;2.中国人民解放军总医院第一医学中心妇产科,北京 100853;3.中国人民解放军总医院转化实验室,北京 100853)
在辅助生殖技术(ART)应用中,控制性促排卵(COH)是体外受精-胚胎移植(IVF-ET)这一复杂程序的关键步骤,也是获得一定数目且高质量卵母细胞和理想临床妊娠率的重要前提和保障。但因个体差异难以在COH前准确预测卵巢对外源性卵泡刺激素(FSH)刺激的反应。有些患者对外源性FSH敏感性较低,导致获卵过少,出现无可移植胚胎的情况,卵巢低反应患者在行助孕治疗总人群中大约占9%~24%[1]。而有些患者敏感性较高,易导致卵巢过度刺激综合征(OHSS),只能取消新鲜周期移植,甚至出现腹水、胸水等症状[2]。因此如何在COH过程中提前预测患者的卵巢反应性,对制定个性化的治疗方案十分重要。FSH由脑垂体前叶合成和分泌,主要通过与颗粒细胞膜表面的特异性FSH受体(FSHR)结合,发挥其调节蛋白表达和细胞发育的作用,以维持生殖系统的动态平衡。有研究表明,FSHR多态性可能影响基础FSH(bFSH)和E2水平,FSHR基因和其他基因变异可能在调节受体敏感性和其他促性腺激素(Gn)方面发挥作用[3]。近年来,有研究报道,FSHR单核苷酸多态性(SNP)可能与卵巢反应性具有一定关联[4]。因此,本研究通过前瞻性研究,对接受IVF-ET助孕治疗的不孕症女性FSHR基因rs6165(Thr307Ala)、rs6166(Asn680Ser)位点多态性进行检测,分析其与卵巢反应性及OHSS发生的相关性。
资料与方法
一、研究对象
招募2020年10月至2021年12月在中国人民解放军总医院第一医学中心生殖医学中心进行IVF-ET助孕治疗的女性患者为研究对象。纳入标准:(1)年龄≤38岁;(2)本取卵周期为首次取卵周期。排除标准:(1)输卵管、卵巢手术史或结核史;(2)化疗史、盆腹腔放疗史;(3)既往或现患有影响Gn或生殖激素分泌及代谢的疾病;(4)受试前3个月内使用药物或口服避孕药。
共纳入551例不孕症患者。本研究设计经中国人民解放军总医院伦理委员会批准通过(伦理审查号:S2020-374-01),所有研究对象均同意加入本研究并充分知情同意后签署知情同意书。
二、研究方法
1.COH:通过阴道B超监测卵巢卵泡发育情况并结合患者bFSH、抗苗勒管激素(AMH)水平和体质量指数(BMI)等各项指标制定合适的促排卵方案,如拮抗剂方案、长方案、短方案、微刺激方案等。当优势卵泡>18 mm、至少有3个卵泡≥16 mm时,肌肉注射HCG(珠丽海珠制药)10 000 U。HCG注射后36 h在超声引导下取卵。
2.IVF-ET或冻融胚胎移植(FET):对患者病史及取卵结果进行评估后选择IVF或ICSI人工授精,受精后16~18 h观察受精状态,见到双原核(2PN)者为正常受精,则继续体外培养。根据《人类体外受精-胚胎移植实验室操作专家共识》[5]和Gardner标准[6]分别对卵裂期胚胎及囊胚进行评级。根据患者病史、获卵数及取卵后有无OHSS发生风险等综合判断是否进行新鲜胚胎移植,或将可利用胚胎玻璃化冷冻后择期行FET。所有患者均移植1~2枚卵裂期胚胎或囊胚(优先选择优质胚胎),新鲜移植或FET后均行常规黄体支持。
3.SNP检测:取卵当日,抽取患者外周静脉血5 ml保存于EDTA抗凝管中;按照DNA提取试剂盒QIAamp DNA Blood Mini Kit 51106(250)(QIAGEN,德国)说明书操作,提取血液样本的DNA,并经分光光度计测定其浓度及纯度。使用Primer Premier 5.0软件进行FSHR基因SNP位点rs6165(Thr307Ala)、rs6166(Asn680Ser)的引物设计,具体引物序列见表1。本实验所需引物均由上海生工生物工程股份有限公司(北京)合成。对目的DNA片段进行聚合酶链反应(PCR)扩增,使用KOD FX Neo Polymerase试剂盒(KFX-201,TOYOBO,日本)进行实验。经预实验,两个反应可共用1个反应条件。PCR体系为50 μl,反应体系由25 μl的2×PCR buffer、10 μl dNTPs(2 mmol/L)、上/下游引物(10 μmol/ml)各1.5 μl、1 μl的DNA样品、10 μl灭菌蒸馏水和1 μl KOD FX(1.0 U/μl)组成。扩增条件:94℃×2 min;98℃×10 s,55℃×30 s,68℃×30 s,35个循环;68℃×5 min。PCR反应完成后,使用1%的琼脂糖胶电泳分析PCR产物,观察显影结果,拍照保存并导出图像。目标DNA片段切胶回收,将回收纯化的PCR产物送至上海生工生物工程股份有限公司(北京)进行一代测序。测序结果返回后,通过Chromas软件查看测序质量和结果,并利用Mutation Surveyor 4.0.5软件将测序结果与原序列进行比对分析,确定是否存在特异的SNP位点,并统计基因型。

表1 FSHR基因SNP引物
4.研究分组:根据多态性位点基因型检测结果,将rs6165(Thr307Ala)分为A/A组(273例)、A/G组(224例)和G/G组(54例),rs6166(Asn680Ser)亦分为A/A组(272例)、A/G组(231例)和G/G组(48例)。
5.观察指标及判断标准:记录患者的一般资料[年龄、BMI、基础窦卵泡数(AFC)、AMH、bFSH、bLH水平]、促排卵及胚胎发育情况(促排天数、外源性FSH剂量、总卵泡数、获卵数、MⅡ卵母细胞数,正常受精数、正常卵裂数、优质胚胎数、囊胚形成率)、临床妊娠率,以及各组中卵巢反应情况和OHSS发生率。
胚胎移植后14 d行血HCG检测,阳性者于移植后28 d行阴道超声检查,见宫腔内孕囊及胎心搏动者确定为临床妊娠。卵巢低反应指获卵数≤4枚者,正常反应指5枚≤获卵数≤15枚,高反应指获卵数>15枚。
三、统计学分析

结 果
一、一般情况
本研究共纳入551例患者,FSHR基因SNP位点rs6165、rs6166各等位基因与基因型的分布情况见表2。
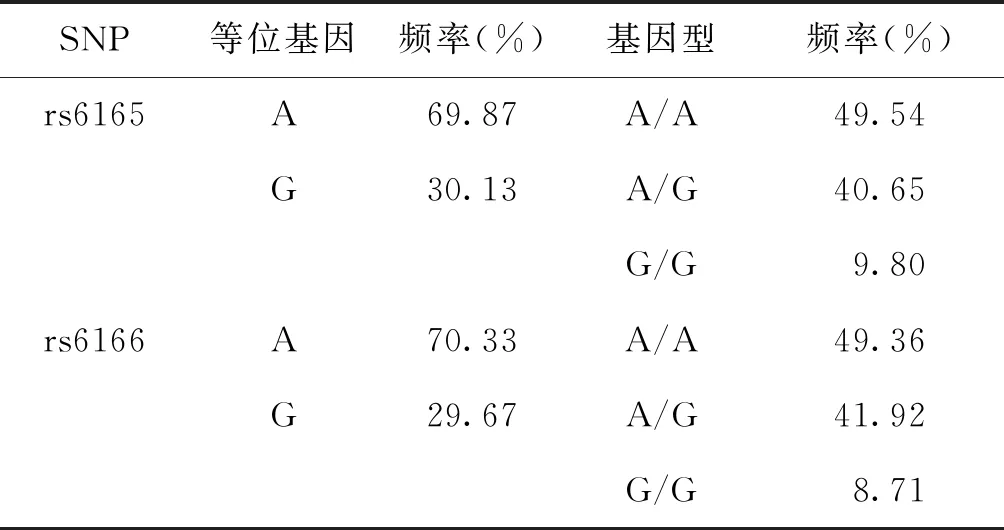
表2 FSHR基因SNP位点rs6165、rs6166等位基因与基因型分布情况
二、rs6165(Thr307Ala)不同基因型组间比较
rs6165(Thr307Ala)3种基因型分组的患者年龄、BMI、AMH等一般资料比较均无显著性差异(P>0.05)(表3);3组患者的促排卵天数、外源性FSH剂量、总卵泡数、获卵数亦无显著性差异(P>0.05),A/A基因型组的MⅡ卵母细胞数显著高于A/G基因型组(P<0.05)(表4);3组患者的正常卵裂数、优质胚胎数、囊胚形成率、临床妊娠率均无显著性差异(P>0.05),A/A基因型组的正常受精数显著高于A/G基因型组(P<0.05)(表5)。
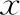
表3 rs6165不同基因型组别的一般资料比较(-±s)
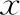
表4 rs6165不同基因型组别促排卵情况比较(-±s)
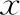
表5 rs6165不同基因型组别的受精及胚胎发育情况比较((-±s),%)
三、rs6166(Asn680Ser)不同基因型组间比较
rs6166(Asn680Ser)3种基因型分组的患者年龄、BMI、AMH等一般资料比较均无显著性差异(P>0.05)(表6);3组患者的促排天数、外源性FSH剂量、总卵泡数、获卵数亦无显著性差异(P>0.05),A/A基因型组的MⅡ卵母细胞数显著高于A/G基因型组(P<0.05)(表7);3组患者的优质胚胎数、囊胚形成率、临床妊娠率均无显著性差异(P>0.05),A/A基因型组的正常受精数、正常卵裂数显著高于A/G基因型组(P<0.05)(表8)。
表6 rs6166不同基因型组别的一般资料比较(-±s)
表7 rs6166不同基因型组别的促排卵情况比较(-±s)
表8 rs6166不同基因型组别的受精及胚胎发育情况比较[(-±s),%]
四、FSHR基因多态性与卵巢反应性及OHSS发生的相关分析
rs6165(Thr307Ala)A/A基因型组卵巢低反应发生率显著低于A/G基因型和G/G基因型(P<0.05);其余基因型中不同卵巢反应性情况无显著性差异(P>0.05)(表9)。rs6166(Asn680Ser)A/A基因型组卵巢低反应发生率亦显著低于A/G基因型和G/G基因型(P<0.05)(表10)。在551例纳入患者中,有53名患者发生OHSS,rs6165和rs6166不同基因型组别中OHSS发生率无显著性差异(P>0.05)(表9、10)。
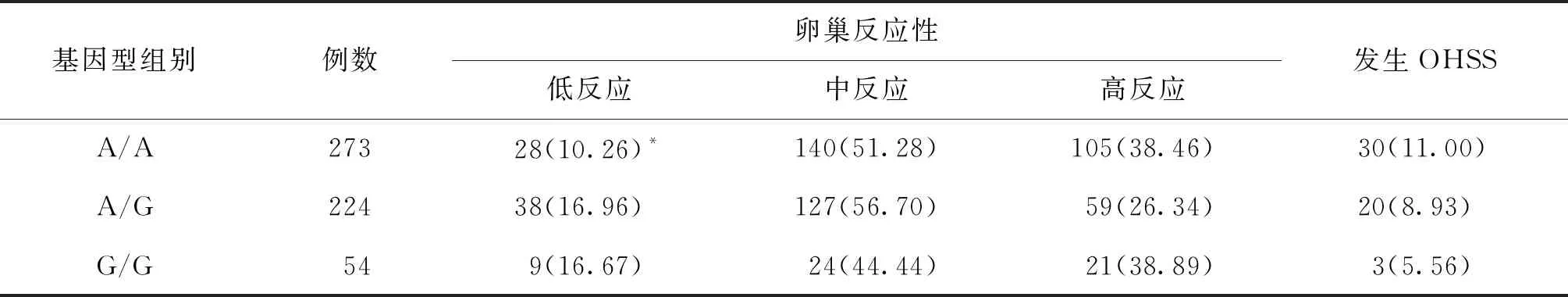
表9 rs6165不同基因型组别中卵巢低、中、高反应发生情况[n(%)]

表10 rs6166不同基因型组别中卵巢低、中、高反应发生情况[n(%)]
讨 论
目前,通过FSH、E2、AMH等激素水平检测及AFC等来预测卵巢反应性及获卵数已经成为ART过程中常规检测的一部分[7]。近年来FSHR基因多态性与卵巢反应性的关联逐渐被关注[8]。FSHR基因多态性评估尚不可以取代传统的卵巢储备检测,但是与传统检测方法相比,评估个体的FSHR基因多态性可以了解甚至更好地预测某些特定或难以治疗患者的卵巢反应性[9],对制定诱导排卵的个体化方案存在潜在价值。
本研究纳入的551例助孕女性中,SNP位点FSHRrs6165(Thr307Ala)A/A基因型和rs6166(Asn680Ser)A/A基因型是最常见的基因型,频率分别为49.54%和49.36%。之前国外学者的相关研究提出,rs6165(Thr307Ala)A/G基因型和rs6166(Asn680Ser)A/G基因型是高加索人种中最常见的基因型[10-12]。提示FSHR多态性的分布差异可能与种族、地域有关。
有研究通过监测排卵周期中垂体和卵巢激素的分泌模式,发现rs6165(Thr307Ala)参与人类月经周期时长和周期的改变[13]。有文献报道,在COH过程中,rs6165(Thr307Ala)G/G基因型的印度妇女可能更适合低剂量的FSH进行卵巢刺激,且该基因型发生OHSS的风险增加[14]。2021年一项研究提出,rs6165(Thr307Ala)A/A基因型的女性比其他基因型女性促排天数更短、所需外源性FSH剂量更少[15],但本研究中这种差异并不明显。在巴西开展的一项研究指出,基因多态性并不决定bFSH和E2水平以及ART治疗中的卵巢反应,但rs6165(Thr307Ala)G/G基因型女性的MⅡ期卵母细胞数和胚胎数量明显高于A/G基因型和/A/A基因型[16]。而本研究结果显示,rs6165(Thr307Ala)A/A基因型患者MⅡ期卵母细胞数与正常受精数均显著高于基因型A/G的患者,这可能是由于地域和人种因素导致的差别。
都在外显子10上的两个SNP即rs6165(Thr307Ala)与rs6166(Asn680Ser)之间有很强的连锁性,迄今为止大多数研究都集中在rs6166(Asn680Ser)。有研究表明,rs6166(Asn680Ser)A/A基因型女性月经周期较G/G基因型女性长2.3 d左右[17]。一项共纳入4 020例妇女的荟萃分析也证明,与其他基因型相比,rs6166(Asn680Ser)A/A纯合子基因型女性bFSH水平较高,并且需要更多的外源性FSH来诱导卵泡发育以达到相同的卵泡刺激效果,高基础水平通常预示着卵巢对FSH反应的阈值更高[18]。关于不同基因型患者的临床妊娠结局,有个别文献提出rs6166(Asn680Ser)基因型与临床妊娠结局有关,G/G纯合子基因型患者的临床妊娠率显著高于其他基因型患者[19]。同时也有一些研究指出,rs6166(Asn680Ser)基因型与卵巢反应性[20]和累积活产率[21]无关。我们的研究结果显示,各组临床妊娠率无显著性差异(P>0.05);结合之前的文献分析,认为FSHR基因多态性与临床妊娠结局之间的关系尚存在争议,可能是由于样本数量较少或人种、地域差异所致。且因为本研究设计时将临床妊娠率作为重点观察指标,故未对纳入患者的胚胎移植情况及种植率、生化妊娠率等进行分析,研究数据覆盖不够全面,研究结论存在一定的局限性,后续还需完善研究设计、延长随访时间进一步加以探讨。
综上所述,FSHR常见SNP位点rs6165(Thr307Ala)和rs6166(Asn680Ser)的不同基因型与卵巢反应性有一定关联,可以为临床制定个体化的COH方案提供参考;但其对妊娠结局及OHSS发生的影响并不明显。由于样本数量、标志物数据标准、统计描述方式、人口分层、遗传变异(遗传异质性,人口历史)、环境因素等的干扰,研究结论目前尚存在争议,将来还应考虑FSH-FSHR系统的遗传复杂性,从药物遗传学、生理学信号转导等角度进一步深入研究;且由于基因检测的成本较高,该检测方法的普及使用尚有待研究。

