HA基因真核表达载体构建及在293T细胞中的表达
李方琳,王慧慧,粟雨芯,马忠仁*
(1.西北民族大学 生物医学研究中心,甘肃 兰州 730030;2.西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
人流行性感冒(流感)是由流感病毒引起的急性呼吸道传染性疾病。据世界卫生组织估计,流感病毒每年感染率高达5%~10%,老年人是高危人群[1-2]。因此,流感在威胁公共健康的同时,也增加了国家和社会的经济负担[3]。血凝素(Hemagglutinin,HA)和神经氨酸酶(Neuraminidase,NA)是流感病毒2种表面抗原,其抗原性强,容易变异,致使人群对新毒株的免疫力下降,给疫苗研制与生产带来了挑战[4]。目前,接种流感疫苗是预防和控制流感最为有效的措施,及时接种流感疫苗,既能减少流感病毒感染,又能减轻流感症状[5]。DNA疫苗因其免疫效果好、危险性低、价格低廉、易于贮藏和运输等优点受到广泛关注[6-9]。近年来,流感病毒的DNA疫苗研究取得了较大进展。针对人流感分离株H5N1的DNA疫苗研究结果表明,该研究中所构建的H5N1的DNA疫苗能够诱导小鼠产生免疫反应[10]。此外,有学者已经成功构建出2013年暴发的禽流感的病原体H7N9的DNA疫苗[11]。本试验旨在构建甲型流感病毒(H1N1)血凝素(HA)的pcDNA3.1(+)真核表达质粒(pcDNA3.1(+)-HA),为后续其作为DNA疫苗免疫实验动物奠定基础。
1 材料与方法
1.1 材料
人肾上皮细胞系(293T)由西北民族大学生物医学研究中心冻存传代;E.coli BL21感受态细胞由西北民族大学生物工程与技术实验室制备;引物由杨凌天润奥科生物科技有限公司合成,荧光定量内参为GAPDH。
1.2 主要试剂
DL10000 Marker、DL2000 Marker、限制性内切酶BamH I和Xho I均购于TAKARA生物技术有限公司;聚合酶链式反应(PCR)试剂(北京博奥龙免疫技术有限公司),TreliefTM SoSoo Cloning Kit(北京擎科生物技术有限公司),胎牛血清(兰州民海生物工程有限公司),DMEM高糖培养基(兰州百灵生物技术有限公司),转染试剂(Invigentech公司);总RNA提取试剂(上海雅酶生物医药科技有限公司),反转录及荧光定量试剂盒(天根生化科技(北京)有限公司);β-Actin、抗甲型流感H1N1 HA抗体(兔源,Abcam);山羊抗兔IgG抗体(HRP标记,Abcam)。
1.3 方法
1.3.1 目的基因的扩增与连接 采用PCR技术,以H1N1流感病毒cDNA为模版,上游引物为5’-TGGAAATGGCTGCTTCGAGT-3’、下游引物为5’-TTGCCTCCTCGCTGTACTTG-3’,扩增目的基因大小为1 700 bp左右。PCR扩增产物经琼脂糖凝胶电泳鉴定后,进行回收与纯化。
用限制性内切酶BamH I和Xho I按表1反应体系酶切pcDNA3.1(+)质粒和目的基因,经琼脂糖凝胶电泳、纯化、回收线性载体和目的基因后,用TreliefTM SoSoo Cloning Kit进行连接。连接产物即重组质粒命名为pcDNA3.1(+)-HA。将连接产物转化至BL21感受态,37 ℃、200~220 rpm放大培养,抽提质粒后进行双酶切验证。

表1 双酶切反应体系(20 μl)
1.3.2 质粒转染及荧光定量 293T细胞由含10%胎牛血清的DMEM高糖完全培养基,于37 ℃、5% CO2的恒温培养箱中培养。转染前培养于6孔板中,当细胞密度达60%左右时,使用Invigentech公司转染试剂按照操作说明书将pcDNA3.1 (+)与成功构建的pcDNA3.1 (+)-HA重组质粒分别与转染试剂按照1∶1混匀,混合液于室温孵育10~15 min后,加入含有完全培养基的293T细胞中培养24 h后,换液培养至48 h,其中以不转染细胞作为空白对照组,pcDNA3.1 (+)转染为阴性对照组。随后提取细胞RNA并反转录,通过荧光定量观察HA基因在293T细胞中的mRNA相对表达情况。
1.3.3 蛋白免疫印迹(Western blot)检测HA的表达 各组质粒转染48 h后,经PBS清洗数次,收集细胞并加入RIPA裂解液500 μl(含有1%的PMSF),抽提蛋白。用BCA法定量,经SDSPAGE凝胶电泳后用湿转的方法转移到PVDF膜上,封闭后,孵育一抗,二抗4 ℃过夜孵育后,显影拍照并保存。
2 结果与分析
2.1 PCR扩增与重组质粒鉴定
设计引物进行PCR扩增,扩增片段大小为1 700 bp左右,与预期大小相符(图1A)。重组质粒经BamH I和Xho I酶切后,电泳结果出现1 700 bp的目的条带(图1B)。结果表明pcDNA3.1 (+)-HA重组质粒构建成功。
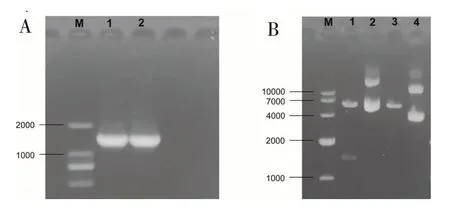
图1 HA PCR产物电泳及pcDNA3.1 (+)-HA双酶切
2.2 HA基因mRNA表达水平
将质粒转染293T细胞48 h后的荧光定量结果显示,与对照组相比,转染后293T细胞内HA的mRNA表达显著上升(P<0.000 1,图2),这一结果也进一步表明pcDNA3.1 (+)-HA重组质粒构建成功并且能在293T细胞中表达。pcDNA3.1 (+)-HA转染组HA的mRNA表达水平显著高于空白对照及空载转染组(P<0.000 1,图2)。

图2 pcDNA3.1 (+)-HA转染293T细胞后HA mRNA表达
2.3 Western blot验证pcDNA3.1 (+)-HA在293T细胞中的蛋白表达
转染293T细胞48 h提取蛋白,经Western Blot检测HA蛋白的表达。图3表明,转染pcDNA3.1 (+)-HA重组质粒组,出现特异性条带,即HA蛋白,而未转染及空载组无条带,与mRNA水平一致(图2),说明真核表达载体pcDNA3.1 (+)-HA转染293T细胞后,细胞内HA蛋白的表达明显增加。

图3 Western Blot检测pcDNA3.1 (+)-HA转染293T细胞后HA的蛋白表达
3 讨论与结论
甲型流感病毒传染性较强,容易形成大流行。HA是流感病毒表面主要的结构蛋白之一,也是甲型流感病毒主要的表面抗原,它能产生保护人类的中和抗体[12],因此是疫苗开发的靶点[13],也是DNA疫苗的聚焦点。重组质粒是研究基因功能的常用手段之一,也是DNA疫苗的主要技术。DNA疫苗作为新兴的生物技术产品已被充分肯定,应用前景较好。
为了进一步研究DNA疫苗的免疫效果,本研究通过P C R 等技术成功构建重组质粒pcDNA3.1 (+)-HA,验证后将其转染293T细胞,48 h后对细胞内HA进行mRNA及蛋白水平检测。结果表明,转染后细胞内无论是mRNA水平,还是蛋白表达水平都显著增加,证明成功构建真核表达载体pcDNA3.1 (+)-HA,可为后续DNA的研究提供材料。
——一道江苏高考题的奥秘解读和拓展

