基于代谢组学的黑老虎果实发育过程中花青苷组分动态分析
覃艳红,明如宏,姚绍嫦,2,谭 勇,2,黄 鼎,2*
(1.广西中医药大学药学院,广西 南宁 530200;2.广西中医药大学壮瑶药重点实验室,广西 南宁 530200)
黑老虎Kadsura coccinea(Lem.)A.C.Smith是木兰科南五味子属藤本植物,原生于我国西南部原始森林。其果形奇特,部分品种果实富含花青苷,营养与药用价值高,集食用、观赏、美化、绿化及药用于一体[1]。其根可药用,现代药理学研究表明黑老虎根中的木脂素和三萜类物质具有多种药理活性,如抗癌、抗HIV、抗氧化等作用[2-5];果实中富含人体所必需的多种氨基酸、矿质元素和微量元素,且维生素C和花青苷含量较高,具有良好的保健价值[6-8];此外,黑老虎的种子也具有一定的食品开发利用价值[9]。因此,黑老虎是一种具有多开发用途的特色药用植物,其种植产业可作为当地农民增收、脱贫致富的特色支柱产业,具有非常好的开发利用价值和发展前景。
黄酮类物质是植物中主要的一类次级代谢产物,普遍存在于水果、蔬菜等园艺作物中。按照其化学结构可分为4大类:黄烷酮、黄酮、黄酮醇和花青苷[10]。花青苷是属于类黄酮类的水溶性次生代谢物质,通过糖苷键以糖苷形式存在于植物的液泡中,赋予了众多园艺作物从红色、蓝色到紫色的各种色彩变化[11-13]。花青苷是一种非常有效的天然抗氧化物,它能有效猝灭自由基,在抵御心血管疾病、预防癌症和一些其他的慢性病、改善血液循环等方面有重要意义[14-17]。同时花青苷作为一种天然食用色素,资源丰富,提取工艺成熟,在医药、食品、化妆行业有着重要的应用[18-20]。
迄今为止,关于黑老虎的研究主要集中在药效成分、药理作用和种质资源遗传多样性上[21-24],而果实中花青苷组分与含量尚未见有报道。本研究采用超高效液相色谱-串联质谱(ultra-performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)方法,分析黑老虎果实发育中花青苷的组分与含量的动态变化,为黑老虎果实花青苷的研究和开发利用提供参考依据。
1 实验材料
1.1 材料与试剂 黑老虎果实来源于广西南宁市邕宁区广泽农业开发有限公司种植基地,三个果实发育时期分别为幼果期(S1)、转色期(S2)和着色期(S3)。甲醇(色谱纯,德国Merck公司);甲酸(色谱纯,美国Sigma-Aldrich公司);盐酸(优级纯,信阳市化学试剂厂)。
1.2 仪器与设备 QTRAP 6500+液相色谱-质谱联用仪(美国SCIEX公司);5424R离心机(德国Eppendorf公司);MM400球磨仪(德国Retsch公司);KQ5200E超声清洗仪(昆山舒美公司)。
2 方法
2.1 样本前处理 黑老虎果实样品真空冷冻干燥:利用球磨仪研磨(30 Hz,1.5 min)至粉末状;取50 mg的样品粉末,溶解于500μl 50%的甲醇水溶液(含0.1%盐酸)中;涡旋10min,超声10min,离心(转速12000r/min,3 min),吸取上清,重复操作1次;合并两次上清液,用微孔滤膜(0.22μm)过滤样品,并将过滤液保存于进样瓶中,用于UPLC-MS/MS分析。每个果实发育时期取5个果实研磨后混匀作为一个样品,每个时期设置3个平行实验。
2.2 总花青苷含量测定 总花青苷含量测定采用pH示差法[25]。具体操作如下:取100 mg粉末样品,加入2 ml缓冲液A(pH=1.0);另取100 mg粉末样品,加入2 ml缓冲液B(pH=4.5)。将两份混合物置离心机中,4℃下以12 000 r/min离心15 min。分别取两份样品中的上清,稀释10倍后直接在510 nm分光光度计下检测吸光值。
2.3 花青苷组分分析
2.3.1 液相条件 色谱柱:ACQUITY BEH C18(1.7μm,2.1 mm×100 mm);流动相:A相为超纯水(加入0.1%甲酸),B相为甲醇(加入0.1%甲酸);洗脱梯度:B相比例0 min为5%,6 min增至50%,12 min增至95%,保持2 min;14min降至5%,并平衡2min;流速:0.35ml/min;柱温:40℃;进样量:2μl。
2.3.2 质谱条件 电喷雾离子源(Electrospray Ioniza⁃tion,ESI)温度550°C,正离子模式下质谱电压5 500 V,气帘气(curtain gas,CUR)35 psi。
2.3.3 花青苷组分定性分析 采用Analyst 1.6.3软件处理质谱数据,参考标准品的保留时间与峰型信息,对待测物在不同样本中检测到的质谱峰进行积分校正,以确保定性的准确。基于花青苷标准品构建MWDB数据库(武汉迈维代谢生物科技公司)对质谱检测的数据进行定性分析。对所有样本进行定性分析,每个色谱峰的峰面积(Area)代表对应物质的相对含量,代入线性方程和计算公式,最终得到所有样本中待测物的定性分析结果。
2.3.4 花青苷组分定量分析 利用三重四级杆质谱的多反应监测模式(multiple reaction monitoring,MRM)分析完成。配制0.01 ng/ml、0.05 ng/ml、0.1 ng/ml、0.5 ng/ml、1 ng/ml、5 ng/ml、10 ng/ml、50 ng/ml、100 ng/ml、500 ng/ml、1 000 ng/ml、2 000 ng/ml、5 000 ng/ml不同浓度的标准品溶液,获取各个浓度标准品的对应定量信号的质谱峰强度数据;以标准品浓度为横坐标,峰面积为纵坐标,绘制不同物质的标准曲线。将检测到的所有样本的积分峰面积代入标准曲线线性方程进行计算,最终得到实际样本中该物质的绝对含量。计算公式如下:样本中代谢物的含量(μg/g)=c×V/1 000 000/m,其中c表示样本中积分峰面积代入标准曲线得到的浓度值(ng/ml),V表示复溶时所用溶液的体积(μl),m表示称取的样本质量(g)。
2.4 数据分析 使用Microsoft Office Excel 2016和SPSS 23.0进行统计分析。使用单因素方差分析(ANOVA)和Duncan倍数进行统计学评估确定显著差异,P<0.05为有显著性差异。使用Adobe Illustrator CS6绘制图片,热图使用Tbtools绘制。
3 结果与分析
3.1 黑老虎果实发育过程果实颜色变化和花青苷总量定量分析 黑老虎成熟果实呈现出紫红色。本研究选取了黑老虎果实发育过程中三个具有代表性的时期进行花青苷组分和含量的分析。如图1所示,黑老虎果实发育的幼果期(S1)果实颜色为绿色,对应花后120 d;转色期(S2)果实开始有少量变红,对应花后160 d;着色期(S3)果实已经完全变成了紫红色,对应花后200 d。通过紫外分光光度计法测定黑老虎三个不同发育时期果实中的总花青苷含量,结果显示:S1时期黑老虎果实中未检出花青苷,S2和S3时期果实中的花青苷总含量分别为(6.35±0.83)μg/g和(152.45±18.62)μg/g(图2)。从黑老虎果实发育过程中花青苷总含量的变化,结合图1中黑老虎不同发育时期果实的色泽外观的变化情况,笔者推测花青苷总含量的变化是黑老虎果实发育过程中颜色变化的主要影响因素。

图1 黑老虎三个果实发育时期颜色变化

图2 黑老虎三个果实发育时期中花青苷总含量
3.2 黑老虎果实发育过程花青苷各组分鉴定 本研究基于武汉迈维代谢生物科技有限公司开发的基于花青苷标准品构建的MWDB数据库进行靶向代谢组分析,用于鉴定花青苷组分的MWDB数据库中包含36种花青苷组分。在黑老虎S3时期的果实中,总共检测并鉴定出17种花青苷组分,其中包括2种矮牵牛花色素、3种飞燕草素、1种锦葵色素、4种芍药花色素、5种矢车菊素和2种天竺葵色素的糖苷衍生物。见表1。
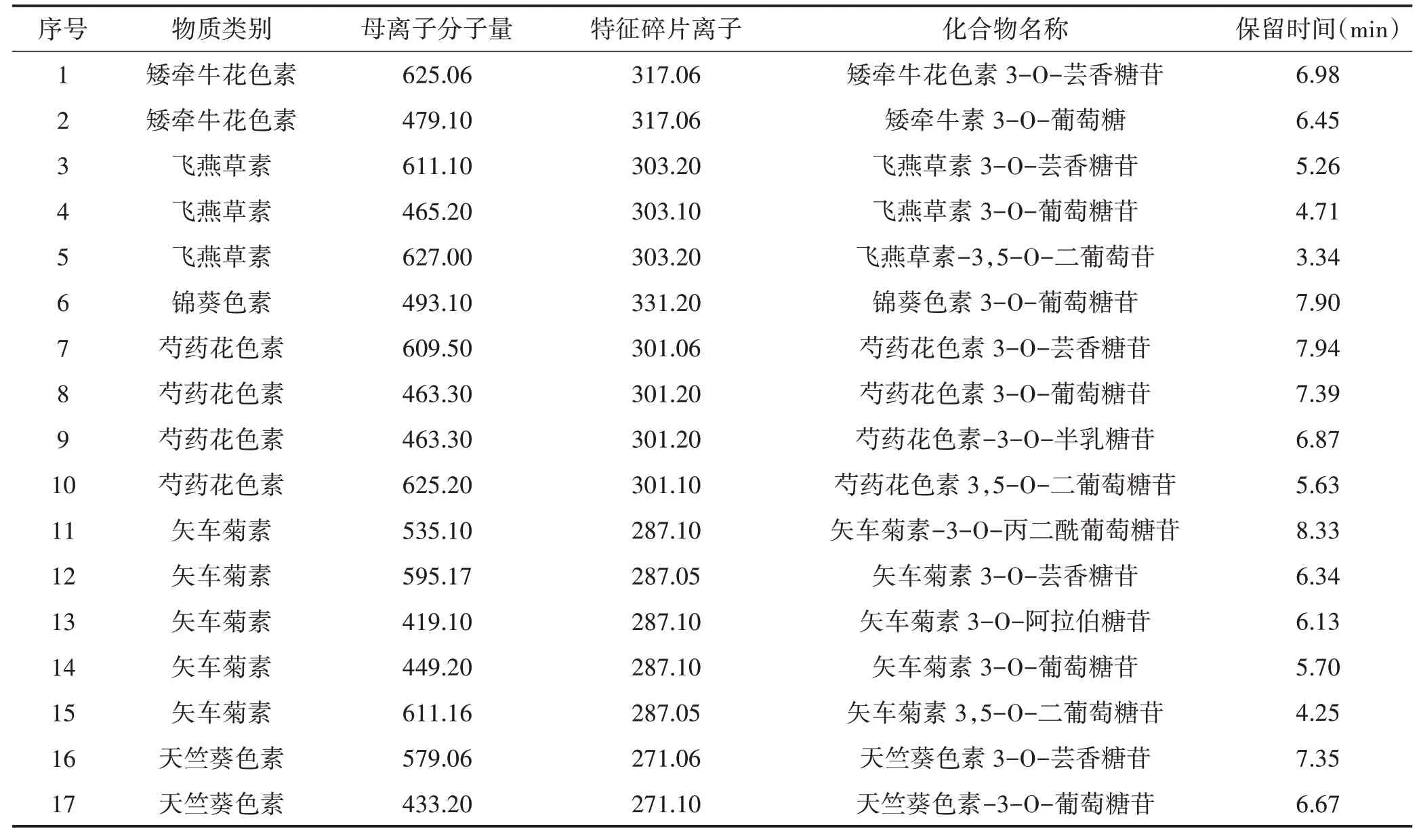
表1 17种花青苷化合物信息表
3.3 黑老虎果实发育过程花青苷各组分含量分析
3.3.1 标准曲线的制作 对黑老虎S3时期果实中鉴定到的17种花青苷组分,分别将对应的标准品按照方法2、3、4中的描述配置不同浓度的标准品溶液,获取各个浓度标准品的对应定量信号的质谱峰强度数据;以标准品浓度为横坐标,峰面积为纵坐标,绘制不同物质的标准曲线,见表2。由表2可见,本研究所检测物质的标准曲线线性方程的相关系数均大于0.99,表明构建的标准曲线方程可靠,可用于下一步黑老虎果实花青苷的定量分析。

表2 17种花青苷组分的线性关系
3.3.2 花青苷组分含量分析 通过三重四级杆质谱的多反应监测模式,检测黑老虎果实S1~S3三个果实发育时期果实中不同类型花青苷组分对应的积分峰面积,将检测到的所有样本的积分峰面积代入标准曲线线性方程进行计算,最终得到花青苷各组分的含量。黑老虎发育时期果实中17种花青苷含量如表3所示。
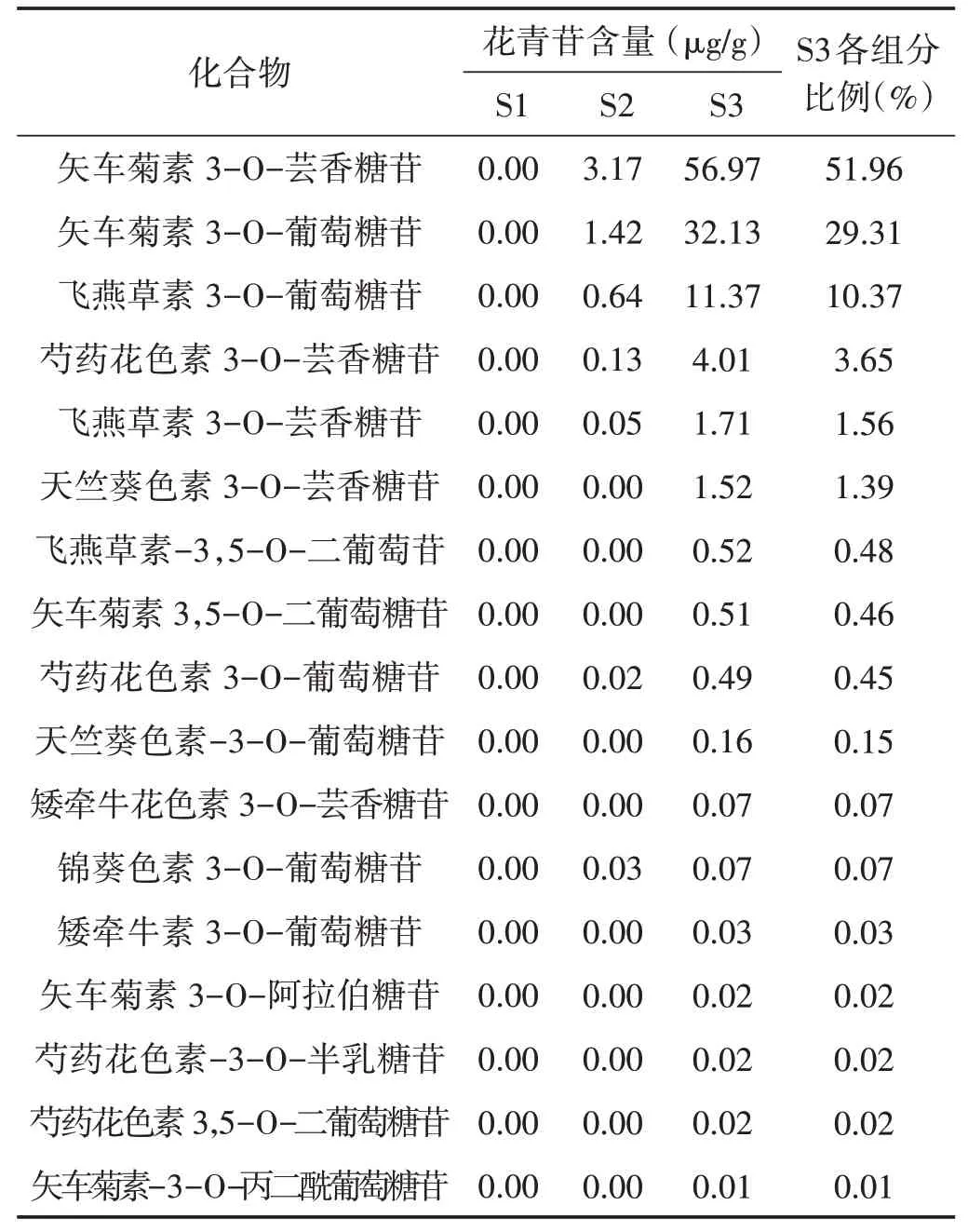
表3 黑老虎三个果实发育时期果实中17种花青苷组分含量
表3结果显示:在S3时期,果实中矢车菊素3-O-芸香糖苷占总花青苷含量的51.96%,矢车菊素3-O-葡萄糖苷占总花青苷含量的29.31%,飞燕草素3-O-葡萄糖苷占总花青苷含量的10.37%,这3种花青苷组分占检测到的17种花青苷组分总含量的91.64%,其余各花青苷组分占总花青苷含量的8.36%。因此,矢车菊素3-O-芸香糖苷、矢车菊素3-O-葡萄糖苷和飞燕草素3-O-葡萄糖苷是导致黑老虎果实紫红色外观变化的主要花青苷组分。
3.3.3 花青苷组分含量的热图显示 为了更好地展示和分析黑老虎果实发育过程中花青苷各组分含量的变化与果实色泽之间的关系,笔者采用热图来进行展示(图3)。在黑老虎果实S1时期,果实中17种花青苷组分的含量均为0μg/g(未检出)。在S2时期果实中,检测到了7种花青苷组分的含量有所增加,分别为矢车菊素3-O-芸香糖苷(3.17μg/g),矢车菊素3-O-葡萄糖苷(1.42μg/g)、飞燕草素3-O-葡萄糖苷(0.64μg/g)、芍药花色素3-O-芸香糖苷(0.13μg/g)、飞燕草素3-O-芸香糖苷(0.05μg/g)、锦葵色素3-O-葡萄糖苷(0.03μg/g)和芍药花色素3,5-O-二葡萄糖苷(0.02μg/g),但各组分的含量均较低。黑老虎果实发育S3时期果实中,7种在S2时期检测到的花青苷组分均明显增加,此外,在S3时期果实中还检测到了另外的10种花青苷组分,其中含量大于0.10μg/g的有4种,含量低于0.10μg/g有6种。

图3 黑老虎三个果实发育时期中花青苷组分热图
4 讨 论
本研究以黑老虎果实发育过程中色泽特征变化上最具代表性的三个不同时期作为切入点,运用UPLC-MS/MS技术建立了检测黑老虎果实中花青苷各组分和含量的靶向代谢组学方法,鉴定出黑老虎S3时期果实中的17种花青苷组分,并对三个不同时期黑老虎果实中各组分的含量进行了定量分析。确定了矢车菊素3-O-芸香糖苷、矢车菊素3-O-葡萄糖苷和飞燕草素3-O-葡萄糖苷是形成黑老虎果实紫红色外观最主要的3种成分,分别占总花青苷组分的51.96%、29.31%和10.37%。
花青苷是植物果实中的主要色素之一,同时也是果实成熟的标志。在许多植物的果实中,通常可以鉴定到6种不同的花青苷:矢车菊素、飞燕草素、芍药花色素、天竺葵色素、矮牵牛色素和锦葵色素。有研究表明,矢车菊素是存在果实中最普遍的花青苷类型[26]。飞燕草素、矮牵牛色素和锦葵色素通常在植物中显现出深蓝色或是紫色,而矢车菊素和天竺葵色素是鲜红色水果和花卉中的主要花青苷类型[27]。因此在本研究中,矢车菊素3-O-芸香糖苷、矢车菊素3-O-葡萄糖苷和飞燕草素3-O-葡萄糖苷作为主要的花青苷组分综合在一起形成了紫红色的黑老虎果实色泽外观,这与研究是相符的。
本研究鉴定了黑老虎紫红色果实色泽外观的主要花青苷组分,对于后续研究黑老虎果实发育过程中花青苷的变化提供了代谢物质基础,同时也为黑老虎的进一步开发利用提供了参考。

