NLR、PLR 以及网织红细胞系列指标对肥胖合并OSAHS 患者病情的临床价值分析
赵男
OSAHS 是睡眠时出现的呼吸道阻塞综合征,主要是睡眠时呼吸暂时受阻和精神状态差的临床表现。近年来,OSAHS 在全球上其发病率一直快速增加。根据相关流行病学调查证实,OSAHS 和高血压病、冠心病等疾病关系紧密。而且,肥胖人群在OSAHS 患者中的比例高达60%以上。如果不及时治疗,会增加高血压、糖尿病甚至猝死的风险。因此,有必要采取积极的减肥措施,降低重度肥胖患者发生OSAHS 的风险[1]。但是,如何及时评估肥胖合并OSAHS 的严重程度,并指导下一步的治疗,成为临床研究者面临的问题。目前,多导睡眠图(PSG)已被公认为诊断本病的金标准,但是操作过程很繁琐,患者不易接受。所以,能否提供一个既能准确诊断OSAHS,其操作又较简便的检查方式,就是现在研究的关键。研究发现,肥胖通常伴有OSAHS,而且肥胖可以诱发全身的炎症作用。而间歇性缺氧(IH)是OSAHS 患者的主要病理生理特征。同时,缺氧又可导致细胞坏死、巨噬细胞浸润的发生。另一项研究发现,IH 暴露数天后,RET 明显升高[2]。所以,通过研究上述指标的变化情况和OSAHS 轻重情况的联系,就能够得到一种便捷的生化指标对肥胖合并OSAHS 的患者进行诊断,并预测治疗效果,为临床诊治提供更多帮助。
1 资料与方法
1.1 一般资料 选取2019 年6 月~2020 年6 月沈阳医学院附属第二医院收治的20 例肥胖合并OSAHS 患者作为观察组,同时选取同期本院健康体检者20 例作为对照组。观察组男14 例,女6 例;年龄36~70 岁,平均年龄(56.2±6.7)岁。对照组男15 例,女5 例;年龄34~72 岁,平均年龄(58.4±6.5)岁。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。其中观察组依据AHI 分为轻度OSAHS 组(5 次/h≤AHI<15 次/h,16 例)与重度OSAHS 组(AHI≥30 次/h,4 例)。
1.2 诊断、纳入及排除标准
1.2.1 诊断标准 所有患者均依据《美国睡眠医学会睡眠及其相关事件判读手册》中记录的诊断标准评定为OSAHS。
1.2.2 纳入标准 ①符合诊断标准的患者;②体质量指数(BMI)≥32.5 kg/m2;生活方式变化和医疗难以控制,并满足至少2 种代谢综合征或糖尿病;③患者语言能力正常,积极配合实施PSG;④对试验目的及过程充分了解,并签署知情同意书。
1.2.3 排除标准 ①BMI<27.5 kg/m2,或者没有并发症和代谢异常综合征;②患有急慢性肝肾功能不全、肿瘤及免疫系统疾病等;③患有急慢性心肺系统疾病;④患有精神疾病或严重认知障碍者;⑤近半年接受抗凝或全身皮质类固醇治疗;⑥依从性差,不能配合完成PSG 的患者;⑦患有甲状腺功能减退(甲减)或肢端肥大症等诱发的继发性肥胖,或者已接受或正在接受减肥的患者。
1.3 方法 所有纳入者均在安静舒适的状态下,使用Anoba S4500 多导监护仪进行检查,给予患者夜间睡眠呼吸监测,使用国际标准同步记录脑电图(EEG)、眼电图(EOG)、肌电图(EMG)、胸腹呼吸、鼻呼吸气流、心率及外周血氧饱和度等,以上数据由两位医师共同分析。经数据分析后,选取18:00~19:00 采集两组外周静脉血2 ml,并通过Sysmex K-4500 全自动血液分析仪分析血液指标,包括NLR、PLR、RET 和IRF。
1.4 观察指标 比较观察组与对照组、轻度OSAHS组与重度OSAHS 组的NLR、PLR、RET、IRF 水平。
1.5 统计学方法 采用SPSS20.0 统计学软件处理数据。计量资料以均数±标准差()表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 观察组与对照组血液指标水平比较 观察组NLR、PLR、RET、IRF 水平均显著高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 观察组与对照组血液指标水平比较()
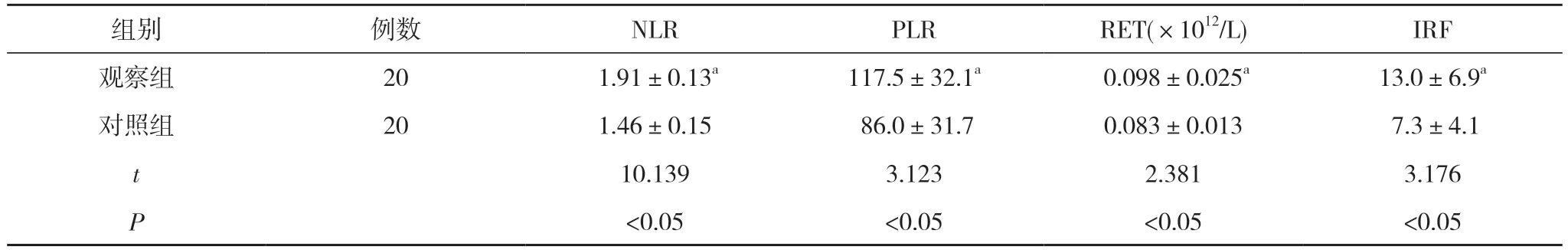
表1 观察组与对照组血液指标水平比较()
注:与对照组比较,aP<0.05
2.2 轻度OSAHS 组与重度OSAHS 组血液指标水平比较 重度OSAHS 组NLR、PLR、RET、IRF 水平均显著高于轻度OSAHS 组,差异有统计学意义(P<0.05)。见表2。
表2 轻度OSAHS 组与重度OSAHS 组血液指标水平比较()

表2 轻度OSAHS 组与重度OSAHS 组血液指标水平比较()
注:与轻度OSAHS 组比较,aP<0.05
3 讨论
OSAHS 是一种非常多见的睡眠呼吸阻塞综合征,临床症状是睡眠时发生上呼吸道的阻塞,导致呼吸被迫停止或者明显减弱,出现短暂的乏氧,致使患者睡眠质量差、白天精神差,影响其精神及生理功能[3]。而肥胖是发生OSAHS 的一个常见病因。病理上,肥胖的患者,其上呼吸道周围旁有大量的脂肪层,可压迫气道、塌陷,导致管腔狭窄,影响气流通过。人体乏氧时,会导致患者睡眠质量差,干扰正常的睡眠规律,同样导致酯类代谢功能低下。所以,肥胖和OSAHS 是互为因果的。另外,肥胖也是一种慢性的轻微炎性反应,黄海涛等[4]试验证实,肥胖与脂肪细胞增殖和细胞缺氧有关,细胞缺氧也会刺激巨噬细胞大量分泌缺氧诱导因子1(HIF-1),从而加速单糖产生,促进M1 基因的复制,导致全身炎性反应。考虑到乏氧、炎性反应等因素和OSAHS 的密切关系,肥胖患者的免疫指标水平可以明显有利于诊断OSAHS。中性粒细胞全程参与了感染性症状的祛除过程,在免疫系统中有很多作用。正常情况下恶炎性反应,其外周血的中性粒细胞计数增加,同时淋巴细胞计数减少。而NLR 同时代表两种不同的免疫表达,经常被用来诊断急性心血管疾病、恶性肿瘤和急性炎症。陆治平等[5]试验证实了OSAHS的严重程度与NLR 值具有重要关系。重度OSAHS 组的NLR 值明显高于轻度OSAHS 组,随着AHI 的增加,NLR 也相对增加,与本次试验结果基本相同。网织红细胞是介于晚期红细胞和成熟红细胞之间的一种过渡细胞,反映了骨髓的造血功能。IRF 是未成熟网织红细胞占网织红细胞总数的百分比。未成熟网织红细胞的RNA 量略少于常规网织红细胞,说明骨髓细胞的状态早于网织红细胞,在缺氧和溶血的应激下,骨髓可以通过严格的调节机制提高红细胞生成率,导致外周血循环网织红细胞增多。IH 是OSAHS 的基本生理特征。OSAHS 中血细胞的变化可能是由于缺氧产生的HIF,增强了促红细胞生成素(EPO)的产生,从而提高了基础红细胞的产生率[6]。
综上所述,IRF、PLR、NLR 以及RET 水平的变化和肥胖合并OSAHS 患者的病情轻重变化情况关系密切,所以可以通过上述指标的共同测量对肥胖合并OSAHS 的患者进行简单的诊断,预测患者的病情轻重情况。

