G蛋白偶联雌激素受体激活对脂多糖诱导的小鼠急性呼吸窘迫综合征的影响
杨 翠, 丛竹凯, 赵 峰, 沈子渊, 朱 曦
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是ICU内常见的危重病,是指各种因素引起的急性弥漫性肺水肿,病死率约为40%[1]。研究[2]发现,ARDS发生率和严重程度与性别相关。相较于女性,男性更易发生ARDS且病死率更高,因此有学者将男性列为发生ARDS的独立危险因素。性激素是这一性别偏移的重要原因之一。不同于雄激素的抑制性效应,体内雌激素具有免疫保护作用[3]。但是雌激素减轻肺损伤的机制有待阐明。此前有研究探索了经典雌激素受体-α(estrogen receptor-alpha, ER-α)参与介导了雌激素的肺保护作用[4],但是非经典雌激素受体G蛋白偶联雌激素受体(G protein-coupled estrogen receptor,GPER)对ARDS的影响有待明确。因此本研究采用脂多糖(lipopolysaccharide,LPS)气管内滴法模拟ARDS,从动物探索激活GPER对ARDS的影响,为ARDS的性别差异以及雌激素的临床应用提供实验依据。
1 材料与方法
1.1材料
1.1.1 实验动物 实验所用SPF级6~8周BALB/c系小鼠(20~25 g)均购于北京维通利华实验动物技术有限公司,购买后在北京大学医学部动物部适应性饲养2周,温度21~25 ℃,湿度约50%,保证充足的水源和食物。所有实验操作严格按照《关于善待实验动物的指导性意见》进行。
1.1.2 试剂 LPS(大肠杆菌血清型 O111:B4)和戊巴比妥钠均购自Sigma Aldrich(美国);GPER特异性激动剂(G1)和玉米油购自MedChemExpress(美国);小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)的酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)试剂盒购自R&D Systems(美国);雌激素和白蛋白ELISA试剂盒购自武汉云克隆科技股份有限公司(中国);瑞氏-吉姆撒染色试剂盒购于南京建成科技有限公司(中国);兔抗小鼠GPER抗体购于CST(美国);小鼠抗小鼠β-actin、抗体山羊抗兔IgG和山羊抗小鼠IgG均购于普利莱基因技术有限公司(中国)。
1.2方法
1.2.1 小鼠双侧卵巢去势模型 雌性小鼠双侧卵巢去势模型参照文献[5]方法。在ARDS造模前两周,雌性小鼠随机分为双侧卵巢切除(ovariectomy, OVX)组和假手术雌性(Sham)组。为确认卵巢切除手术的成功,小鼠处死后收集子宫并称重计算子宫比(子宫重量/体质量),ELISA法检测血清雌激素水平。
1.2.2 小鼠ARDS模型 小鼠ARDS模型参照文献[6]报道。小鼠称重后编号,腹腔注射G1(5 mg/kg)或等体积玉米油,30 min后对侧腹腔注射1%戊巴比妥钠(20 mg/kg)麻醉。待麻醉进入手术期后,沿颈部腹侧中线处切开以暴露气管,22号微型注射器刺穿环甲膜,注入LPS(2 mg/kg)或等体积PBS,滴注后将小鼠垂直放置1 min,以确保液体肺内均匀分布。LPS滴注后24 h,小鼠麻醉并采集心尖血处死,收集肺组织和BALF。
1.2.3 实验分组 实验包括雄性组、OVX组和Sham组,每组再随机分为四小组,即PBS组(空白对照组,小鼠腹腔注射玉米油100 μL、气管内滴注PBS 40 μL)、LPS组(即ARDS组,小鼠腹腔注射玉米油100 μL、气管内滴注LPS,2 mg/kg,体积40 μL)、LPS+G1组(小鼠腹腔注射G1 5 mg/kg,体积100 μL,30 min后气管内滴注LPS,2 mg/kg,体积40 μL)和G1组(小鼠腹腔注射G1 5 mg/kg,体积100 μL,30 min后气管内滴注PBS 40 μL),每小组12只,6只HE染色,6只用于收集肺泡灌洗液(bronchoalveolar lavage fluid,BALF)。
1.2.4 BALF收集与细胞计数 1 mL预冷生理盐水用20 G规格的静脉留置针注入肺组织反复抽吸3次,收集的BALF离心(1000 r/min,5 min,4 ℃)收集上清,分装后存于-80 °C以测定细胞因子和白蛋白。沉积的细胞沉淀重悬后,celldrop细胞计数仪计数3次后取均值,获得细胞总数;参照试剂盒说明书吉姆萨染色后,每个切片随机选取5个视野计算中性粒细胞占比,该比例乘以BALF中的细胞总数,即得BALF中性粒细胞数目。
1.2.5 HE染色 肺组织4%多聚甲醛室温48 h固定,石蜡包埋,切成5 mm厚的切片。按说明书用苏木精-伊红染色,经漂洗、脱水和透明后,中性树胶封片。数字病理显微镜下观察并扫描(每个切片随机选取5个视野),根据美国胸科学会标准[7]计算肺损伤评分。
1.2.6 BALF中细胞因子、白蛋白、雌激素和总蛋白浓度的测定 根据ELISA试剂盒说明书检测TNF-α、IL-6、白蛋白和雌激素的浓度,BCA法检测总蛋白浓度。
2 结果
2.1OVX组雌激素和子宫指数变化 与Sham组相比,OVX组雌激素水平(P<0.001)和子宫指数(P<0.0001)明显降低。见图1。

注:OVX为双侧卵巢切除组;Sham为假手术雌性组;***P<0.001;****P<0.0001
2.2G1对雌雄小鼠肺组织病理损伤的影响 滴注LPS后小鼠肺泡结构完整性破坏,肺泡内炎性细胞和红细胞浸润,肺泡内充盈富含蛋白的液体,伴肺泡间隔增厚和肺泡限闭。G1预处理可减轻LPS诱导的雄性组(P<0.0001)和OVX组小鼠(P=0.0001)肺泡病理损伤,降低肺损伤评分,但对Sham组无影响(P=0.9983)。见图2。
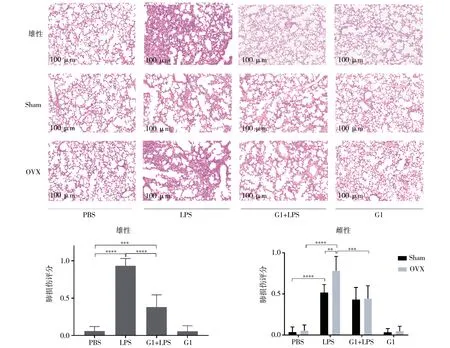
注:LPS为脂多糖;G1为GPER特异性激动剂;OVX为双侧卵巢切除组;Sham为假手术雌性组;**P<0.01;***P<0.001;****P<0.0001
2.3G1对雌雄小鼠肺部炎症细胞浸润的影响 LPS刺激后小鼠BALF中炎症细胞数目明显增多,且增大多为中性粒细胞;OVX组炎症细胞浸润数量多于假手术组。与单纯LPS组相比,G1处理可减轻雄性和OVX组小鼠BALF中中性粒细胞数目(均P<0.0001),但对Sham组无影响(P=0.9993)。见图3。

注:黑箭头为肺泡巨噬细胞;红箭头为中性粒细胞;LPS为脂多糖;G1为GPER特异性激动剂;OVX为双侧卵巢切除组;Sham为假手术雌性组;BALF为肺泡灌洗液;*P<0.05;**P<0.01;***P<0.001;****P<0.0001
2.4G1对雌雄小鼠BALF中TNF-α和IL-6的影响 与PBS组相比,LPS组雌雄小鼠BALF中TNF-α(均P<0.0001)和IL-6(雄性和OVX组均P<0.0001,假手术组P=0.0012)均明显升高,且OVX组TNF-α(P=0.0264)和IL-6(P=0.0015)高于假手术组。G1处理可减轻雄性和OVX雌性小鼠BALF中TNF-α(雄性:P<0.0001,OVX:P<0.01)和IL-6(雄性:P<0.001,OVX:P<0.01),但对Sham组无影响(均P>0.9999)。见图4。
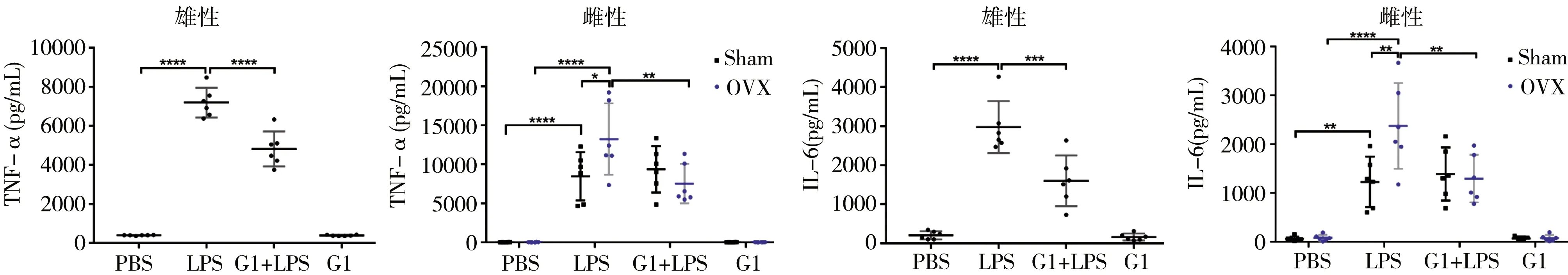
注:LPS为脂多糖;G1为GPER特异性激动剂;OVX为双侧卵巢切除组;Sham为假手术雌性组;BALF为肺泡灌洗液;TNF-α为肿瘤坏死因子-α;IL-6为白细胞介素-6;*P<0.05;**P<0.01;***P<0.001;****P<0.0001
2.5G1对雌雄小鼠BALF中总蛋白和白蛋白的影响 LPS刺激可以引起雄性和雌性小鼠BALF中总蛋白含量的升高(均P<0.001),且OVX组小鼠BALF中总蛋白含量高于Sham组小鼠(P=0.0403)。给予G1可以抑制LPS引起的雄性(P<0.0001)和OVX雌性(P=0.0151)小鼠BALF总蛋白的升高,但对Sham组小鼠则无影响。LPS可以引起雄性和OVX小鼠BALF中白蛋白含量的升高(均P<0.0001),Sham组小鼠BALF白蛋白虽有升高的趋势,但差异无统计学意义(P=0.0832),OVX组白蛋白含量也有高于Sham组小鼠的趋势(P=0.2817)。给予G1可以抑制LPS引起的雄性小鼠BALF白蛋白的升高(P<0.0001),也有抑制OVX组白蛋白升高的趋势(P=0.0548),但对Sham组小鼠则无影响(P>0.9999)。见图5。
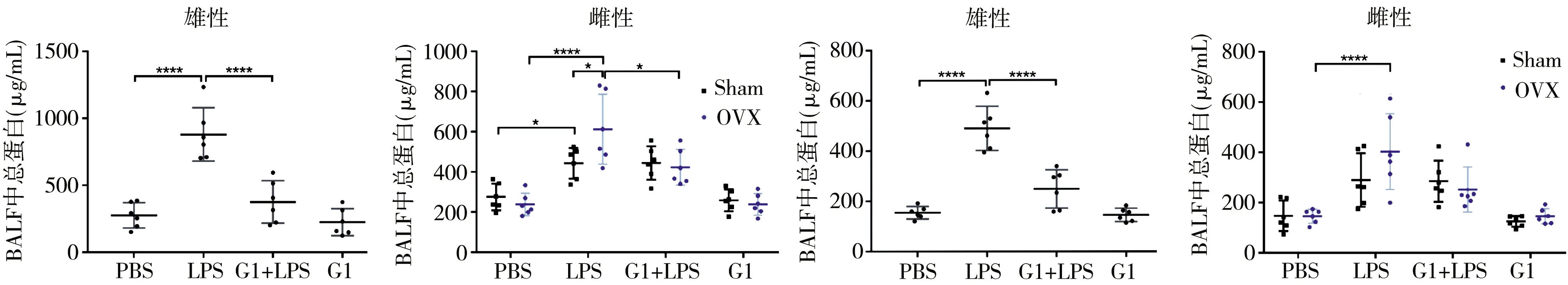
注:BALF为肺泡灌洗液;LPS为脂多糖;G1为GPER特异性激动剂;OVX为双侧卵巢切除组;Sham为假手术雌性组;****P<0.0001
3 讨论
本研究中通过气管内滴注LPS方法成功建立了小鼠ARDS模型,在此基础上探究激活GPER对雌雄小鼠肺部急性炎症反应的影响。研究结果表明,GPER特异性激动剂G1预处理可显著改善LPS诱导的雄性和OVX小鼠肺病理损伤和肺泡-毛细血管屏障破坏,抑制肺部中性粒细胞的募集以及BALF中促炎因子TNF-α和IL-6水平的升高;假手术雌性小鼠激活GPER却无类似的肺保护作用。本实验结果为雌激素的肺保护作用提供了一定的实验依据,尽管不能完全模拟临床情况,但为研究ARDS的性别偏移提供一个方向。
目前认为,过度激活的炎症是ARDS的病理特征[8],雌激素具有调节肺部炎症的作用。Card等[9]之前的一项研究发现,气管内滴注LPS后,雄性和OVX雌性小鼠BALF中炎症介质(IL-1β和IL-6)水平明显高于假手术小鼠,使用雌激素(17β-雌二醇)处理后OVX小鼠炎症介质降至正常雌性小鼠水平,提示17β-雌二醇可减轻OVX小鼠肺部炎症。本研究中雄性和OVX雌性小鼠肺部炎症细胞数目和BALF中IL-6和TNF-α均高于假手术小鼠,也间接证明了雌激素减轻肺损伤的作用。Vegeto等[4]也证实,雌激素可抑制雌雄小鼠的肺内促炎介质的分泌,此外ER-α或ER-β基因敲除小鼠的应用揭示了ER-α而非ER-β在介导雌激素抗炎作用中的关键作用。本研究发现,激活GPER可抑制LPS诱导的雄性和OVX小鼠肺部炎症细胞浸润,并降低BALF中IL-6和TNF-α水平。然而,在正常的雌性小鼠中未检测到类似的抗炎作用。一项创伤性脑损伤的研究[10]同样证明了G1的这一性别特异性,G1处理显著抑制了雄性和OVX雌性小鼠创伤性脑损伤后体内炎症介质IL-1β、IL-6、TNF-α的产生,但在假手术雌性小鼠体内却诱导促炎介质的生成。以上结果提示,G1可以发挥类似雌激素的抑制肺部炎症的作用,但G1的抑炎作用也受体内雌激素水平的影响,G1仅在雌激素水平较低的情况下才显现出抑炎效果。同时,本研究也发现G1可减轻LPS诱导的肺泡毛细血管屏障损伤。
正常情况下,由于肺泡毛细血管屏障通透性较低,血液中的蛋白无法透过此屏障进入肺泡中,故BALF中蛋白含量较低,其中大分子蛋白(例如白蛋白)含量更低;在ARDS病理状态下,肺泡毛细血管屏障受损,通透性增高,血液中的蛋白透过肺泡屏障进入肺泡,导致BALF中蛋白含量升高[11]。研究[9]表明,ARDS小鼠肺泡毛细血管屏障的受损也存在性别差异。LPS刺激后雄性和OVX雌性小鼠BALF中的白蛋白含量升高程度高于正常雌性小鼠,本研究结果与之一致。而给予OVX小鼠雌激素则可逆转漏入肺泡内的白蛋白至完整雌性小鼠水平[9],提示雌激素可以改善体内雌激素水平较低的雌性小鼠肺泡毛细血管屏障。雌激素干预对雄性动物肺泡毛细血管屏障也有保护作用。Hamidi等[12]研究表明,将雌激素注入肺循环可显著减轻百草枯和谷氨酸激动剂N-甲基-d-天冬氨酸引起的雄性大鼠肺部白蛋白渗漏。几乎没有研究探索何种受体介导了雌激素改善肺泡毛细血管屏障的作用,本研究发现GPER激动剂G1可减轻LPS诱导的肺泡毛细血管屏障损伤,并且G1提前干预只能减轻雄性和OVX雌性小鼠BALF中总蛋白的升高,但对完整雌性小鼠则无影响。另外,G1干预也可以抑制LPS引起的雄性小鼠BALF中白蛋白含量的升高,也具有减轻OVX雌性小鼠白蛋白含量的趋势,推测之所以在OVX组内差异不具有统计学意义,可能是因为数据量过少以及组内数据过于分散,若加大数据量则可能差异会具有统计学意义。
综上所述,GPER激动剂干预可减轻雄性和OVX雌性小鼠ARDS的严重程度,但对假手术雌性小鼠ARDS无改善作用。这提示激活GPER可以发挥类似雌激素的肺保护作用,并且这一保护作用受体内雌激素水平影响,仅在雌激素水平较低时GPER激活具有肺保护作用,但激活GPER减轻ARDS的作用机制仍有待进一步探索。

