脓毒症患者继发急性肺损伤的危险因素及早期预测价值
李京宴, 田英平, 高恒波, 姚冬奇, 苏建玲, 郑拓康, 孟 娜
脓毒症是由细菌感染引起的严重全身炎症反应综合征,其本质是形成难以控制的炎症反应和免疫抑制的恶性循环,病死率达27%[1-2],是重症监护病房死亡的主要原因[3-4]。其中急性肺损伤(acute lung injury,ALI)为脓毒症常见且严重的并发症之一,脓毒症导致ALI发病率达25%~45%,病死率高达50%~60%[5],严重影响患者的预后。因此,在积极治疗脓毒症的同时,对脓毒症继发ALI的早期识别及干预是改善脓毒症患者预后的关键因素。近年研究显示, 中性粒细胞/淋巴细胞比值(NLR)是有效的全身炎症反应标志物,且对多种感染性疾病的预后起主要作用。氧合指数(PaO2/FiO2)是评估肺功能的传统指标,肿瘤坏死因子-α(TNF-α)在反映炎症轻重程度方面具有高灵敏性,目前关于上述指标在预测脓毒症继发ALI方面的文献报道较少。本研究旨在探讨NLR、PaO2/FiO2及TNF-α在脓毒症继发ALI的早期诊断效能及潜在的预测价值,为临床上治疗脓毒症提供一定参考。
1 资料与方法
1.1一般资料 回顾性分析河北医科大学第二医院急诊科于2020年6月至2022年1月收治的135例脓毒症患者为研究对象。依据是否继发ALI将其分为脓毒症组(94例)和ALI组(41例)。本回顾性研究符合《赫尔辛基宣言》的基本原则,并依据河北医科大学第二医院伦理委员会政策,临床资料在不泄露患者身份的前提下进行分析及使用。伦理编号:2022-R290。
1.2研究分组 纳入标准:①年龄>18周岁;②脓毒症纳入标准符合2016年修订的《脓毒症和脓毒症休克定义的第三次国际共识(Sepsis 3.0)》[6];③ALI符合2012年制定的急性肺损伤/急性呼吸窘迫综合征(ALI/ARDS)柏林诊断标准[7];④临床资料完善。排除标准:①合并血液疾病晚期者;②合并肿瘤疾病晚期者;③合并免疫性疾病者;④长期服用免疫抑制剂、激素等药物者;⑤入院24 h死亡或放弃治疗者;⑥临床资料不完善者。
1.3研究方法 纳入研究的患者于入院确诊时采集外周静脉血行血常规、CRP、PCT检测。血常规检测由SysmesXN-1000及其配套试剂完成;应用酶联免疫吸附法(ELISA)测定血清CRP、PCT和TNF-α 水平(ELISA试剂盒购于上海信然生物技术公司)。
1.4观察指标 ①记录脓毒症患者入院时的性别、年龄、体重指数(BMI)、体温、心率、收缩压(SBP)、合并症、PaO2/FiO2、APACHEⅡ评分及SOFA评分等资料;②依据2016年修订的《脓毒症和脓毒症休克定义的第三次国际共识(Sepsis 3.0)》制定的脓毒症诊断标准以及2012年制定的ALI/ARDS柏林诊断标准将其分为脓毒症组和ALI组。
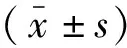
2 结果
2.1一般资料 两组在性别、年龄、BMI、体温、心率、SBP、原发感染部位、合并基础疾病方面水平相近(P>0.05);ALI组PCT、NLR、TNF-α、APACHEⅡ评分及SOFA评分高于脓毒症组,PaO2/FiO2低于脓毒症组,差异有统计学意义(P<0.05)。见表1。
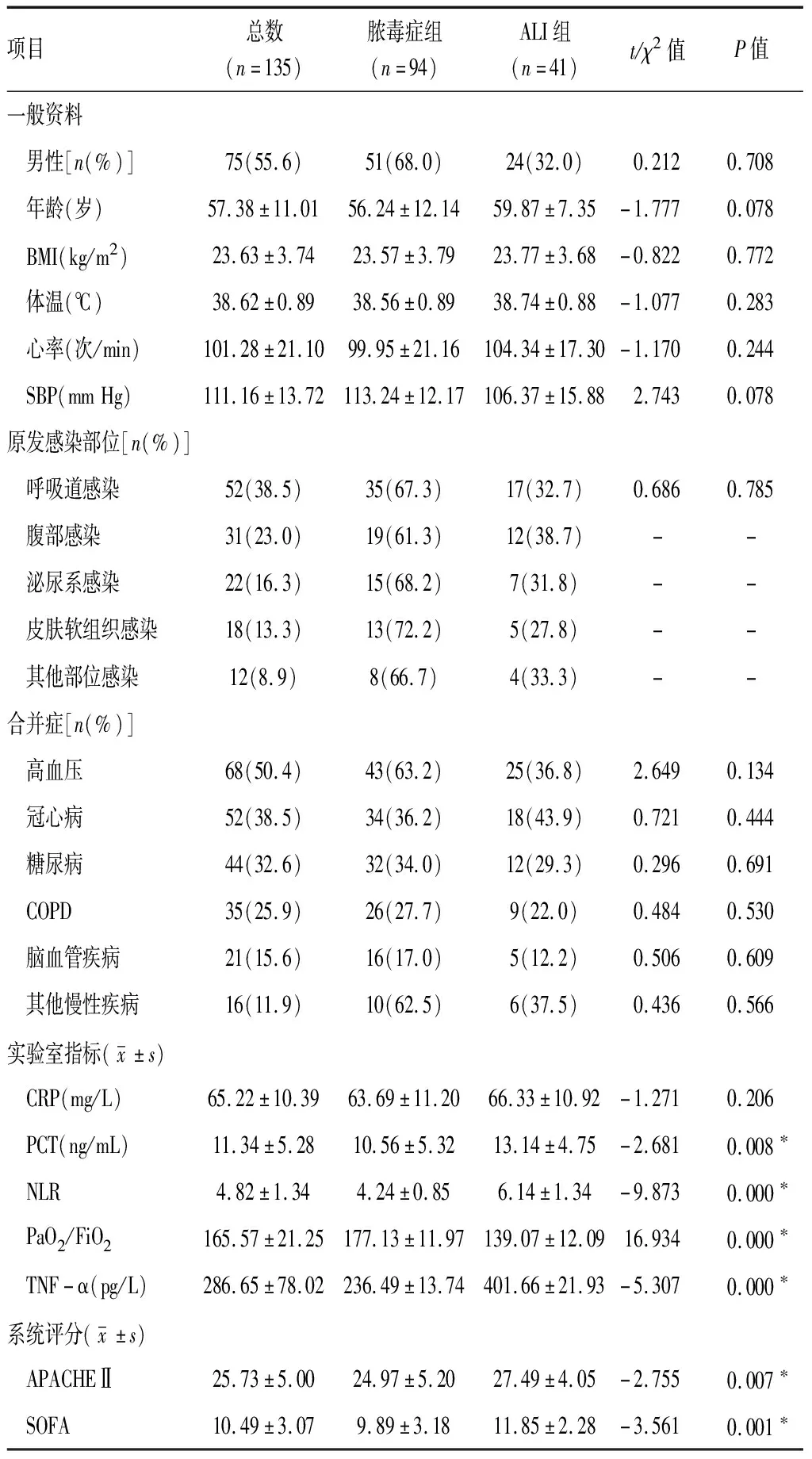
表1 纳入者一般资料和系统评分比较
2.2脓毒症患者继发ALI独立危险因素及模型构建 以是否继发ALI为因变量,将具有统计学差异的指标PCT、NLR、PaO2/FiO2、TNF-α、APACHEⅡ评分及SOFA评分为自变量进行多因素Logistic回归分析,结果显示,NLR、PaO2/FiO2、TNF-α是脓毒症患者继发ALI的独立危险因素(P<0.05),见表2。以独立危险因素NLR、PaO2/FiO2、TNF-α为基础,应用Logistic回归分析构建联合预测模型如下:logit(p)=1.350×NLR+0.002×PaO2/FiO2+0.036×TNF-α(pg/L)-17.600。
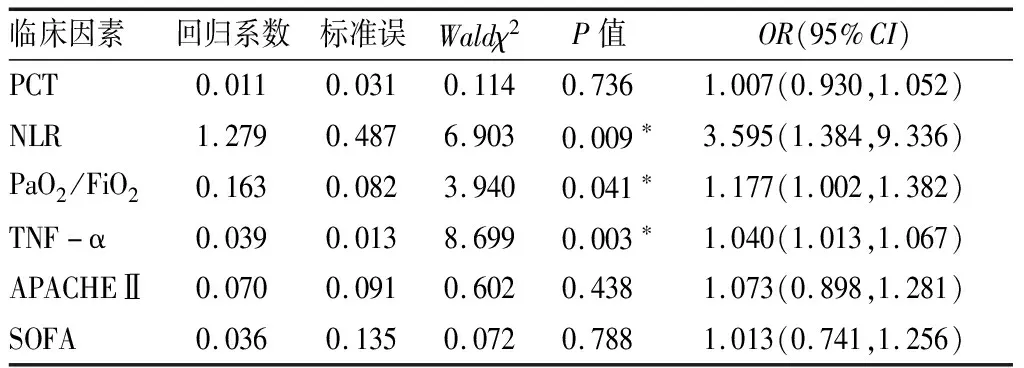
表2 脓毒症患者继发ALI的多因素Logistic回归分析
2.3独立危险因素与联合预测模型对脓毒症患者继发ALI的预测价值 NLR、PaO2/FiO2、TNF-α与三项联合预测模型预测脓毒症患者继发ALI的AUC分别为0.755、0.811、0.821、0.872,95%CI分别为0.720~0.829、0.753~0.868、0.769~0.873、0.832~0.913,最佳阈值分别为5.542、152.351、354.334、0.469,最佳阈值下的敏感度分别为89.90%、72.30%、71.40%、73.60%,最佳阈值下的特异度分别为56.10%、85.60%、88.40%、89.00%。见表3、图1。
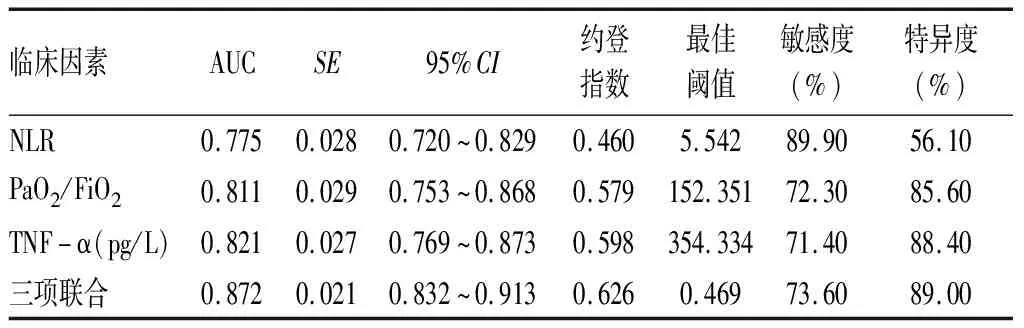
表3 独立危险因素与联合预测模型对脓毒症患者继发ALI的预测价值
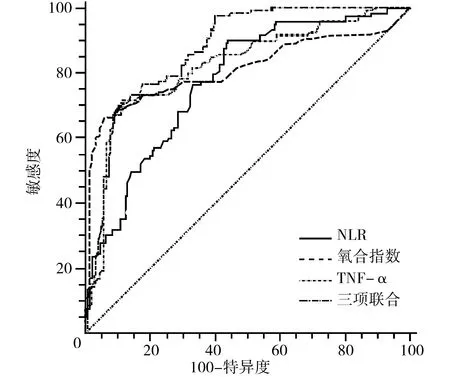
注:NLR为中性粒细胞/淋巴细胞比值;PaO2/FiO2为氧合指数;TNF-α为肿瘤坏死因子-α
3 讨论
脓毒症是重症监护病房最常见的急危重症疾病,迅速变化的病情可快速引发机体发生一系列严重的炎症反应,出现多器官功能障碍进而危及患者生命,其中ALI较其他脏器损伤更为常见且对脓毒症患者的预后造成极大威胁,故对是否出现ALI的评估显得十分关键,评价各项生物学指标在预测脓毒症继发ALI风险方面的敏感度和特异度将为脓毒症诊治提供潜在的临床价值。本研究通过回顾性分析发现,脓毒症组和ALI组在性别、年龄、BMI、体温、心率、SBP、原发感染部位及合并症等一般资料比较差异无明显统计学意义,提示这些临床指标缺乏早期识别脓毒症继发ALI风险的特异性。ALI组CRP高于脓毒症组,但差异无统计学意义,这也说明作为非特异性炎性指标的CRP对严重脓毒症后是否继发ALI无评估价值。过度炎症状态下的炎症细胞可分泌大量PCT,其水平可在一定程度上反映炎症的轻重程度[8]。本研究发现,ALI组PCT水平高于脓毒症组,提示继发ALI患者病情较重,这也与本研究中观察到的APACHEⅡ和SOFA评分在ALI组高于脓毒症组的结果相一致。然而通过Logistic回归分析显示,PCT、APACHEⅡ和SOFA评分并不是继发ALI的独立危险因素,上述指标在预测及判定脓毒症患者是否继发ALI方面无确切意义。
肺脏是炎症因子最容易累及的器官之一,脓毒症时全身炎症反应可损伤肺泡,引起肺泡内水肿、渗出,肺毛细血管扩张、充血以及炎症细胞浸润并最终导致患者氧合能力下降,随着病情的进展可导致ALI。曾有研究[9-10]发现,PaO2/FiO2的高低和肺部疾病的严重程度呈负相关,即肺脏损伤越重PaO2/FiO2就越低,反之亦然。本研究发现,ALI组PaO2/FiO2低于脓毒症组,差异有统计学意义,这和以往的研究[9-10]结果一致,通过Logistic回归分析发现,PaO2/FiO2作为独立危险因素对脓毒症患者继发ALI的诊断具有一定意义。进一步ROC曲线分析显示,PaO2/FiO2的最佳截断值为152.351,提示脓毒症患者PaO2/FiO2低于最佳截断值时需警惕继发ALI的可能。
中性粒细胞是人体重要的免疫细胞之一,当机体处于感染状态下血细胞成分通常会发生一系列的变化,免疫细胞往往迅速趋化聚集到感染部位,发挥宿主防御和免疫调节的作用。当中性粒细胞显著减少时,机体免疫力受到损害,因此感染风险显著增加。淋巴细胞是人类免疫反应的主要效应细胞,体内淋巴细胞的数量与机体对病原微生物的免疫防御系统密切相关,并与炎症程度呈负相关。NLR包括两种白细胞亚型,反映了机体中性粒细胞和淋巴细胞计数水平的平衡和全身炎症的程度。更准确地说,它反映了炎症的严重程度和机体免疫状态之间的平衡,因此被认为是一个重要的标志。Lee等[11]研究显示,NLR与慢性阻塞性肺疾病、急性呼吸系统等肺部疾病的预后存在相关性,ALI期间NLR的改变与全身炎症反应过程密切相关。进一步研究证实,NLR与气流限制的严重程度相关,中性粒细胞是ALI肺功能持续下降的关键调节因子,炎症期间中性粒细胞被激活,活化的中性粒细胞分泌蛋白水解酶和基质金属蛋白酶,导致肺泡发生病理学改变,加重ALI的病理过程,此外肺功能降低患者常伴有外周淋巴细胞减少,因此NLR可能与ALI期间气道气流受限相关[12]。de Jager等[13]研究发现,NLR在肺炎诊断及预后的评估中具有重要的预测价值,其预测效能优于其他血液指标。曾有报道通过前瞻性研究发现,NLR是评估感染性心内膜炎患者住院死亡的独立危险因素,预测价值高于其他指标,同时还发现NLR随时间的推移具有一定的差异,在感染的早期NLR偏低,随着疾病的进展NLR水平逐渐升高,这种随时间的变化和疾病的预后相关[14-15]。本研究发现,ALI组NLR水平高于脓毒症组,通过Logistic回归分析发现,NLR作为独立危险因素对脓毒症继发ALI的诊断具有一定意义。进一步ROC曲线分析显示,NLR的曲线下面积为0.775,最佳阈值为5.892,为临床上脓毒症病情进展的预测提供一定的参考。
脓毒症本质上是一种失调的炎症和免疫反应[16-17],中性粒细胞和淋巴细胞在免疫调节和炎症过程中可通过进一步诱导炎症介质的释放而加速炎症和免疫反应的失调进而促使病情的加重。TNF-α是一种典型的炎症介质,在脓毒症炎症进展过程中发挥主要的作用,通过辅助白细胞穿过内皮细胞壁加速白细胞到达炎症部位从而促进炎症的进程。除此之外还可增加中性粒细胞在肺组织以及肺泡中的浸润程度进而导致患者出现ALI的临床症状[18]。而ALI病理生理过程受模式识别受体(pattern recognition receptors, PRRs)调控,作为先天免疫系统关键组成部分的第一道防线,PRRs可识别两种类型的配体即非内源性病原体相关分子模式(pathogen-associated molecular patterns, PAMPs)和内源性损伤相关分子模式(endogenous danger-associated molecular patterns, DAMPs),识别受体可启动炎症信号级联和炎症介质TNF-α的释放,并刺激肺泡上皮细胞凋亡,诱导产生抗炎分子Toll样受体(Toll-like receptor, TLR)。研究证实,TLR信号通路参与ALI的病理生理过程,ALI期间肺组织受损伤后产生细胞外基质氨基葡萄糖聚糖即透明质酸的降解产物,并与TLR4和TLR2相互作用,诱导炎症反应,加重ALI期间的肺损伤,此外肺上皮细胞中高分子量透明质酸的过表达可导致线粒体DAMPs产物蓄积,并通过诱导产生中性粒细胞黏附剂和激活剂的方式激活中性粒细胞,从而参与ALI的病理过程[19-20]。Kothari 等[21]的研究还发现,随着脓毒症患者病情的逐渐加重以及ALI程度的不断进展,患者体内TNF-α水平逐渐升高。本研究显示,ALI组TNF-α水平高于脓毒症组,且差异具有统计学意义,TNF-α作为脓毒症继发ALI的独立危险因素,其预测脓毒症继发ALI的AUC为0.821(95%CI0.769~0.873),最佳截断值为354.334 pg/L,与继发ALI呈正相关。
总之,NLR、PaO2/FiO2和TNF-α是脓毒症患者继发ALI的独立危险因素,联合指标对预测ALI的发生具有较高的敏感度和特异度,提示临床上针对脓毒症患者,在早期进行病情评估时不要依赖单一指标,将多项指标联合检测会具有更加积极的意义。
本研究为单中心回顾性研究,纳入的研究对象数量有限,还需通过大量的前瞻性研究进一步验证。但本研究主要针对患者入院时的各项指标变化对脓毒症后期是否继发ALI进行判断,患者入院时已经确诊脓毒症,于进行干预治疗前收集上述数据,并依据后期是否继发ALI对上述数据进行分析比较,从而得到脓毒症患者继发ALI的独立危险因素以及独立危险因素的阈值,这在一定程度上弥补了上述不足,增加了研究的可信度。

