肝癌细胞SMMC-7721中CXCL3表达与氧化应激的相关性研究
毛麟宇,鹿士振,王伟群,张春斌,张丽娜
(1.佳木斯大学附属第一医院检验科,黑龙江 佳木斯154003;2.佳木斯大学基础医学院生物学教研室,黑龙江 佳木斯154007;3.佳木斯大学基础医学院生理学教研室,黑龙江 佳木斯154007;4.漳州卫生职业学院医学技术系、转化医学检测应用技术协同创新中心,福建 漳州 363000;5.大庆油田总医院检验科,黑龙江 大庆 163000)
肝癌是我国常见的恶性肿瘤之一,具体发病分子机制尚有待研究。相关研究称感染性疾病和慢性炎症约占致癌因素的25%。慢性炎症时炎症细胞和上皮细胞均可产生反应性氧(reactive oxygen species,ROS)或反应性氮(reactive nitrogen species,RNS),引起DNA的损伤、突变,进而可能引发恶性肿瘤的发生。而乙肝、丙肝导致的慢性肝炎的长期不愈,反复发作,将导致肝脏的病变:肝纤维化及肝硬化,并最终发展为肝癌。趋化因子3(C-X-C motif chemokine ligand 3,CXCL3)作为炎性细胞因子的一种,在肝细胞癌中保持较高的表达水平,正符合恶性肿瘤发生发展的炎性微环境理论。
长期炎症状态下,氧化应激失衡,ROS对核酸、蛋白、脂质等的氧化作用促进了恶性肿瘤的发生,损伤的DNA进入细胞质后,又会诱导干扰素介导的先天免疫反应,从而促进ROS的产生,保持着肿瘤的炎症环境。适量的ROS在恶性肿瘤的进程中激活了对细胞有利的信号,可以促进细胞的增殖,存活和抗氧化应激能力。而过高的ROS会导致肿瘤细胞的持续突变和基因组不稳定性。癌症的发展中也需要依赖于内源性抗氧化剂来减轻氧化应激,使其保持在一定的水平。
有相关研究发现CXCL3在肝细胞癌中表达高于癌旁组织且跟肿瘤的炎症环境相关[1-2],但关于肝癌中CXCL3和氧化应激之间的关系尚未有人研究。本课题的目的在于研究CXCL3表达水平发生改变后,细胞氧化应激水平变化情况,验证在肝癌细胞中CXCL3与氧化应激水平的相关性。
1 材料与方法
1.1 实验材料肝癌细胞系来源于美国模式培养物集存库;CXCL3病毒转染试剂购自广州易锦生物技术有限公司;BeyoRTTMⅡ cDNA第一链合成试剂盒、RIPA裂解液(强)购自中国碧云天生物技术有限公司;总RNA提取试剂购自生工生物工程(上海)股份有限公司;荧光定量试剂购自罗氏诊断产品(上海)有限公司公司;血红素加氧酶1(heme oxygenase-1,HO-1)抗体、总超氧化物歧化酶(superoxide dismutase,SOD)测试盒(羟胺法)、丙二醛(malondialdehyde,MDA)测定试剂盒(硫代巴比妥酸法)购自万类生物有限公司;辣根过氧化物酶标记二抗购自北京中杉金桥生物技术有限公司。
1.2 细胞转染对数生长期的SMMC-7721细胞按5×104个/mL的浓度铺入24孔板中;将载有CXCL3高表达和CXCL3敲除及各自对照的带有嘌呤霉素抗性及相应荧光蛋白质粒的慢病毒颗粒与完全培养基按11混合;按转染试剂操作说明转染到SMMC-7721细胞中(依次命名为:vector-CXCL3和sh-CXCL3);培养12~16 h后,加入嘌呤霉素(终浓度为2 μg/mL)进行筛选;纯度达到90%以上后,进行后续实验。
1.3 细胞增殖细胞按1.5×103个/孔接种于96孔培养板中;细胞在37 ℃培养24 h、48 h和72 h后,分别向设定孔中加入10 μL CCK-8试剂;37 ℃培养箱中孵育1 h后用酶标仪读取各孔450 nm处的吸光度值。
1.4 Western Blotting法将30 μg的细胞总蛋白经质量分数12%SDS聚丙烯酰胺凝胶电泳处理后,转移至聚偏氟乙烯膜;质量分数5%脱脂乳封闭后,用兔抗HO-1多克隆抗体(11 000稀释)在4 ℃孵育过夜;TBST洗涤3次×5 min;辣根过氧化物酶偶联的山羊抗兔二抗(15 000稀释)在37 ℃孵育1 h;TBST洗涤4次×10 min;ECL试剂孵育膜,使信号可视化;用全自动化学发光图像系统进行曝光、拍照,并对图像进行量化和分析。
1.5 氧化应激处理将等量细胞铺到6孔板的4个孔,待细胞长满80%时按最终为0、100、200、400 μmol/L的浓度梯度将过氧化氢加入6孔板,正常培养24 h,提取4个孔的总RNA,反转录,荧光定量检测各自的CXCL3的表达量。
1.6 SOD、MDA测定SOD、MDA的测定采用酶联免疫吸附试验,具体操作按照说明书进行。

2 结果
2.1 CXCL3的表达情况本研究通过对TCGA数据库的生物信息学分析发现,CXCL3在肝癌组织的转录水平与正常组织比较差异无统计学意义(t=0.864,P=0.075)。CXCL3高表达患者与CXCL3低表达患者相比,总生存率低(P=0.001)。见图1、2。
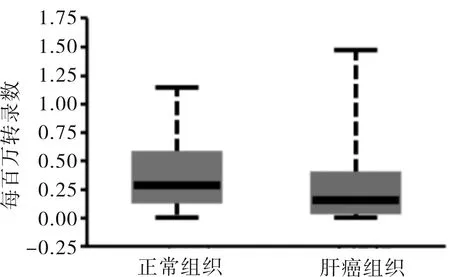
图1 TCGA数据库中CXCL3在不同肝脏组织中表达的比较
2.2 CXCL3与氧化应激的关联分析
2.2.1 过氧化氢处理后CXCL3的表达 过氧化氢浓度为100 μmol/L时,CXCL3的表达与对照组差异无统计学意义(t=0.716,P=0.494)。当浓度达到200 μmol/L时,CXCL3的表达下降(t=3.275,P=0.004)。当浓度达到400 μmol/L时,CXCL3的表达水平下降更加明显(t=5.162,P<0.001)。见图3。
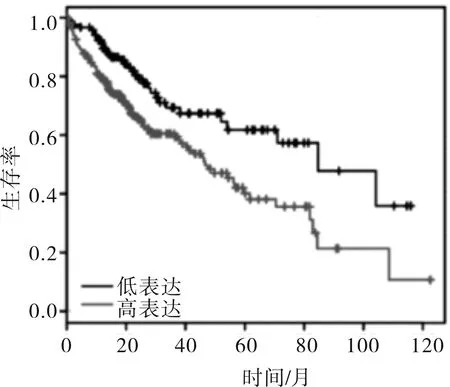
图2 CXCL3表达对肝癌患者生存率的影响

图3 过氧化氢处理后肝癌细胞中CXCL3表达情况分析
2.2.2 CXCL3与氧化应激基因的关联分析 生物信息学分析结果所示,肝癌组织中有7个与CXCL3表达相关的氧化应激基因。包括1个负相关基因PTGS2(COX2);6个正相关基因,分别为CYBB、SOD3、NCF1、NCF2、UCP2和HMOX1。见图4。

图4 与CXCL3表达相关的氧化应激基因及其相关系数
2.3 荧光定量PCR验证转染效果为了验证CXCL3表达对肝癌细胞氧化应激状态的影响,本研究设计了高表达CXCL3细胞和低表达CXCL3细胞。稳定转染CXCL3的SMMC-7721细胞中CXCL3的表达接近其对照的2倍(t=3.432,P=0.034);RNAi干扰SMMC-7721细胞的CXCL3表达是对照组的20%左右(t=9.957,P=0.014)。见图5。

图5 转染后SMMC-7721细胞中CXCL3表达情况
2.4 CCK-8增殖情况SMMC-7721细胞中,稳定高表达CXCL3的细胞增殖能力强于对照(t=4.180,P<0.001);低表达CXCL3的细胞增殖能力低于对照组(t=60.201,P<0.001)。见图6。
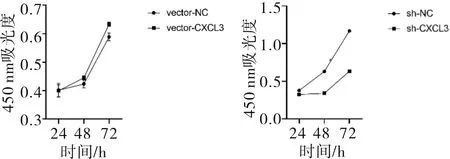
图6 CXCL3表达对SMMC-7721细胞增殖的影响
2.5 SOD测定结果SMMC-7721细胞中,高表达CXCL3的细胞SOD水平高于对照组(t=253.301,P<0.001);低表达CXCL3的细胞SOD水平低于对照组(t=253.782,P<0.001)。见图7。
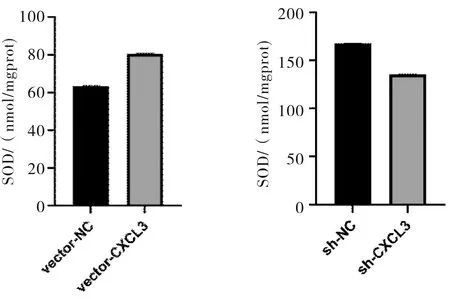
图7 CXCL3表达对SMMC-7721细胞中SOD水平的影响
2.6 MDA测定结果SMMC-7721细胞中,高表达CXCL3的细胞MDA含量高于对照组(t=19.485,P<0.001);低表达CXCL3的细胞MDA含量低于对照组(t=11.265,P<0.001)。见图8。

图8 CXCL3表达对SMMC-7721细胞MDA水平的影响
2.7 HO-1表达情况SMMC-7721细胞中,高表达CXCL3的细胞HO-1相对表达量高于对照组(t=5.592,P<0.001);低表达CXCL3的细胞HO-1相对表达量低于对照(t=13.064,P<0.001)。见图9、10。
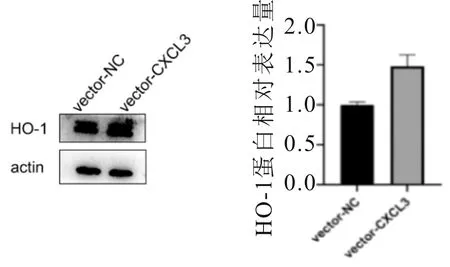
图9 高表达CXCL3 SMMC-7721细胞中HO-1表达情况

图10 低表达CXCL3 SMMC-7721细胞中HO-1表达情况
3 讨论
3.1 CXCL3的表达水平影响肝癌的恶性表型CXCL3是一种生长因子蛋白,与CXCR2结合,并作为中性粒细胞的趋化剂。作为一种重要的趋化因子,CXCL3在多种肿瘤中有一定的表达。在宫颈癌中,肿瘤组织高表达CXCL3[3-4];CXCL3通过调节细胞外调节蛋白激酶通路相关基因的表达促进宫颈癌细胞增殖和迁移、抑制其凋亡[5]。
在研究头颈部癌时发现,CXCL3在口腔鳞癌组织中的表达高于正常组织,与肿瘤分期及淋巴结转移密切相关;CXCL3的高表达促进了裸鼠移植瘤的生长;细胞外调节蛋白激酶阻断剂PD98059可减弱CXCL3诱导的增殖和迁移效应[6]。CXCL3在头颈部鳞癌中的表达高于正常患者,CXCL3高表达患者组总生存率较低,其表达水平会影响凋亡、Toll样受体、Nod样等多种信号通路基因[7]。
Han等[2]建立的裸鼠模型中,与相邻正常组织相比,肝癌组织中CXCL3的mRNA和蛋白表达上调。同样,Zhang等[8]报道CXCL3的高表达表明预后不良,通过细胞外调节蛋白激酶的磷酸化增强了肝癌干细胞的维持和肿瘤发生。
本研究通过对TCGA数据库的生物信息学分析发现CXCL3在肝癌组织的转录水平高于正常组织。高表达CXCL3的患者比低表达CXCL3患者总生存率低。这与Wang等[9]的数据分析结果一致,说明CXCL3的表达水平也会影响肝癌的发病进程。
3.2 CXCL3与氧化应激基因的关联分析有研究[10]表明,氧化应激的失衡可以加速细胞恶性衍变过程,并且影响肿瘤预后的效果。但是,迄今为止,仍不清楚肿瘤细胞中氧化应激分子调控及其作用机制的完整网络,影响肝癌细胞中的氧化应激失衡的关键分子也不清楚。
我们先利用过氧化氢诱导肝癌细胞SMMC-7721,使其处于氧化应激状态,来检测CXCL3的表达情况。结果显示,过氧化氢浓度达到200、400 μmol/L时,CXCL3的表达水平下降,并且随着过氧化氢浓度增加,下降幅度逐渐增大。此结果可以说明,CXCL3的表达与肝癌细胞的氧化应激状态密切相关。
为了探讨肝癌细胞中的氧化应激相关基因表达情况,本研究利用cBioPortal数据库,分析了肝癌细胞中与CXCL3基因共表达的氧化应激基因,利用DAVID数据库(https://david-d.ncifcrf.gov/,6.7版本)对其进行了功能富集分析。结果显示,当P<0.001时,在与CXCL3基因相关的基因功能注释中,获得了7个与氧化应激和肿瘤发生相关的基因,包括1个负相关基因:PTGS2(COX2);6个正相关基因:CYBB、SOD3、NCF1、NCF2、UCP2和HMOX1。
值得关注的是,与CXCL3负相关基因COX2,在大多数正常组织都未能找到。最近,其已被证明可在多种恶性肿瘤患者体内检出,显示在肿瘤病患中起重要作用[11-13]。这是一个诱导酶,功能是激活巨噬细胞或其他细胞,充斥于炎症组织[14]。这与我们前期研究CXCL3影响炎症、肿瘤的进程结果吻合。
3.3 CXCL3表达对肝癌细胞氧化应激状态的影响为了验证CXCL3表达水平对肝癌细胞氧化应激状态的影响,我们设计了高表达CXCL3细胞株和低表达CXCL3细胞。
3.3.1 CXCL3表达对细胞增殖的影响 本研究中,高表达CXCL3的SMMC-7721细胞增殖能力强于对照组;低表达CXCL3的细胞增殖能力低于对照组。由此可以说明,CXCL3的表达水平与SMMC-7721细胞增殖密切相关,而氧化应激水平的改变很可能就是由增殖能力的变化引起的。
3.3.2 CXCL3表达对SOD的影响 SOD是机体内天然存在的超氧自由基清除因子,是一种能够催化超氧化物通过歧化反应转化为氧气和过氧化氢的酶,而体内的其他酶会立即将过氧化氢分解为完全无害的水。因此,SOD能专一清除体内有害的自由基,以解除自由基氧化体内的某些组成成分而造成的机体损害。
本研究中,高表达CXCL3的SMMC-7721细胞SOD高于对照组;低表达CXCL3的细胞SOD低于对照组。这也与生物信息学预测中CXCL3与SOD基因呈正相关结果一致。
SOD在机体的氧化与抗氧化平衡中起到至关重要的作用。高表达CXCL3能引起SOD增加,这说明在一定范围内增加CXCL3可以增强细胞的抗氧化能力,保护细胞免受氧化应激损伤。这与Wang等[15]发现人参皂苷抗氧化机制相类似。
3.3.3 CXCL3表达对MDA的影响 MDA是细胞膜脂过氧化作用的产物之一,其产生还能加剧膜的损伤。因此,MDA的多少能够代表膜脂过氧化的程度。
本研究结果显示,在SMMC-7721细胞中,高表达CXCL3的细胞MDA高于对照组;低表达CXCL3的细胞MDA低于对照组。由此可以说明,CXCL3的表达水平与SMMC-7721细胞氧化应激损伤密切相关。这与Li等[16]从枸杞中提取的枸杞多糖-4a对MDA的作用类似。
在很多研究中,SOD与MDA呈负相关,通常给以氧化应激刺激后,SOD降低而MDA升高。例如,检测急性心肌梗死患者外周血[17]和噪声暴露情况下大鼠耳蜗皮质组织[18]都属于此类情况。但本研究中,高表达CXCL3的肝癌细胞中MDA升高可以说明细胞氧化应激状态处于更高水平,而相对于CXCL3正常表达水平时,细胞长期处于增殖增加的状态,这说明MDA等过氧化状态对细胞损伤影响得以消除,即细胞的抗氧化能力的到了提高,SOD水平的升高正对应这一结论,反之亦然。
3.3.4 CXCL3表达对HO-1的影响 HO在细胞应激反应和体内平衡中起着关键作用。其表达或活性的失调与多种人类疾病的病理生理学有关,包括心血管疾病、糖尿病、肥胖、肺病、胃肠疾病、肾功能障碍、皮炎、癌症等。因此,血红素加氧酶被认为是许多人类疾病的预防、治疗干预中最重要的目标之一[19]。
本研究结果显示,在SMMC-7721细胞中,高表达CXCL3细胞的HO-1表达高于对照组;低表达CXCL3细胞HO-1表达低于对照组。由此可以说明,CXCL3的表达水平与HO-1表达密切相关,这与增加HO-1表达可能导致一些疾病的进展,如神经退行性变、致癌的观点吻合[20]。
当前的恶性肿瘤相关研究已不再局限于进行某一因子的调控机制,而是强调整个的肿瘤微环境的作用。本课题根据恶性肿瘤的炎症环境对恶性肿瘤发生、发展的影响,首次提出了在肝癌细胞中,CXCL3表达与细胞氧化应激水平具有相关性的观点。但由于本课题只涉及了CXCL3与肝癌的相关性,没有进行具体的调控关系及调控网络的研究,且炎症细胞因子仅选用了CXCL3,不能系统地诠释炎症相关因子与氧化应激的关系。这些问题将在课题组今后的研究中逐渐解决。

