肺表面活性物质气管内滴入联合枸橼酸咖啡因治疗早产儿呼吸窘迫综合征疗效研究
赵小燕,张 帆,朱良梅,胡方启,章 乐
1.安庆市立医院 NICU,安徽 安庆 246000;2.无锡市儿童医院 新生儿科,江苏 无锡 214000
新生儿呼吸窘迫综合征又称肺透明膜病,是因患儿肺部发育不全,肺表面活性物质(pulmonary surfactant,PS)缺乏而出现两肺广泛肺泡萎陷损伤渗出的急性呼吸衰竭,多见于早产儿,亦可发生于剖宫产新生儿。胎儿胎龄24~25周开始合成PS,但胎龄35周时PS合成量才迅速增多[1]。PS制剂具有明显改善患儿肺泡表面张力的作用,疗效显著且安全性高,是新生儿呼吸窘迫综合征患儿的急救用药[2-3]。枸橼酸咖啡因是一种甲基黄嘌呤类药物,有兴奋呼吸中枢的作用,具有半衰期长、不良反应少的特点[4]。有研究报道,枸橼酸咖啡因可扩张支气管改善肺功能,抑制肺部炎症减轻炎症肺损伤,促进PS的合成与分泌[5-6]。基于上述药理效用理论,本研究选取63例患有呼吸窘迫综合征的早产儿为研究对象,探讨PS联合应用枸橼酸咖啡因对早产儿呼吸窘迫综合征的疗效。现报道如下。
1 资料与方法
1.1 一般资料 选取自2019年1月至2021年11月安庆市立医院收治的63例发生呼吸窘迫综合征的早产儿为研究对象,将患儿随机分为A组(n=31)与B组(n=32)。纳入标准:胎龄29~33周;出生24 h内发生呼吸窘迫综合征,并采用呼吸机(有创或无创)辅助通气。排除标准:家属放弃治疗或转院治疗患儿;严重发育异常患儿(先天性遗传代谢性疾病、严重先天性心脏病等)。两组患儿性别、出生体质量、分娩方式、胎龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。本研究经我院伦理委员会审批通过,患儿家属均签署知情同意书。
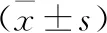
表1 两组患儿基线资料比较
1.2 治疗方法 两组患儿入院后均予以清理呼吸道、暖箱保暖、呼吸循环支持、维持内环境稳定等。A组患儿充分清理呼吸道后经气管内(普通气管插管法或LISA法)滴入PS,仰卧位给药,应用PS后6 h避免吸痰。PS制剂选择猪肺磷脂注射液(意大利Chiesi Farmaceu tici S.p.A,注册证号:H20140848,规格:240 mg/支),参照《新生儿呼吸窘迫综合征的表面活性物质替代治疗指南》用药标准[7],用药剂量为每次200 mg/kg,重症患儿需重复给药,间隔时间根据需要制定。B组患儿在A组治疗基础上给予枸橼酸咖啡因注射液(山西国润制药有限公司,国药准字:H20183092,规格:1 ml∶20 mg)静脉滴注。枸橼酸咖啡因用药剂量参考文献[8]研究结果,首次负荷剂量为20 mg/(kg·d),24 h后给予维持剂量5~10 mg/(kg·d),每日1次,可使用至校正胎龄33~34周。
1.3 观察指标 记录并比较两组患儿支气管肺发育不良(bronchopulmonary dysplasia,BPD)发生率、治疗有效率、呼吸机使用时间、住院时间、氧暴露时间、并发症、PS重复使用率。记录并比较两组患儿治疗前、治疗48 h后动脉血气分析指标[pH值、血氧分压(arterial partial pressure of oxygen,PaO2)、二氧化碳分压(partial pressure of carbon dioxide in artery,PaCO2)、吸入氧浓度(inhaled oxygen concentration,FiO2)、剩余碱(base excess,BE )]及呼气末正压(positive end expiratory pressure,PEEP)。记录并比较两组患儿治疗前、治疗7 d后炎症因子[肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素6(interleukin 6,IL-6)、白细胞介素8(interleukin 8,IL-8)]水平。并发症包括肺出血、脑损伤、心肌损害、消化道出血、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、血糖异常、胆汁淤积、肺动脉高压(pulmonary hypertension,PH)、动脉导管未闭(patent ductus arteriosus,PDA)、败血症等。疗效评估标准[9]:有效、显效为治疗后患儿一般情况好转,肺部病变明显或部分吸收,动脉血气主要指标明显好转,呼吸机参数可下调;无效为治疗后患儿全身状况无好转或恶化,肺部病变及动脉血气指标无改善或恶化,呼吸机参数无改善。
总有效率=(有效+显效)例数/总例数×100%
2 结果
2.1 两组BPD发生率比较 B组患儿BPD发生率为15.6%(5/32),明显低于A组的29.0%(9/31),差异有统计学意义(P<0.05)。
2.2 两组治疗有效率比较 A组患儿显效15例,有效9例,总有效率为77.4%(24/31);B组患儿显效20例,有效10例,总有效率为93.8%(30/32)。B组患儿总有效率明显高于A组,差异有统计学意义(P<0.05)。
2.3 两组患儿动脉血气分析指标比较 治疗前,两组患儿pH值、FiO2、PaO2、PaCO2、BE比较,差异无统计学意义(P>0.05)。治疗48 h后,两组患儿pH值、FiO2、PaO2、PaCO2、BE较治疗前明显改善;B组患儿pH值、PaO2、BE高于A组,FiO2、PaCO2低于A组,差异有统计学意义(P<0.05)。见表2。
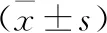
表2 两组患儿动脉血气分析指标比较
2.4 两组患儿炎症因子水平比较 治疗前,两组患儿血清TNF-α、IL-6、IL-8水平比较,差异无统计学意义(P>0.05)。治疗7 d后,两组患儿血清TNF-α、IL-6、IL-8水平均较治疗前明显降低,且B组低于A组,差异有统计学意义(P<0.05)。见表3。
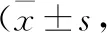
表3 两组患儿炎症因子水平比较浓度/pg·ml-1)
2.5 两组患儿呼吸机使用时间、住院时间、氧暴露时间及PEEP比较 B组患儿呼吸机使用时间、住院时间、氧暴露时间均短于A组,差异有统计学意义(P<0.05)。治疗前,两组患儿PEEP比较,差异无统计学意义(P>0.05)。治疗48 h后,两组患儿PEEP均较治疗前降低,且B组低于A组,差异有统计学意义(P<0.05)。见表4。
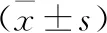
表4 两组患儿呼吸机使用时间、住院时间、氧暴露时间及PEEP比较
2.6 两组患儿并发症比较 两组患儿并发症发生率比较,差异均无统计学意义(P>0.05)。见表5。
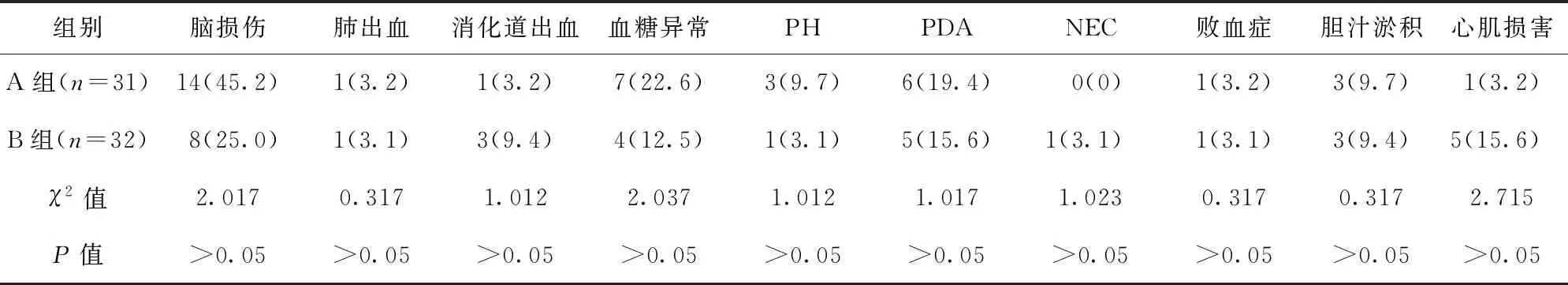
表5 两组患儿并发症发生情况/例(百分率/%)
2.7 两组患儿PS重复使用率比较 A组重复使用PS患儿3例,重复使用率为9.7%(3/31);B组重复使用PS患儿2例,重复使用率为6.3%(2/32)。两组患儿PS重复使用率比较,差异无统计学意义(P>0.05)。
3 讨论
新生儿呼吸窘迫综合征的发病机制是肺泡Ⅱ型上皮细胞不能合成及分泌足够的PS,导致肺泡张力增高,肺泡萎陷出现肺通气、换气功能障碍,患儿于出生后不久出现进行性呼吸窘迫,临床治疗首选PS制剂[1]。BPD是早产儿呼吸窘迫综合征常见的严重呼吸系统并发症之一[10]。胎龄小的早产儿发生呼吸窘迫综合征是因PS缺乏及肺微血管发育不良,长期吸入高浓度氧及呼吸机辅助通气,肺部血管重塑,最终导致肺纤维化,发生BPD[1]。有研究报道,2006—2008年出生的体质量<1 500 g早产儿的BPD发生率为19.3%,而2019年的上述统计数据为25.0%,有明显上升趋势[11-12]。PS药物的主要适应证为呼吸窘迫综合征,对呼吸窘迫综合征治疗效果显著,可有效降低呼吸窘迫综合征患儿病死率[13-14]。BPD的发生与有呼吸窘迫综合征的早产儿肺实质结构异常有关,治疗上单独使用PS制剂不能完全改善肺实质结构。咖啡因作为一种甲基黄嘌呤类药物,可抑制非选择性腺苷A1和A2受体,具有刺激呼吸中枢、增加二氧化碳敏感性、增强呼吸肌收缩力等生理作用,可有效促进早产儿自主呼吸,降低再次插管率,缩短呼吸机使用时间[15]。有研究报道,PS联合枸橼酸咖啡因治疗呼吸窘迫综合征患儿的临
床疗效与调节IL-6水平相关[16]。有研究报道,IL-8、TNF-α等炎性因子贯穿于早产儿呼吸窘迫综合征的整个病程,可反映肺局部的炎症程度[17-18]。
本研究结果显示,治疗后,B组血气分析指标较A组改善明显,说明联合用药更有利于改善呼吸窘迫综合征早产儿通气及氧合;治疗后,两组患儿炎症因子水平较治疗前降低,且B组炎症因子水平下降更明显,说明联合用药治疗更有利于减轻患儿炎症反应;B组呼吸机使用时间、氧暴露时间及住院时间均较A组短,B组治疗后呼吸机PEEP低于A组,表明联合用药治疗更有利于早产儿撤离呼吸机,并缩短住院时间及氧暴露时间。本研究中,两组患儿并发症发生率及PS重复使用率无明显差异,说明联合用药不会增加患儿并发症的发生,且安全性好,但并未改善早产儿PS重复使用情况,这可能与患儿胎龄小、出生体质量低有关。B组患儿BPD发生率为15.6%(5/32),明显低于A组的29.0%(9/31),说明联合用药治疗明显降低早产儿BPD的发生率,可能与静脉应用枸橼酸咖啡因能够抑制肺部炎症、改善肺功能有关。
综上所述,PS气管内滴入联合应用枸橼酸咖啡因能有效改善呼吸窘迫综合征早产儿的通气及氧合,可有效降低早产儿BPD发生率,缩短住院时间及氧暴露时间,降低炎症因子水平,但未降低PS重复使用率。

