基于PINK1/Parkin通路探讨灵芝孢子对糖尿病肾病模型大鼠肾脏细胞凋亡的影响
周广旭 齐亚灵 周少波 吴可佳 张莹 石瑞平 秦丽微 王淑湘 付宏扬 张欣 王淑秋
(1佳木斯大学基础医学院,黑龙江 佳木斯 154007;2海南医学院组织学与胚胎学教研室;3贝德福德大学生命科学学院生物与环境科学与技术研究所;4佳木斯大学附属第一医院)
糖尿病肾病(DN)是1型和2型糖尿病的一种由不受控制的高血糖长期累积肾单位进而损伤微血管的并发症〔1〕,严重者可造成终末期肾衰竭,在DN发生发展过程中会出现肾小球肥大、系膜细胞增生、扩张、肾小管萎缩等病理改变〔1,2〕。自噬是细胞识别并分解自身异常成分、自我保护的过程。在自噬过程中,双膜小泡会吞噬错误折叠、聚集的蛋白质和功能失调的细胞器,最终被溶酶体降解〔3〕。线粒体自噬可以抑制炎症〔4〕,减少细胞死亡信号,防止细胞在遇到各种刺激后发生损害〔5〕。PTEN诱导假定激酶(PINK)1/帕金森病蛋白(Parkin)途径通过调控自噬可及时识别并有效地清除异常线粒体,抑制氧化应激,维持细胞内环境稳态〔6〕。实验证实,在高糖状态下培养的足细胞,上调PINK1蛋白表达,可减少活性氧的生成,减轻足细胞损伤,使其功能蛋白正常表达〔7〕。
血糖的累积可损害肾小球内皮细胞,过度产生的活性氧导致氧化应激增强,进一步激活凋亡途径〔8〕,导致广泛功能障碍。灵芝在中国有千年药用史,对机体健康具有有益功效,是一种药食两用的真菌〔9〕。灵芝孢子用途广泛,目前已有研究表明,灵芝孢子通过改变巨噬细胞极性抑制肝癌细胞生长〔10〕。灵芝孢子具有明显降血脂、降血糖、抗氧化等作用,研究表明,通过灵芝进行干预的糖尿病实验,干预组大鼠血脂降低,高血糖症改善,胰岛素敏感增强性,糖耐量明显改善〔11〕。目前尚无关于灵芝孢子对DN模型大鼠中PINK1/Parkin信号通路潜在的自噬和凋亡的影响的研究。本研究以链脲佐菌素(STZ)诱导DN模型大鼠为研究对象并给予灵芝孢子灌胃治疗,通过生化指标试剂盒检测大鼠血清中相关生化指标水平、肾脏病理及自噬与凋亡的相关指标,探讨基于PINK1/Parkin通路灵芝多糖对DN模型大鼠肾脏结构和功能的主要影响。
1 材料与方法
1.1实验动物 从哈尔滨医科大学动物中心购进32只雄性SD大鼠〔实验动物许可证号:SYXK(黑)2016-014〕,体重180~200 g。
1.2实验试剂 STZ(Sigma公司),PINK1、Parkin、Bcl-2相关X蛋白(Bax)、B细胞淋巴瘤(Bcl)-2均购自博士德生物工程有限公司,P62购自碧云天生物公司,微管相关蛋白1轻链(LC)3、含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)3购自美国Abcam公司,激活型半胱氨酸天冬氨酸蛋白水解酶(Cleaved-Caspase)3购自CST公司。尿蛋白定量测定法(CCB)尿蛋白试剂盒、血清肌酐检测试剂盒及脲酶法尿素氮测试盒(批号均为:20201213,南京建成)、Masson染色试剂盒(货号:20210320)、过碘酸希夫反应(PAS)染色液试剂盒(货号:20210320)均购自北京索莱宝公司,灵芝孢子购自黑龙江省佳木斯市灵芝养殖场。
1.3DN模型制备和分组 32只SPF级雄性SD大鼠以躲避强光和噪声,自由饮食和水喂养1 w。应用随机数字表法分为正常对照(NC)组、高脂高糖(HF)组、DN模型(DN)组、灵芝孢子(GLSP)组各8只。HF组、DN组、GLSP组饲喂高脂高糖饲料(基础饲料59%,白糖20%,猪油18%,蛋黄3%)28 d。禁食不禁水12 h后,DN组和GLSP组采用腹腔注射STZ(50 mg/kg),NC组和HF组按相同环境、相同方法注射枸橼酸-枸橼酸盐缓冲液(根据体重计算相应大鼠的注射量)。注射完毕后不立刻给予食物,2 h后直接饮用葡萄糖。3 d后,用眼科剪刀剪断尾部末端取血检测选择血浆葡萄糖≥16.7 mol/L的大鼠。模型制备成功后,GLSP组每日灌胃给予灵芝孢子〔300 mg/(kg·d)〕,其余3组灌胃给予等量生理盐水。每周固定时间测定空腹血糖。12 w后麻醉处死。
1.4取材与处理 待大鼠状态稳定后,用无菌生理盐水配制0.3%戊巴比妥钠(40 mg/kg)溶液腹腔注射麻醉大鼠,分离出肾脏血管将其夹闭,从腹主动脉处进针采血 1 ml。取出肾脏组织并剥离肾脏被膜,一部分置于10%甲醛溶液固定24 h并标注分组,以用于蜡块包埋进行病理学检查及免疫组化分析。其余肾组织分成小块分组分装在EP管内并放在-80℃冰箱中保存,用于进一步Western印迹检测相关蛋白。
1.5肾脏组织病理学检测 将肾脏用10%甲醛溶液固定并包埋,分别进行苏木素-伊红(HE)染色、PAS染色和Masson染色,用光学显微镜分别进行组织形态病理学观察、系膜细胞及基底膜观察、肾脏纤维化程度。
1.624 h尿蛋白、血清肌酐及尿素氮检测 24 h尿蛋白检测:将大鼠分批次置于金属代谢笼中正常饮水并禁食1 d(注意大鼠粪便),收集尿液并按照编号标识保存。充分混匀,静置5 min,波长595 nm,双蒸水调零,利用全自动酶标仪Synergy HT测定各管吸光度值。血清肌酐及尿素氮检测:将装有全血的分离胶试管在3 500 r/min条件,离心30 min后,EP管分装血清,-80℃条件保存。分别用尿素氮试剂盒和肌酐测定试剂盒进行检测。
1.7肾脏组织病理学检测 将充分固定完成的肾脏进行石蜡包埋并切片,分别进行HE染色、PAS染色和Masson染色,用光学显微镜分别进行组织形态病理学观察、系膜细胞及基底膜观察、肾脏纤维化程度。
1.8免疫组化检测 60℃恒温箱烤片15 min,新鲜二甲苯2次脱蜡,放置100%、95%、90%、85%、80%、75%乙醇脱水,枸橼酸盐缓冲液(pH6.2)热修复抗原,磷酸盐缓冲液(PBS)振荡冲洗,5%牛血清白蛋白(BSA)封闭液37℃水浴箱孵育,滴加适当比例稀释的一抗4℃冰箱过夜,PBS洗涤,滴加生物素化的抗兔或抗鼠二抗放置湿盒37℃孵育,滴加链霉亲和素生物复合物(SABC)放置湿盒37℃孵育,二氨基联苯胺(DAB)显色1~5 min,苏木素轻度复染并蓝化1~2 h,脱水至透明,中性树胶封片烘干,光学显微镜进行图像采集,并对阳性面积进行分析。
1.9TUNEL检测法观察肾脏组织凋亡细胞分布及凋亡率情况 60℃恒温箱烤片30 min,二甲苯脱蜡,梯度乙醇脱水,枸橼酸盐缓冲液(pH6.2)热修复,50 μl 3%H2O2室温避光静置,50 μl TUNEL反应缓冲液(此步骤之后直至荧光观察前的所有实验步骤需避光进行),4′,6-二脒基-2-苯基吲哚(DAPI)复染细胞核,抗荧光淬灭剂封片。制成的片子应立即观察,或避光保存于-20℃,1 w之内进行观察。阳性细胞核呈绿色荧光。
1.10Western印迹检测 RIPA裂解液研磨肾脏组织,离心取上清,二喹啉甲酸(BCA)试剂盒测蛋白浓度,置胶,根据蛋白浓度调整上样量,电泳:恒压80 V,marker跑出红线转恒压120 V,溴酚蓝即将跑出胶板,转膜:恒电流260 mA,30 min,封闭:5 % 脱脂奶粉37℃孵育,一抗4℃过夜,洗膜孵育TBST稀释HRP 标记的二抗,用BeyoECL Plus发光液在DM4000B图像信号采集分析系统中检测信号强度大小,再用Image J1.8软件分析条带光密度值,并与GAPDH内参吸光度的比值进行相对表达量的计算。
1.11统计学分析 采用SPSS22.0软件进行方差分析、LSD-t检验。
2 结 果
2.1各组大鼠一般状态比较 与造模前比较,DN组大鼠体重减轻,嗜睡而且反应迟缓,饮食增加,毛发杂乱不柔顺,小便异常频繁,垫料的湿度在同一时间内相比其他组要更严重。而GLSP组大鼠,精神比较活跃,对外界刺激有明显的躲避行为,但毛发无明显变化。
2.2各组空腹血糖、血清尿素氮、血肌酐及24 h尿蛋白水平比较 与NC组相比,DN组空腹血糖、24 h尿蛋白、血肌酐及尿素氮水平明显增多(P<0.01),而HF组空腹血糖、24 h尿蛋白、血肌酐及尿素氮水平无明显变化(P>0.05);与DN组与HF组相比,GLSP组空腹血糖、24 h尿蛋白、血肌酐及尿素氮水平明显降低(均P<0.01),见表1。

2.3各组肾脏组织病理学观察 HE染色观察大鼠肾脏形态病理学改变:NC组与HF组肾单位轮廓清晰,形态正常。在DN组中,肾小体直径增大,且部分肾小球内出现中性粒细胞及单核细胞,部分肾小囊消失,肾小管内出现蛋白管型,管壁变厚并伴水肿。经灵芝孢子干预,GLSP组肾小球内炎性细胞减少,肾小球直径减小,肾小管管壁均有改善。PAS染色观察大鼠肾脏形态病理学改变:DN组病理改变主要表现为肾小球体积增大,肾小球内有深浅不一红色淡染的阳性物质沉积,肾小球基底膜均质性增厚,系膜细胞增生,肾小囊基底膜明显增厚。与DN组相比,GLSP组肾小球中见少许红色淡染的阳性物质沉积,病变程度均减轻。NC组及HF组肾单位基本正常,未见明显的红色淡染的糖原沉积。Masson染色观察肾脏纤维化改变:DN组的肾小球内胶原纤维明显增加(胶原纤维呈蓝色),GLSP组肾脏组织呈部分蓝染胶原纤维沉积,NC组呈红染状态,HF组呈部分蓝染胶原纤维沉积。见图1。

图1 灵芝孢子对肾脏组织病理变化及形态学的影响(×400)
2.4各组免疫组化检测结果 DN组相比NC组肾脏P62、Bax蛋白阳性着色覆盖面积增多,蛋白表达升高,Bcl-2蛋白阳性着色覆盖面积减少,蛋白表达降低,HF组肾脏P62、Bax蛋白阳性着色覆盖面积增多,蛋白表达模式表现出较强的反应性,Bcl-2蛋白阳性着色覆盖面积减少,这种反应性明显降低;与DN组相比,GLSP组肾脏P62蛋白阳性着色覆盖面积减少,表达降低、Bax蛋白表达明显降低,阳性着色覆盖面积减少,Bcl-2蛋白阳性着色覆盖面积增多,表达模式表现出较强的反应性。见图2。
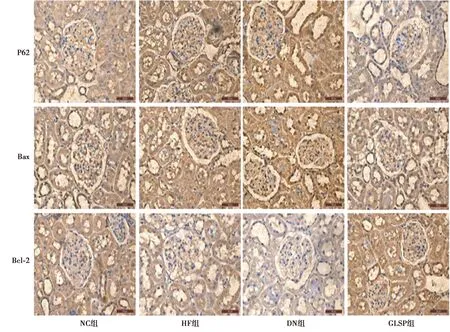
图2 各组肾脏中P62、Bax、Bcl-2蛋白表达(免疫组化,×400)
2.5各组肾脏细胞凋亡水平 NC组、HF组、DN组及GLSP组细胞凋亡率依次为(1.88±0.18)%、(6.77±0.45)%、(7.52±0.24)%、(4.06±0.31)%。NC组荧光强度较弱,肾脏细胞多数保持正常,有极少数细胞发生凋亡;与NC组相比,DN组中荧光强度增强,HF组中凋亡细胞明显增加(P<0.01);与DN组相比,GLSP组中细胞荧光强度明显下降(P<0.01)。见图3。

图3 TUNEL检查法观察各组肾脏细胞凋亡情况(×400)
2.6Western印迹法检测各组自噬蛋白表达 与NC组相比,DN组肾脏PINK1、Parkin蛋白表达及LC3Ⅱ/LC3Ⅰ比值显著降低,而P62蛋白表达显著升高(均P<0.01);与DN组相比,GLSP组肾脏PINK1、Parkin蛋白表达及LC3Ⅱ/LC3Ⅰ比值显著升高,而P62蛋白表达显著降低(均P<0.01)。见表2、图4。


图4 各组肾脏中PINK1、Parkin、LC3Ⅱ/Ⅰ、P62蛋白表达
2.7灵芝孢子预防DN大鼠的肾脏细胞凋亡 与NC组相比,DN组肾脏Bcl-2/Bax比值显著下调,Caspase3、Cleaved-Caspase3表达水平明显升高(P<0.01)。与DN组相比,GLSP组肾脏Bcl-2/Bax比值明显升高,Caspase3、Cleaved-Caspase3表达水平明显降低(P<0.01)。见表2、图5。
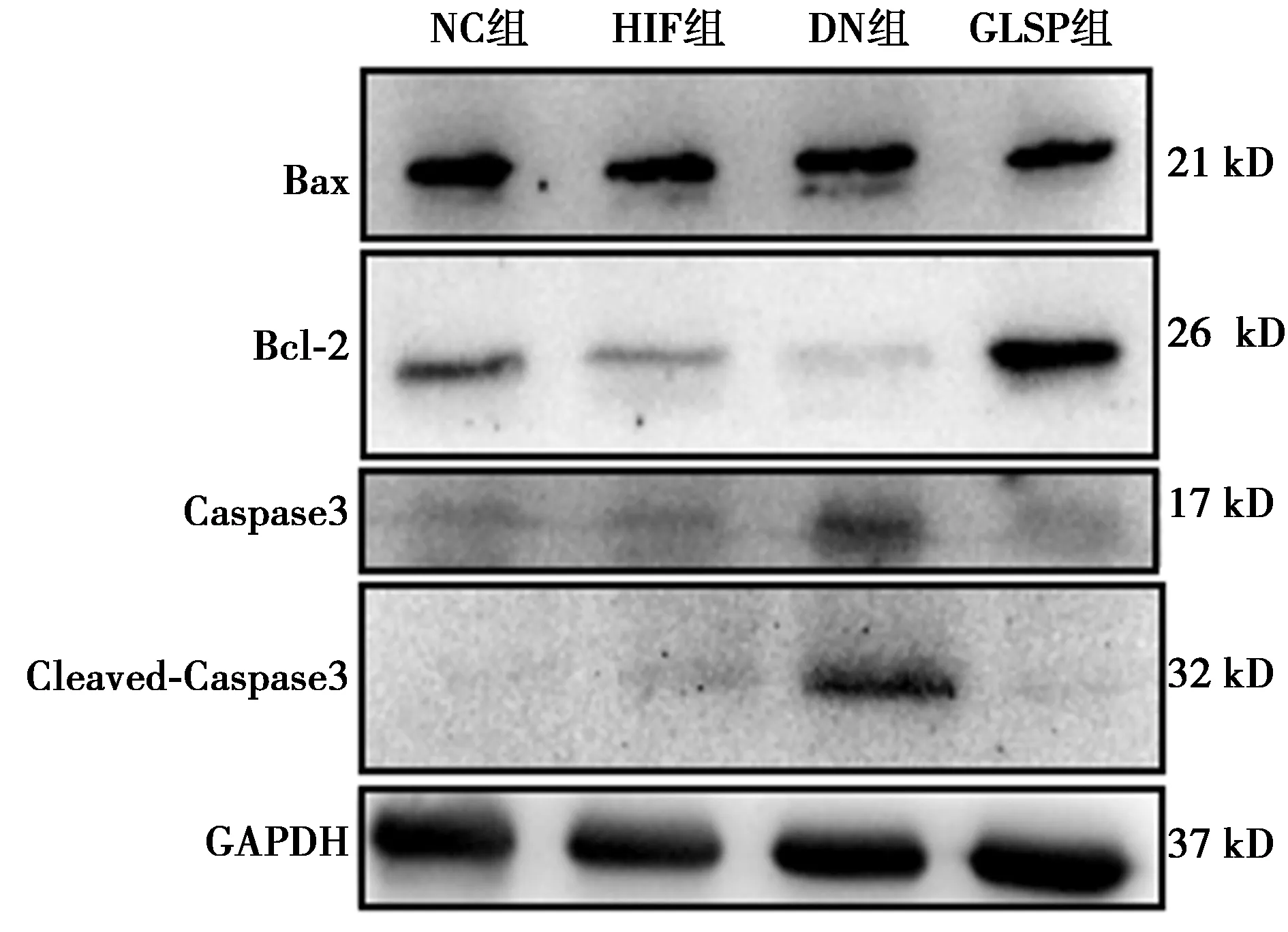
图5 各组肾脏Bax、Bcl-2、Caspase3、Cleaved-Caspase3蛋白表达
3 讨 论
本研究使用高脂高糖饮食联合腹腔注射STZ诱导大鼠制备T2DM模型〔12~15〕,发现单纯给予高脂高糖饲养的大鼠与正常饲料饲养的大鼠相比,血糖无明显变化,体重有略微增加,但相关蛋白有所改变,说明高脂高糖的不良饮食习惯会造成相关组织的损伤。通过分析大鼠肾脏细胞的损伤过程发现,受损的足细胞引起肾脏滤过大量的蛋白进而引发相关疾病〔15〕。本研究发现DN组大鼠尿液中出现大量的尿蛋白。
正常情况下,正常细胞受到任何刺激都可影响自噬的发生。当没有刺激时,机体由于衰老、细胞结构的丢弃、能量的回收等原因,自噬水平会有轻微的波动。正常细胞可通过线粒体自噬调节自身稳态。当细胞受到各种因素刺激时,通过PINK1/Parkin通路识别异常的线粒体并与溶酶体结合最终被水解酶降解。实验证实,高糖培养的足细胞活性氧显著增加造成线粒体损伤,上调PINK1后活性氧显著下降,通过调控自噬进一步清除受损的线粒体〔7〕。
PINK1是清除受损线粒体过程中所必需的蛋白,并进一步激活Parkin蛋白。本研究结果表明给予灵芝孢子治疗可激活DN模型大鼠肾脏细胞中保护性自噬。
线粒体损伤是引起细胞功能异常进而造成细胞死亡的主要原因〔16〕,过度产生的活性氧导致氧化应激,三磷酸腺苷(ATP)产生受到阻碍,细胞出现不可逆的损伤〔17,18〕。凋亡是细胞自发的、有规律的,是为了清除功能异常的细胞而维持稳态。当抑制正常细胞凋亡时,会引起癌症或相关疾病的产生,而激活细胞凋亡则会导致神经退行性病变及加重肾缺血再灌注损伤〔19,20〕。细胞凋亡时会伴随Bax结合线粒体复合物,抗凋亡蛋白Bcl-2、Bcl-xl和其他抗凋亡蛋白能够有效抑制线粒体上的促凋亡蛋白(tBid)/Bax或Bax/Bax复合体形成〔21〕。
本研究结果表明,随着给予灵芝孢子治疗,不仅可以改善大鼠肾功相关生化水平,而且血糖水平也得到了改善,灵芝孢子可能通过PINK1/Parkin通路,调节线粒体自噬,抑制重要的促凋亡蛋白表达,改善高血糖症,肾脏功能得以保障。但其具体的调节机制尚未明确,可进一步研究灵芝孢子对于氧化应激、线粒体动力相关蛋白及炎症等方向的关注。
综上,灵芝孢子可能基于PINK1/Parkin通路,改善高血糖症,减轻肾脏纤维化,通过激活肾脏细胞的保护性自噬,进而抑制肾脏细胞凋亡,提高肾脏滤过能力,改善肾脏细胞损害从而保护肾脏。

