结合珠蛋白和血红蛋白对氧葡萄糖剥夺-再恢复小鼠小胶质细胞的影响
陈枝挺 赵振华 蔡国恩 李元霄 林汉斌 刘昌云 叶钦勇
(福建医科大学 1附属协和医院神经内科,福建 福州 350001;2临床神经病学研究所;3福建省立临床医学院)
小胶质细胞约占脑部胶质细胞总数的20%,是巨噬细胞在中枢神经系统中的特殊存在形式〔1〕。当受到外界不同刺激后,小胶质细胞也类似巨噬细胞发生极化,分化为促炎作用为主的经典活化型(M1)或抗感染作用为主的替代活化型(M2)〔2〕。脑梗死是一个复杂的病理生理过程,小胶质细胞发挥了神经修复和神经损伤的双重作用〔3〕。了解小胶质细胞的作用规律,调控小胶质细胞的分化,是缺血性脑卒中治疗的一个重要策略。血红蛋白(Hb)是红细胞中携带氧的重要蛋白。红细胞破坏后,游离的Hb与血液中的结合珠蛋白(Hp)快速结合,二者通过巨噬细胞表面的CD163受体内吞而清除Hb〔4〕。脑出血〔5〕和蛛网膜下腔出血的研究〔6〕都证实了Hb会诱导小胶质细胞活化,其促炎作用导致血管炎症、脑水肿、外周炎性细胞黏附等,加重脑损伤。在严重的脑梗死部位,外周血液中的各种成分,包括Hp、红细胞,可通过受损的血脑屏障进入梗死区。病灶内的小胶质细胞可能受到红细胞破坏后释放的Hb和缺血缺氧的双重刺激,细胞损伤和极化的情况尚不明确。小胶质细胞在利用Hp清除游离Hb的过程中,是否发生了细胞活化和细胞极化的改变,也未见相关报道。本研究采用小鼠BV2细胞构建氧葡萄糖剥夺-再恢复(OGDR)细胞模型,同时给予Hb和(或)Hp干预,观察BV2细胞的损伤、激活情况及炎性因子表达的变化规律。
1 材料与方法
1.1细胞来源 小鼠小胶质细胞BV2购自中国国家生物医学实验细胞资源库,在福建省老年医学研究所液氮中常规保存。
1.2细胞常规培养及分组 将细胞复苏于含10%胎牛血清的高糖DMEM中,在细胞培养箱中以37℃、5%CO2条件进行常培培养。0.25%胰酶-乙二胺四乙酸(EDTA)消化1∶8传代,3~5 d传代1次。把BV2细胞以2×105个/ml的密度接种于96孔板。为观察Hb和Hp对常规培养的BV2细胞的影响,常规培养的BV2细胞分别加入不同浓度Hb(5、10、15、20 μmol/L Hb)、4 μmol/L Hp和15 μmol/L Hb+4 μmol/L Hp共培养1 d后,进行相应指标的观察。以常规培养的BV2细胞为对照组。
1.3OGDR干预及分组 把BV2细胞以2×105个/ml的密度分别接种于24和96孔板,次日,细胞汇合度达到50%~60%后用于后续试验。参考Badiola等〔7〕和杨碧莹等〔8〕的方法,将含10%胎牛血清的高糖DMEM培养基换成Earle平衡盐溶液,把细胞培养板移入低氧培养箱中,连续通入含95%N2和5%CO2的混合气体30 min,再放回37℃、5%CO2培养箱中培养进行氧葡萄糖剥夺,4 h后更换成含10%胎牛血清的高糖DMEM培养基在37℃、5%CO2的培养箱中继续培养造成OGDR损伤,1 d后细胞损伤达30%~40%为造模成功。为观察Hb和Hp OGDR损伤对BV2细胞的影响,在氧葡萄糖剥夺4 h后加入Hb和(或)Hp在37℃、5%CO2培养箱继续培养1 d,分为OGDR组(OGDR损伤)、5、10、15、20 μmol/L Hb组(OGDR损伤+5、10、15、20 μmol/L Hb)、Hp组(OGDR损伤+4 μmol/L Hp)和Hb+Hp组(OGDR损伤+15 μmol/L Hb+4 μmol/L Hp),干预1 d后,进行相应指标观察。
1.4细胞计数试剂盒(CCK)8法检测细胞存活率 细胞以2×105个/ml接种于96孔板,每组细胞设3个复孔。各组细胞接受干预1 d后弃去培养基,加入100 μl相应培养基及10 μl CCK-8,培养箱中避光孵育0.5 h后,于多功能酶标仪上测定各孔的吸光度(A)值(波长450 nm),计算各组细胞的存活率。存活率(%)=处理组吸光度(A)值/对照组吸光度(A)值×100%。
1.5实时荧光定量聚合酶链反应(RT-PCR)检测mRNA的表达 按RNA提取试剂盒操作说明书提取总RNA。按照逆转录试剂盒说明书操作将RNA逆转录为cDNA。得到的cDNA再进行后续的RT-PCR检测相应的mRNA表达。M1型小胶质细胞的高表达基因包括诱导型一氧化氮合酶(iNOS)、分化群(CD)32和CD11b,M2型小胶质细胞的高表达基因包括CD206、精氨酸酶(Arg)1、几丁质酶样蛋白(CHIL)3和CD163。PCR引物序列分别为:iNOS正向:CAAGCACCTTGGAAGAGGAG,反向:AAGGCCAAACACAGCATAC;CD32正向:AATCCTGCCGTTCCTACTGATC,反向:GTGTCACCGTGTCTTCCTTGAG;CD11b正向:CCAAGACGATCTCAGCATCA,反向:TTCTGGCTTGCTGAATCCTT;CD206正向:CAA-GGAAGGTTGGCATTTGT;反向:CCTTTCAGTCCTTTGCAAGC;Arg1正向:TCACCTGAGCTTTGATGTCG;反向:CTGAAAGGAGCCCTGTCTTG;CHIL3正向:CAGGGTAATGAGTGGGTTGG,反向:CACGGCACC-TCCTAAATTGT;CD163正向:ACGGGTGGTGAAAACAAGTGCT,反向:TCTCAGTTTCAGGTCTGCTCCA;内参β-肌动蛋白(actin)正向:AGGCATCCTGACCCTGAAGTAC,反向:TCTTCATGAGGTAGTCTGTCAG。PCR条件为98℃,5 min;98℃,5 s;60℃,30 s,40个循环。PCR结束后,进行熔炼曲线分析扩增曲线在仪器自带软件分析获取Ct值,mRNA相对表达量=2-(△CT实验组目的基因-△CT对照组内参基因)。
1.6酶联免疫吸附试验(ELSIA)检测炎症因子白细胞介素(IL)-6、IL-10和肺瘤坏死因子(TNF)-α表达 细胞以2×105个/ml接种于24孔板,每组细胞设3个复孔。到达干预时间后,吸取细胞培养液,3 000 r/min离心10 min,吸取上清,根据ELISA试剂盒说明书,检测IL-6、IL-10和TNF-α表达。
1.7Western印迹检测GPX4蛋白表达 提取细胞总蛋白,采用二喹啉甲酸(BCA)法测定蛋白浓度。以β-actin为内参。10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳后,通过电转将蛋白转移到聚偏氟乙烯膜上,3%脱脂奶粉封闭1 h。分别加入一抗(1∶500 GPX4抗体,1∶2 000 β-actin抗体)4℃孵育过夜,TBST洗膜3次,加入相应二抗(1∶5 000)室温孵育1 h,TBST洗膜3次,电化学发光(ECL)法显色,化学发光成像仪拍照。采用Image J分析软件分析条带的灰度值,比较目的条带和内参的比值。
1.8统计学分析 采用SPSS19.0软件进行单因素方差分析,对于方差齐的样本,两两比较采用LSD法检验;对于方差不齐的样本,两两比较采用DunnettT3法检验。
2 结 果
2.1各组BV2细胞生存率比较 常规培养条件下,BV2细胞给予不同浓度的Hb、Hp及Hb+Hp进行干预,各组细胞存活率干预前后比较差异无统计学意义(P>0.05)。OGDR干预BV2细胞的同时加入不同浓度Hb和(或)4 μmol/L Hp进行干预,与对照组比较,OGDR损伤的各组细胞存活率明显下降(P<0.05);与OGDR组相比,15、20 μmol/L Hb组及Hb+Hp组细胞存活率明显下降(P<0.05);与15 μmol/L Hb组相比,Hb+Hp组细胞存活率明显下降(P<0.05)。见表1。
表1 各组BV2细胞存活率的比较
2.2各组BV2细胞炎症因子比较 与对照组、OGDR组和15 μmol/L Hb组相比,Hb+Hp组IL-6及TNF-α水平明显升高(P<0.010)。各组IL-10水平差异无统计学意义(P>0.05)。见表2。
2.3各组BV2细胞极化标志物的mRNA表达比较 各组CHIL3、Arg-1、CD163和CD11b mRNA表达差异无统计学意义(均P>0.05);各组CD206、iNOS和CD32 mRNA表达差异有统计学意义(均P<0.01)。见表2。
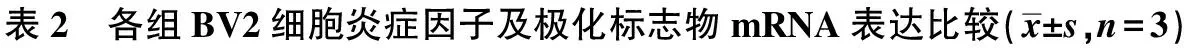
2.4各组BV2细胞GPX4蛋白表达比较 与对照组〔(100.0±0.0)%〕、OGDR组〔(117.7±21.0)%〕和15 μmol/L Hb组〔(104.3±7.5)%〕对比,Hb+Hp组GPX4表达量〔(62.0±15.1)%〕明显降低(P<0.05)。见图1。

1~4:对照组,OGDR组,15 μmol/L Hb组,Hb+Hp组图1 各组BV2细胞GPX4蛋白表达
3 讨 论
小胶质细胞大多处于静息状态,当其受到缺血缺氧损伤微环境的刺激后,可以表现出巨噬细胞样功能和细胞极化现象,同时产生各种细胞因子和生长因子,通过旁分泌的方式影响神经血管单元内神经元和星形胶质细胞〔9〕。M1型的小胶质细胞可诱导促炎因子(如CD16 Fc受体、CD32、CD64、IL-1、IL-6、IL-12、IL-23和TNF-α)上调,能加重神经损伤,而M2型的小胶质细胞能够释放抗炎因子(如IL-10、转化生长因子-β)和一些生长因子,抑制炎症反应而发挥神经保护作用〔10〕。因此,调控小胶质细胞的极化,减少其过度的促炎效应,增加其抗炎效应,是脑卒中治疗的一个重要策略。
小胶质细胞在发生脑缺血损害时表现出规律性的极化现象。首先,极化现象与脑缺血损害的时间有关。Hu等〔11〕对小鼠局灶短暂性脑缺血模型的研究发现,M1型小胶质细胞在造模第3天后逐渐升高,M2型小胶质细胞在造模的第1~3天开始升高并于第3~5天达峰后逐渐减少或向M1型转化。Suenaga等〔12〕永久闭塞大脑中动脉和颈总动脉制作小鼠脑缺血模型发现,M1型和M2型小胶质细胞都在造模的第3天开始显著上升,并且前者在第14天到达高峰逐渐回落,而后者在第7天达到高峰。其次,极化现象与缺血损害的位置有关。Perego等〔13〕对持续性大脑中动脉闭塞的小鼠脑缺血模型的研究发现,在造模后24 h后,CD68为代表的M1型细胞主要在缺血周边区域大量表达,而CHIL3和CD206为代表的M2型细胞在缺血核心区表达更高;在造模7 d后,梗死区域的CD68表达明显增加,特别在缺血核心区域增加更为明显,而M2型细胞则无明显变化。
脑缺血损伤是一个伴随着血脑屏障破坏的病理生理过程。当梗死区域发生严重的血管壁破坏和血脑屏障功能受损时,血管中物质可能大量进入缺血损伤的脑组织引起和加速出血转化、脑水肿等现象,加重神经功能恶化〔14〕。已有研究表明红细胞破裂后释放出的Hb就一种可以诱导小胶质细胞M1型极化的物质。Peng等〔15〕在常规培养的小胶质细胞中加入Hb,小胶质细胞出现了M1型极化现象,IL-1β、TNF-α和IL-6等mRNA表达和分泌都出现升高。Wei等〔16〕使用Hb干预BV2细胞,也观察到iNOS和CD206细胞的比例明显升高,同时在蛛网膜下腔出血的小鼠模型中也发现了小胶质细胞的增殖和M1极化现象。脑卒中受累区域有可能受到缺血缺氧损伤和游离Hb的双重打击,其中的小胶质细胞的极化现象还未见相关的研究报道。本研究结果提示,BV2细胞经OGDR与Hb刺激后,可以诱导M1型极化。在此基础上加用Hp干预后的结果提示,Hp促进了BV2细胞进一步向M1型极化。本研究提示在缺血缺氧和Hb的共同刺激可促进小胶质细胞的促炎反应,Hp则进一步加速了M1型极化,可能加重局部的炎症反应。
红细胞破坏后,产生的血红素铁可与内源性的过氧化氢产生自由基,加重周围组织的损伤。同时,Hb可快速且不可逆地结合一氧化氮,导致高铁血红蛋白生成,影响一氧化氮调节血管舒张的生物学活性。Hb和清道夫受体结合低下,只有与Hp结合后,二者的复合物才能被清道夫受体结合,被巨噬细胞/小胶质细胞吞噬而分解〔17〕。游离的Hb会诱发脑水肿、炎性反应及神经元死亡〔18〕。但是关于Hb是否直接导致小胶质细胞损伤的研究报道较少。Wang等〔19〕采用20 μmol/L Hb干预小胶质细胞可诱导自噬反应,但是作者并未对细胞存活率的改变进行研究。本研究发现,在常规培养条件下,Hb在短时间内并不会对的BV2细胞的存活造成明显影响。但是在OGDR损伤的同时,随着Hb干预浓度增加,可引起BV2细胞的存活率明显下降。说明Hb加重了OGDR对BV2细胞的损伤。在此基础上同时给予Hp干预,BV2细胞存活率进一步下降,说明Hp促进BV2细胞摄取Hb,可能进一步加重OGDR对细胞的损伤。这些结果提示在特定情况下较大剂量Hb及Hp增加Hb摄取,可造成Hb对BV2细胞的毒性。内源性GPX4是一种硒依赖的内源性抗氧化酶,其主要通过抵抗脂质过氧化物而阻止细胞死亡〔20〕。本研究结果提示BV2细胞的损伤可能与抗氧化酶缺乏有关。
综上,在OGDR条件下,Hb和Hp造成了BV2细胞的损伤,与抗氧化蛋白GPX4不足有关,同时促进了细胞的M1型极化。

