乙醇溶液中魔芋精粉低温溶胀特性
段丹,陈远文,张宇,陈绍军,林川,邓小东
内江市农业科学院(内江 641000)
新鲜魔芋为扁球形块茎,一般将其加工成魔芋精粉使用[1],其加工方法通常采用湿法(有机)加工法,通过钝化剂阻止魔芋精粉溶胀,除去魔芋精粉中的淀粉、生物碱、单宁,魔芋精粉品质比干法生产的更高[2]。但在湿法有机加工精粉中,常出现问题:魔芋精粉湿法(有机)加工法,需要大量酒精,导致加工成本高;在整个加工过程中将产生大量混合液,在混合液中含有大量水分、15%~35%的酒精、灰分、生物碱、微量的细精粉、纤维杂质等湿法加工魔芋精粉。因此,湿法有机加工精粉中如何设计有效地减少乙醇消耗量十分重要。在常温下,30%的乙醇溶液能有效地阻止魔芋精粉溶胀,在-10 ℃下,10%的乙醇溶液也能有效地阻止魔芋精粉溶胀,但在-10 ℃下10%的乙醇溶液比常温30%的乙醇溶液节约一半的成本,所以为了降低魔芋精粉加工成本,需要研究低温下魔芋精粉的溶胀特性。该试验通过比较魔芋精粉在水与乙醇溶液中溶胀度的差异,并以乙醇溶液作为钝化剂研究溶胀温度、溶胀时间及乙醇体积分数对魔芋溶胀度的影响,寻找魔芋精粉在这类溶剂中的溶胀规律,为魔芋分离纯化和产品应用提供理论依据[3]。
1 材料与方法
1.1 试验材料与试剂
鲜魔芋(会理纵横实业有限公司);乙醇、无水亚硫酸钠(均为分析纯,成都长征生物试剂公司提供)。
1.2 试验仪器与设备
电子天平(FA2004Max200g,沈阳龙腾电子有限公司);酒精计(陕西唐仪测控科技有限公司);搅拌机(PHILIPS飞利浦HR2027);真空抽滤机(上海领德仪器有限公司);冰箱(广州傲雪制冷设备有限公司)。
1.3 试验方法
1.3.1 酒精阻溶剂溶液配制
50%酒精溶液(1 000 mL)+0.1 g无水亚硫酸钠,保持精粉产品洁白、杂质少,起到漂白、脱水、防氧化褐变作用。
1.3.2 魔芋精粉制备
先将新鲜的魔芋用清水清洗,接着用刀将表面干燥的魔芋球茎去掉外层表皮,特别对虫眼、腐烂变质处刮干净,将干净的魔芋切成小片,按固液比1∶5(g/mL),向搅拌机中加一定量的魔芋小片和酒精阻溶剂溶液粉碎,置于真空抽滤机中抽滤,过滤去除溶剂,即得到待用的魔芋精粉。
1.3.3 溶胀度测定[4]
用电子天平称取2.5 g由抽滤机抽滤后的魔芋精粉(MO),放在100 mL烧杯中,加入水或乙醇溶液,在一定温度下静置一定时间,置于真空抽滤机中抽滤,过滤去除溶剂,称溶胀后的魔芋质量(Mt),按式(1)计算溶胀度(SD)。

1.3.4 常温下魔芋精粉在水中的溶胀效果
用电子天平称取2.5 g由抽滤机抽滤后魔芋精粉,放在100 mL烧杯中,用量筒加入50 mL蒸馏水,放置在常温下静止2 min,取出置于抽滤机中抽滤,过滤去除溶剂,称溶胀后的魔芋精粉质量。
1.3.5 溶胀时间对溶胀效果的影响
用电子天平各称取2.5 g由抽滤机抽滤后魔芋精粉,分别放在4个100 mL烧杯中,各用量筒加入50 mL 20%的乙醇,分别放置在温度为-10 ℃的冰箱里0.5,1.0,2.0和4.0 min,取出置于抽滤机中抽滤,过滤去除溶剂,称溶胀后的魔芋精粉质量。
1.3.6 溶胀温度对溶胀效果的影响
用电子天平分别称取2.5 g由抽滤机抽滤后魔芋精粉,放在4个100 mL烧杯中,各用量筒加入50 mL 20%的乙醇,分别在温度-5,-10,-15和-20 ℃的冰箱中放置2 min,取出置于抽滤机中抽滤,过滤去除溶剂,称溶胀后的魔芋精粉质量。
1.3.7 乙醇体积分数对溶胀效果的影响
用电子天平分别称取2.5 g由抽滤机抽滤后魔芋精粉,放在4个100 mL烧杯中,用量筒分别加入50 mL 5%,10%,15%和20%的乙醇,放在温度为-10 ℃的冰箱里2 min,取出置于抽滤机中抽滤,过滤去除溶剂,称溶胀后的魔芋精粉质量。
1.3.8 正交试验
根据单因素试验的结果,选择对魔芋精粉溶胀效果有影响的3个因素提取时间、乙醇体积分数、提取温度,做三因素三水平L9(33)的正交试验,因素及水平见表1。根据试验结果作分析,得到在乙醇中阻止魔芋精粉溶胀的最佳工艺条件。

表1 正交试验的因素及水平表
2 结果与讨论
2.1 魔芋精粉在水中的溶胀度
魔芋葡甘聚糖可快速溶胀,溶解于水中,不溶解、不溶胀于乙醇中[5]。由图1可以看出,魔芋精粉在水中的溶胀度随着时间延长而增大,3 min时的溶胀度是1 min时溶胀度的1.95倍,2 min时的溶胀度是1 min时溶胀度的1.68倍,3 min时的溶胀度是2 min时的1.16倍,可知魔芋精粉在水中的溶胀随着时间的增长呈上升趋势,但时间越长,魔芋精粉在水中溶胀倍数越小。
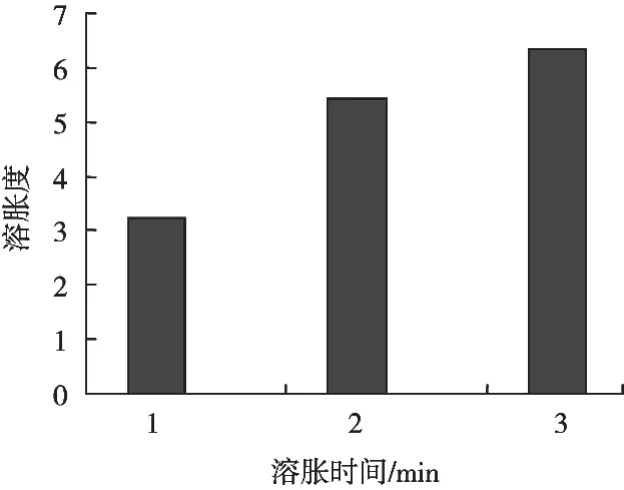
图1 常温下水中魔芋精粉溶胀度与溶胀时间的关系
2.2 溶胀时间对溶胀度的影响
分别测定魔芋精粉在20%乙醇溶液中放置不同时间的溶胀度变化,溶胀度与溶胀时间的关系见图2。高分子溶胀和溶解是一个动态平衡过程[6],随着提取时间延长,魔芋精粉溶胀度呈现先增大后稍平缓的趋势。溶胀时间0.5~1 min,溶胀度上升0.025;溶胀时间1~2 min溶胀度上升0.04;溶胀时间2~4 min,溶胀度上升0.006;溶胀时间4 min以后提取率没有变化。同时可以观察到,溶胀时间大于4 min时延长溶胀时间对溶胀度的上升无明显效果,所以魔芋精粉加工时间不宜过长,取2 min为宜。

图2 20%乙醇溶液中魔芋精粉溶胀度与溶胀时间的关系
2.3 温度对溶胀度的影响
溶胀是魔芋精粉直接液化升温过程中黏度发生变化的主要原因之一。温度小于10 ℃魔芋精粉呈液态,温度大于10 ℃时,呈热可逆性凝胶固态[12]。为检测温度对溶胀度大小的作用,分别测定溶胀初期2 min内,不同温度下魔芋精粉在浓度20%的乙醇溶液中的溶胀度变化。溶胀度与温度的关系见图3。在由温度从高到低时魔芋精粉的溶胀度表现为下降趋势,即从-5 ℃至-10 ℃的溶胀度下降0.035,从-10 ℃至-15 ℃的溶胀度下降0.04,总的来说,溶胀温度对魔芋精粉溶胀度的影响不大。
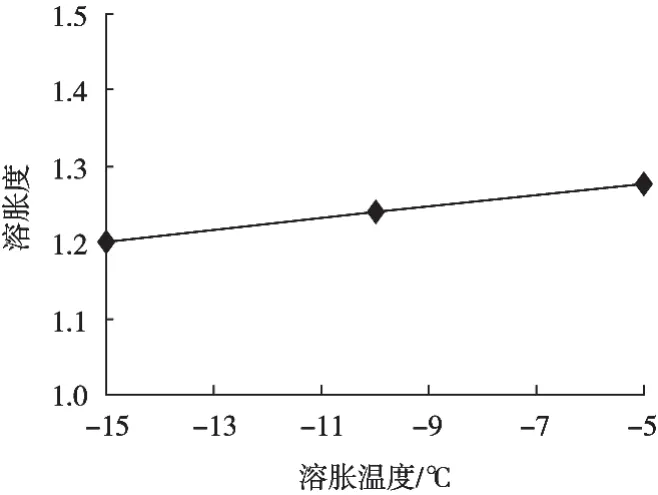
图3 20%乙醇溶液中魔芋精粉溶胀度与溶胀温度的关系
2.4 酒精浓度对溶胀度的影响
魔芋精粉溶于水发生溶胀,吸水力可大到80~100倍,不溶解于乙醇溶剂中[7]。魔芋精粉在乙醇溶液中有一定溶胀能力。溶胀的大小取决于哪种类型的键在魔芋精粉中占主导作用及溶剂的性质。共价键在通常条件下用普通溶剂是不可能断裂的,因此,只有非共价键力(离子力、氢键力、电荷转移力)在溶胀现象中起重要作用[8]。
图4表明,魔芋精粉在水中的溶胀度明显大于在乙醇水溶液中的溶胀度;乙醇体积分数从5%上升至20%,溶胀度呈先显著下降后稍平缓趋势。在折线图中:5%~10%魔芋精粉的溶胀度下降0.124;10%~15%魔芋精粉的溶胀度下降0.008;15%~20%魔芋精粉的溶胀度下降0.007;可见继续增大乙醇体积分数对溶胀度的下降没有显著效果。结果表明乙醇体积分数20%时魔芋精粉溶胀度最小,阻止魔芋精粉溶胀效果最好。
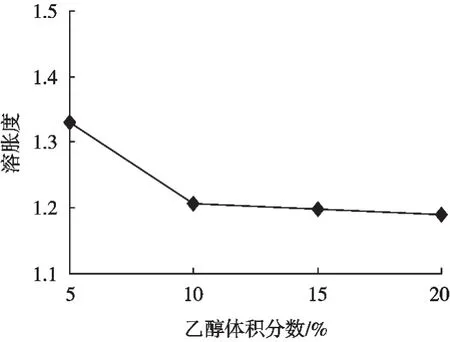
图4 魔芋精粉溶胀度与乙醇体积分数的关系
2.5 正交试验
根据单因素试验的结果,正交试验安排及结果列于表2,通过对乙醇体积分数、溶胀温度、溶胀时间的综合评价可知,在试验条件限定的范围内,从极差大小可以看出各因素对魔芋精粉溶胀影响的主次顺序。
从表2可以看出,乙醇体积分数的变化对魔芋精粉溶胀影响最大,溶胀时间对提取率的影响最小,3个因素对魔芋精粉溶胀效果影响的主次顺序是乙醇体积分数>溶胀温度>溶胀时间。
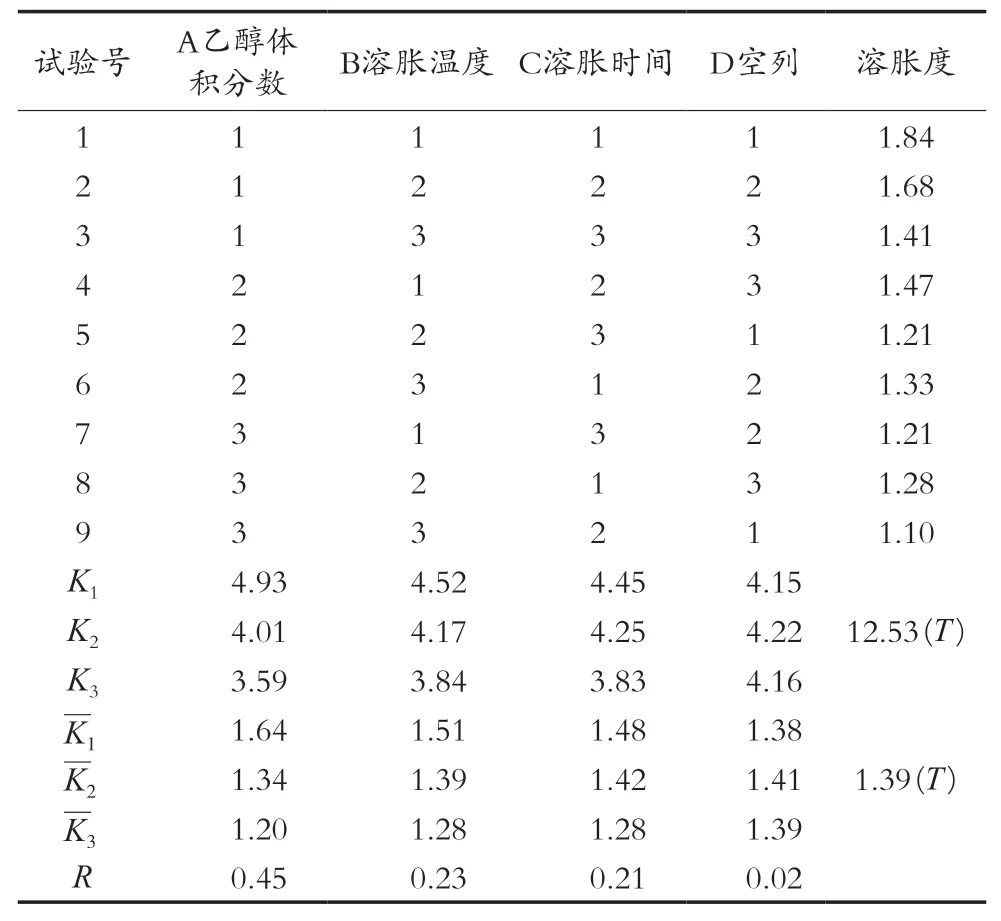
表2 正交试验结果与分析
从表3的方差分析可知:FA=327.7209>99.00,pA<0.01;FB=80.6744>99.00,0.01<p<0.05;19.00<FC=69.860 5<99.00,0.01<p<0.05。分析表明乙醇体积分数对魔芋精粉溶胀有极显著影响,溶胀温度和溶胀时间有显著影响。
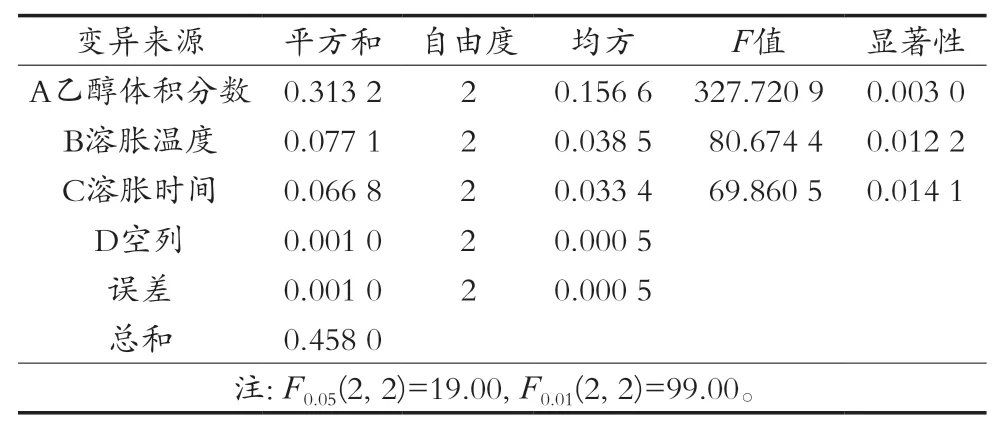
表3 方差分析结果
根据各因素不同水平均值多重比较(SSR)可知:在1~3 min时,随着溶胀时间的延长,魔芋精粉的溶胀度有显著变化,溶胀时间在达到3 min时,再延长溶胀时间对魔芋精粉溶胀已无显著效果;随着乙醇体积分数水平的增加,魔芋精粉溶胀度有显著变化,它随着乙醇体积分数上升而下降,当乙醇体积分数为20%时,溶胀度最小,阻止魔芋精粉在加工中效果最好;在-1~-5 ℃时,随着温度的增大,魔芋精粉的溶胀度有显著变化。据此可以判断出较优的提取工艺为A3B3C3或A2B3C3。由于正交试验中不包含上述组合,需做补充试验验证,验证结果见表5。
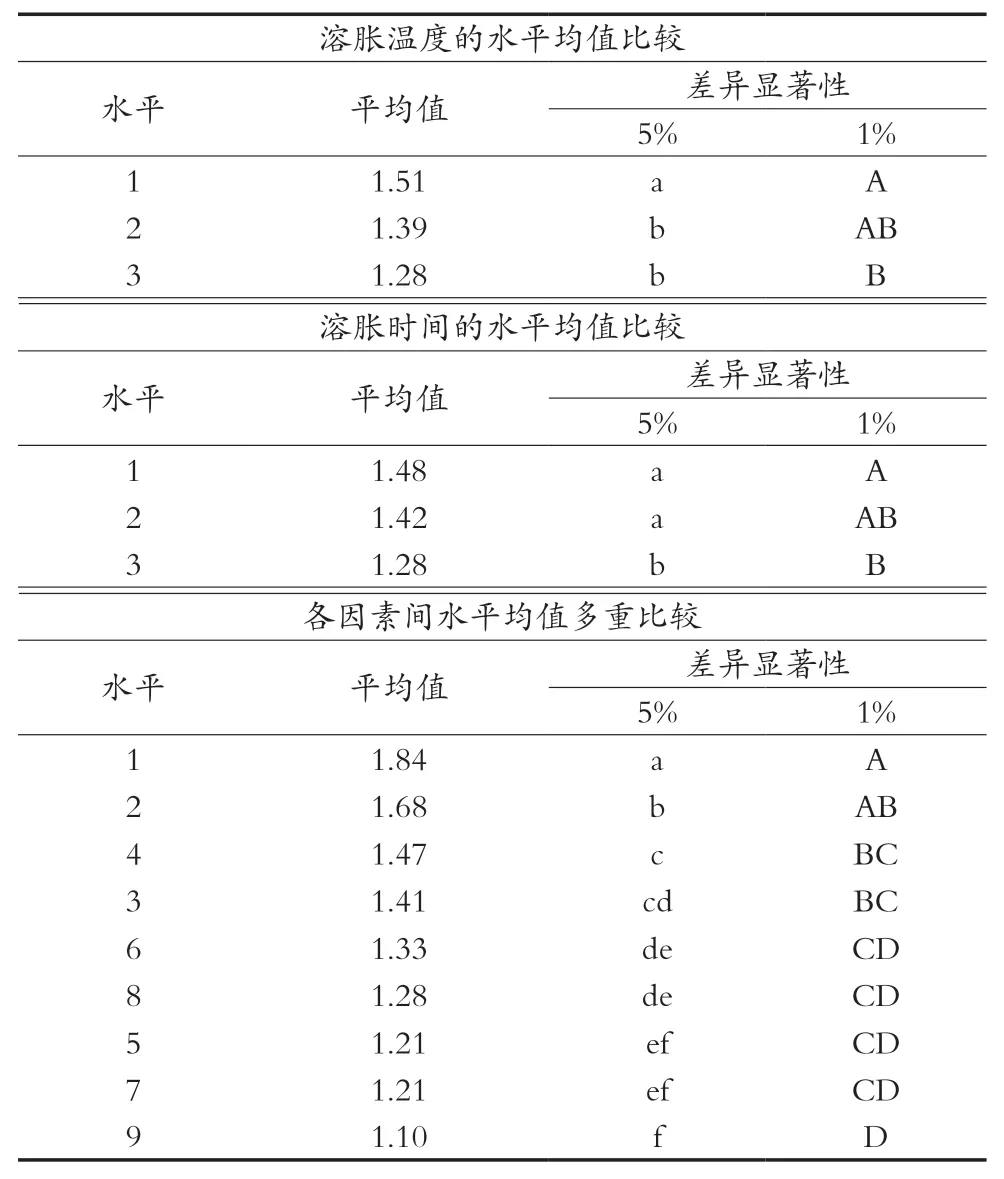
表4 各因素水平均值多重比较

表5 追加试验结果
由表5可知,魔芋精粉的溶胀度为A3B3C3<A3B3C2<A2B3C3<A2B3C2,由A3B3C3与A2B3C3,A2B3C2与A3B3C2相比,可以看出温度、溶胀时间相同,乙醇体积分数对魔芋精粉溶胀度的影响很大,由A3B3C3与A3B3C2,A2B3C3与A2B3C2相比,可以得出浓度、温度相同,溶胀时间对魔芋精粉溶胀度的影响很小。综合考虑成本、工作量及效率等诸多因素,A3B3C2最合适。
3 结论
(1)魔芋葡甘聚糖在水中、乙醇溶液中溶胀度有明显区别,在水中魔芋葡甘聚糖易溶于水,溶胀度较大且溶胀速度非常快。在乙醇溶液中魔芋葡甘聚糖有较小程度溶胀,其溶胀度随着乙醇体积分数增加而减少;20%的乙醇溶液在-10 ℃可明显抑制魔芋葡甘聚糖在水中溶胀行为。
(2)阻止魔芋精粉在加工时的溶胀,可以通过改变乙醇体积分数、溶胀温度、溶胀时间,从而来降低魔芋精粉的溶胀度。正交试验结果分析表明在试验条件范围内,对溶胀度影响的主次顺序为乙醇体积分数>溶胀温度>溶胀时间。分析表明乙醇体积分数对魔芋精粉溶胀有极显著影响,溶胀温度和溶胀时间有显著影响。综合考虑成本、工作量及效率等多方面的因素,阻止魔芋精粉溶胀的最适条件为乙醇体积分数15%、溶胀温度-10 ℃、溶胀时间3 min。
(3)魔芋葡甘聚糖在水中、乙醇溶液中溶胀度与魔芋葡甘聚糖凝胶体结构之间的关系等还有待进一步研究,试图从理论上揭示魔芋葡甘聚糖在水中、乙醇溶液中溶胀规律,为魔芋精粉的发展提供依据。

