肉牛DKK3 基因3'UTR 双荧光素酶报告质粒构建及与miR-25 的靶向验证
张 凤,陈明新
(湖北省农业科学院畜牧兽医研究所/动物胚胎工程及分子育种湖北省重点实验室,湖北武汉 430064)
Wnt 蛋白是一类分泌型糖蛋白,通过自分泌和旁分泌方式在细胞增殖、分化、凋亡、迁移等过程中发挥作用,是一种重要的信号调节分子。按细胞内信号传递链的不同,Wnt 信号通路又主要分为3 个分支:Wnt/-catenin通路、Wnt/Ca通路和Wnt/polarity 通路,其中Wnt/-catenin 通路是经典的Wnt 信号通路。Prestwich等研究发现Wnt/-catenin 信号通路是脂肪生成的开关,在脂肪细胞成脂分化过程中起关键的负调控作用。DKK3(Dickkopf-3)是属于DKK 蛋白家族的一种分泌型糖蛋白,通过调节Wnt 信号转导途径发挥作用,是Wnt/-catenin 信号通路的抑制剂。Xie 等研究发现,在非酒精性脂肪肝患者和肥胖小鼠的肝脏组织中以及体外培养的经棕榈酸刺激的肝脏细胞中,的表达量都显著降低;此外,通过在肝脏细胞中过表达和抑制表达,证实可能通过抑制活性阻碍下游p38/JNK 通路激活的方式抑制肥胖、胰岛素抵抗和肝脏脂肪变性。郭进磊研究显示基因多态性与中国黄牛品种之一南阳牛的经济性状之间存在显著关联,提示基因可能影响肉牛的脂肪发育。
microRNAs(miRNAs)是一类内源性的长度为22 nt左右的单链非编码RNA 小分子,是非编码RNA 家族成员之一。尽管miRNAs 种类不同,但它们在生物系统中发挥功能的机制基本一致,通常表现为结合到靶基因3'非编码区(3'UTR),抑制靶基因翻译或降解靶mRNA,从而降低靶基因的表达水平,影响基因发挥应有的功能。成千上万的miRNAs 已被确认参与诸多生物学过程,比如细胞增殖、分化、发育和新陈代谢等,故而miRNAs 对靶基因的调控研究是非常值得关注的领域。本课题前期研究发现,miR-25-3p 可显著降低小鼠C2C12 细胞内甘油三酯含量;此外,miR-25-3p 也可靶向肉牛基因3'UTR,而基因可显著提高肉牛肌内前脂肪细胞脂肪生成。另有文献报道,miR-25-3p 可通过靶向抑制DKK3 而激活Smad3 和纤维化相关基因的表达以增强心脏纤维化;miR-25-3p 也可通过靶向DKK3 促进胶质瘤细胞的增殖和迁移。但miR-25-3p 是否靶向牛基因还未可知。
本实验拟利用生物信息学软件预测bta-miR-25 的靶基因是否包含基因,并初步划定bta-miR-25与肉牛的结合位点位置;通过构建双荧光素酶报告基因质粒,测定双荧光素酶活性试验验证结合位点的可靠性;牛肾细胞(MDBK)中过表达和抑制表达miR-25,研究miR-25 对基因表达的影响。通过上述工作,明确miR-25 对肉牛基因的靶向调控作用,为今后进一步开展miR-25 调控肉牛肌内脂肪生成的分子机制研究奠定基础。
1 材料与方法
1.1 实验材料 MDBK 细胞购自中国科学院典型培养物保藏委员会武大细胞库;Taq PCR Mix 购自Thermo FisherScientific 公司;限制性内切酶I 和I、T4 DNA 连接酶购自NEB 公司;大肠杆菌()DH5购自TransGen 公司;反转录试剂盒购自TaKaRa公司;胶回收试剂盒(Gel Extraction kit)和无内毒素小量质粒提取试剂盒II(E.Z.N.A.Endo-Free Plasmid Mini Kit II)购自Omega 公司;Lipofectamine2000购自Invitrogen 公司;荧光染料SYBRGreen I 购自Bio-Rad 公司;Dual-LuciferaseReporter Assay System和pmirGLO Vector 购自Promega 公司;DMEM/F-12 1:1培养基、PBS 购自Hyclone 公司;Opti-MEM 购自Gibco;引物由武汉奥科生物技术有限公司合成;miRNA mimics/inhibitor 由广州市锐博生物科技有限公司合成。
1.2 实验方法
1.2.1 生物信息学分析 从生物信息学数据库miRBase(http://www.mirbase.org/)中获取miR-25 的参考序列。利用TargetScan(http://www.targetscan.org/vert_71/)预测bta-miRNA-25 的靶基因,分析是否包含基因并预测bta-miR-25 与基因之间潜在的结合位点。从NCBI 数据库(https://www.ncbi.nlm.nih.gov/)获取肉牛基因3'UTR 序列。
1.2.2 DKK3-3'UTR 片段扩增 采用Primer 5.0 软件设计包含bta-miR-25 结合位点的DKK3 3'UTR 区扩增引物,并分别在上、下游引物加入I、I 酶切位点及保护碱基。引物序列为:DKK3-3'UTR-F:5'-GTTTA AACGGAGCCTGTCAGTGGAG-3';DKK3-3'UTR-R:5'-CTCGAGGTTTAGCAGCCCTGTTCT-3',预期扩增片段大小为321 bp。其中,斜体为保护碱基,下划线为酶切位点,正向引物为I 的酶切位点,反向引物为I 的酶切位点。以MDBK cDNA 为模板,PCR 扩增合成DKK3 3'UTR 序列片段,PCR 扩增体系为25 μL:上下游引物(10 uM/L)各 0.5 μL,Taq PCR Mix 12.5 μL,cDNA(100 ng/μL)1 μL,补充ddHO 10.5 μL。反应程序:95 ℃预变性4 min;95 ℃变性40 s,60 ℃退火45 s,72℃延伸15 s,32 个循环;72℃延伸10 min;25℃保存2 min。反应结束后将PCR 产物进行琼脂糖凝胶电泳,对目的片段进行切割,利用胶回收试剂盒进行回收纯化,具体操作步骤见产品说明书。
1.2.3 pmirGLO-DKK3-3'UTR 双荧光素酶报告质粒构建 将纯化后回收的3'UTR 扩增产物及pmirGLO Vector 质粒经I 和I 双酶切。反应体系为:I、I 各 1 μL,10×FastDigest Green Buffer 1.5 μL,回收产物约0.2 μg 或质粒约1 μg,补充ddHO 至20 μL或30 μL,37℃酶切2~3 h。酶切结束后再次进行琼脂糖凝胶电泳、胶回收、纯化,将回收的目的片段与载体片段用T4 连接酶按如下体系进行连接:目的片段7 μL,载体片段1 μL,T4 连接酶1 μL,10×Buffer 1 μL。16℃过夜连接后转化到大肠杆菌DH5中,12 h 后挑阳性菌扩大培养并克隆检测,检测再次为阳性的菌液送去测序。测序正确后去内毒素提取质粒,经双酶切鉴定成功后置于-20℃保存备用。
1.2.4 DKK3 突变型质粒构建 以1.2.3 中构建的野生型载体质粒为模板,采用融合PCR 方法将预测的btamiR-25 结合位点进行突变,所用引物序列为:DKK3-3'UTR-F:5'-GTTTAAACGGAGCCTGTCAGTGGA G-3';DKK3-3'UTR-R:5'-CTCGAGGTTTAGCA GCCCTGTTCT-3';DKK3-mut-F:5'-TTGTGTGGGT AGATagatccTAGAAGTAGCTAAT-3';DKK3-mut-R:5'-ATTAGCTACTTCTAggatctATCTACCCACACAA-3'。其中小写字母为突变后碱基。具体步骤为:以DKK3-3'UTR-F 和mut1-R 为引物PCR 扩增出mut(上)片段,以mut-F 和DKK3-3'UTR-R 为引物PCR 扩增出mut(下)片段,将片段mut(上)和mut(下)“搭桥”后再次进行PCR 扩增。“搭桥”体系为:mut(上)1 μL;mut(下)1 μL;Taq PCR Mix12.5 μL;ddHO10.5 μL。“搭桥”程序为:95℃ 5 min;95℃ 30 s,40℃ 30 s,45℃ 5s,50℃ 5 s,55℃ 5 s,60℃ 5 s,72℃ 30 s,30个循环;72° C 5 min;25° C 5 min。之后以“搭桥”后的体系为模板,再分别以DKK3-3'UTR-F 和DKK3-3'UTR-R 为上下游引物,再进行常规PCR 扩增,扩增产物经琼脂糖凝胶电泳回收、双酶切、连接pmirGLO Vector 载体等之后一系列的分子克隆技术同上述野生型载体质粒构建方法,最终构建的载体称之为突变型载体。
1.2.5 DKK3 删除型质粒构建 所用的引物序列为:DKK3-3'UTR-F 5'-GTTTAAACGGAGCCTGTCAGTGGAG-3';DKK3-3'UTR-R 5'-CTCGAGGTTTAGCAGCC CTGTTCT-3';DKK3-del-F 5'-TTGTGTGGGTAGATTA GAAGTAGCTAAT-3';DKK3-del-R 5'-ATTAGCTACTT CTAATCTACCCACACAA-3',其余同1.2.4 突变型载体质粒构建。
1.2.6 细胞转染及双荧光素酶活性测定 MDBK 细胞接种至48 孔细胞板中,待细胞长至80℃时进行转染。每孔加0.1 μg 质粒和1 μLmiR-25mimics 于25 μL opti-MEM中稀释,1 μL Lipofectamine 2000 于25 μLopti-MEM 中稀释,5 min 后将两部分混合,室温静置10~15 min 后一滴一滴地加入到细胞培养板中。对照组是以同样的方法将mimics NC(阴性对照)替代miR-25mimics。转染24 h 后利用1×PLB(Passive lysis buffer)裂解细胞并收集细胞裂解液,测定双荧光素酶活性。利用Dual-Reporter Assay System 在多功能酶标仪中检测荧光载体质粒的相对荧光活性:吸取10 μL 细胞裂解液加入酶标板中,首先加入50 μL 的LARII 读取样品中荧火虫荧光素酶的活性值A,再加入50 μL 的Stop&Glo Reagent读取样品中海肾荧光素酶的活性值B,A/B 比值即代表该荧光载体的活性。
1.2.7 荧光定量PCR 和Western blot MDBK 细胞接种至12 孔细胞板中,待细胞长至80% 时分别将miR-25 mimics、mimics NC、miR-25 inhibitor、inhibitorNC转染至细胞中,48 h 后提取细胞总RNA 和总蛋白。总RNA 反转录成cDNA,以cDNA 为模板,进行相对荧光定量PCR,引物序列见表1。总蛋白用于Western blot 检测基因的蛋白表达量。

表1 荧光定量PCR 扩增引物序列
1.2.8 统计学分析 实验结果以均值±标准差表示,两组数据之间进行t-test;多组数据先进行单因素方差分析,两两之间再进行t-test。
2 结果与分析
2.1 生物信息学分析 从miRBase 数据库中获取miR-25序列为CAUUGCACUUGUCUCGGUCUGA。通过在线生物信息学软件TargetScan 分析肉牛miR-25 的靶基因,预测其潜在靶基因共944 个,包括1 066 个保守位点和170个低保守位点;其中,基因3'UTR 的25~32 bp处存在一个潜在的miR-25 结合位点(图1),据此推测基因可能是bta-miR-25 的一个靶基因。

图1 bta-miR-25 与DKK3 3'UTR 结合位点预测
2.2基因3'UTR 双荧光素酶报告基因质粒构建利用常规PCR、融合PCR、双酶切、回收纯化、连接等过程分别构建了野生型(wt)、突变型(mut)及删除型(del)双荧光素酶报告载体,结构示意图如图2所示。构建的3 种报告基因质粒经I 和I 双酶切,琼脂糖凝胶电泳结果显示释放出与预期大小相符的片段(图3),结合测序结果表明质粒构建成功。

图2 bta-miR-25 结合位点突变及删除结构示意图

图3 野生型、突变型及删除型双荧光素酶质粒双酶切鉴定结果
2.3 双荧光素酶活性检测 将野生型(wt)、突变型(mut)及删除型(del)双荧光酶报告基因质粒分别与miR-25 mimics 共转染MDBK 细胞,mimics NC 作为对照。24 h后裂解细胞,取细胞裂解液测定双荧光素酶活性。结果显示,将潜在的miR-25 结合位点突变或删除后质粒的双荧光素酶活性都显著上升(图4);与对照组NC 相比,miR-25 mimics 超显著地抑制了野生型质粒的荧光活性,位点突变后抑制作用减弱,而位点删除后抑制作用完全消失(图5)。
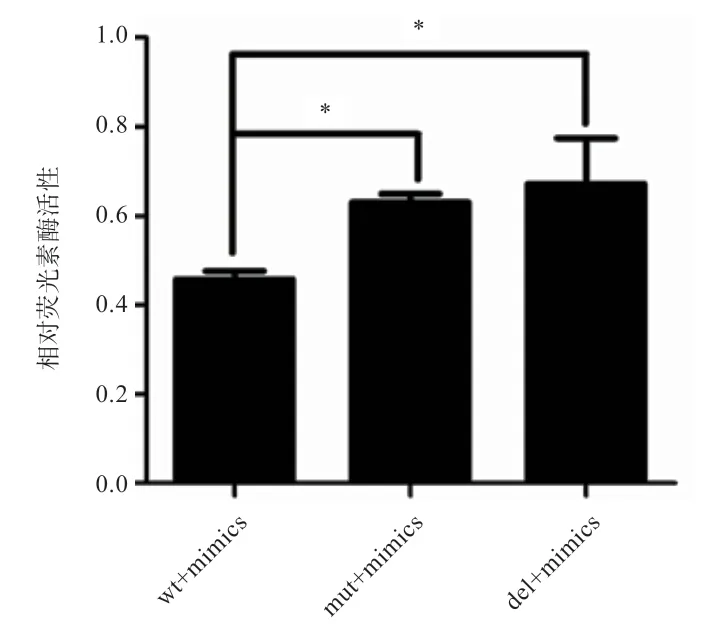
图4 miR-25 mimics 对3 种载体质粒双荧光素酶活性检测结果
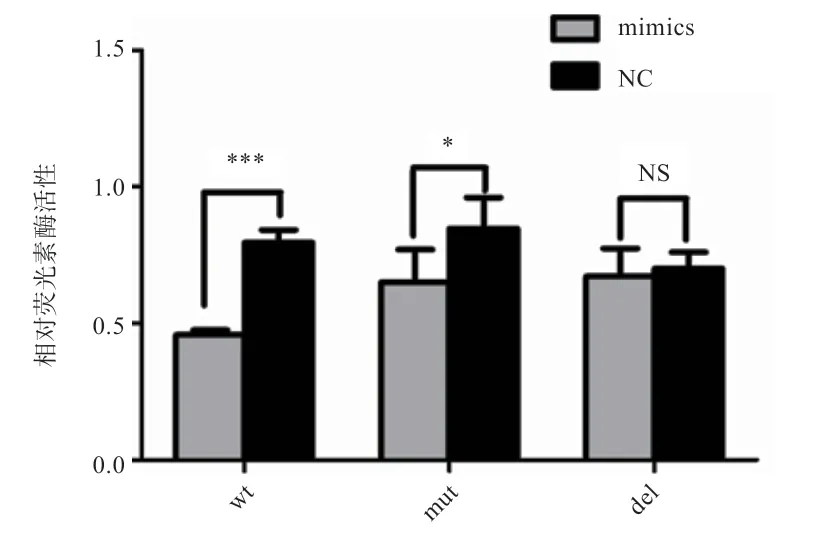
图5 miR-25 mimics 及mimics NC 对3 种载体质粒双荧光素酶活性检测结果
2.4 miR-25 对DKK3 表达量的影响 将miR-25 mimics、mimics NC、miR-25 inhibitor、inhibitor NC 分别转染MDBK 细胞,24 h 后提取细胞总RNA,首先利用荧光定量PCR 检测miR-25 的表达量,评估mimics 及inhibitor 的效果,结果如图6 所示。与mimics NC 相比,miR-25 mimics极显著提高了miR-25的表达量;与inhibitor NC 相比,miR-25 inhibitor 显著降低了miR-25 的表达量,表明miR-25 mimics、inhibitor 能达到预期效果,可用于后续研究。的mRNA 表达量如图7 所示,miR-25 mimics 显著抑制了的表达,但抑制miR-25 后的表达量显著上升。Western blot 结果与之相同(图8)。
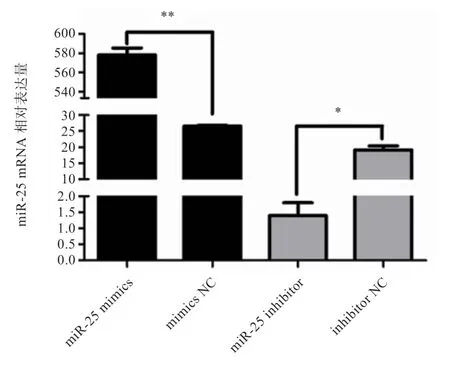
图6 miR-25 mRNA 相对表达量检测结果
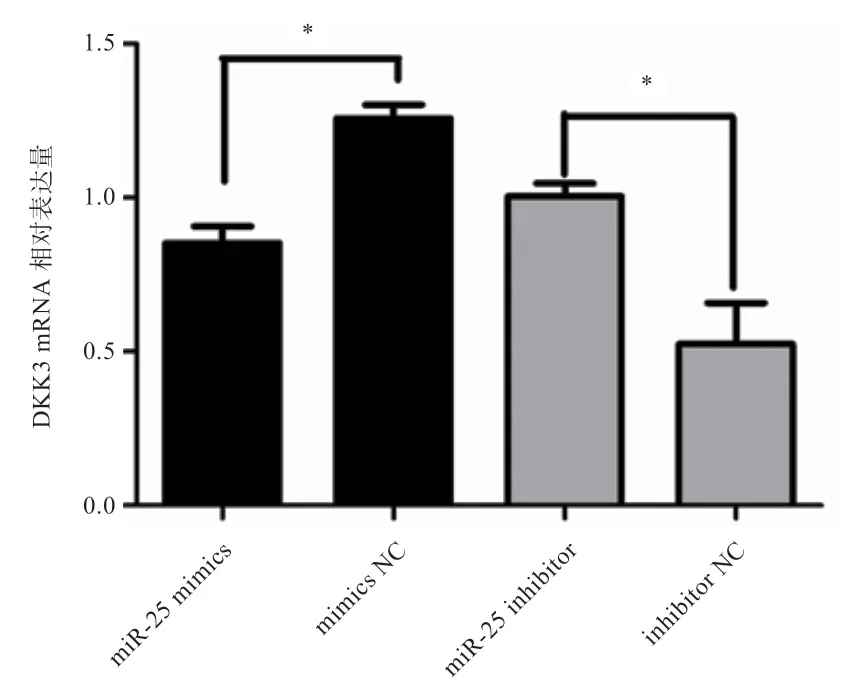
图7 DKK3 基因mRNA 相对表达量检测结果
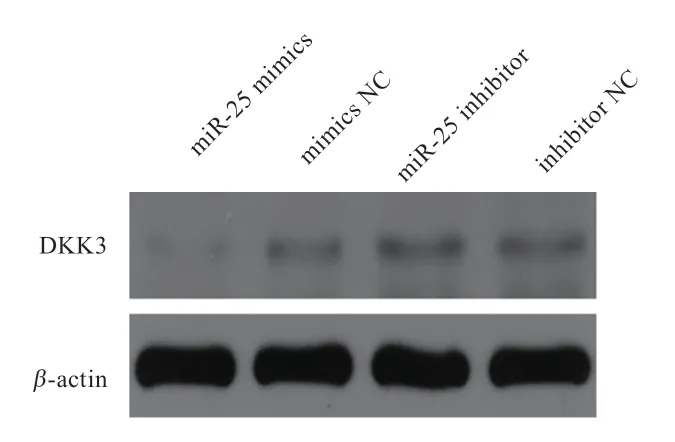
图8 DKK3 基因蛋白表达量检测结果
3 讨论
miR-25 是miR-106b-25 簇的一员,已有研究表明miR-25 在脂肪生成过程中具有一定的调控作用。Ma 等研究表明miR-25 可通过抑制调节山羊乳腺上皮细胞甘油三酯和脂质积累;Liang 等研究发现miR-25 可靶向和基因抑制小鼠前脂肪细胞的脂肪生成;miRNA 测序及组织表达谱分析结果显示,miR-25 在秦川牛背部脂肪组织中高表达,对miR-25 的靶基因进行GO 分析,结果显示上百个靶基因富集到与脂肪形成或脂滴沉积相关的通路。课题前期研究结果显示,miR-25-3p 可显著降低小鼠C2C12细胞内甘油三酯的含量;miR-25-3p 也可靶向肉牛基因3'UTR,而基因可显著提高肉牛肌内前脂肪细胞脂肪生成。据此推测,miR-25 可能参与调控肉牛肌内脂肪生成,且表现为抑制作用。
DKK3 是Wnt/-catenin 信号通路的抑制剂,具有调控组织细胞发育、增殖、凋亡、代谢和免疫反应等多种生物学功能,在心脏疾病、肿瘤发生、免疫调节、神经发生和代谢疾病等方面有诸多研究。在脂肪发育方面的研究较少,迄今仅有一项研究报道基因多态性与南阳牛经济性状之间存在显著关联,提示基因可能影响肉牛的脂肪发育。高等生物基因的表达受细胞内外环境的精细调控,具有严格的时间及空间有序性。基因的表达调控是一个复杂有序的过程,由多阶段调控水平共同完成,主要包括转录前、转录、转录后、翻译、翻译后5 个水平。miRNAs 具有降解靶mRNA 和抑制靶基因翻译的作用,在转录后或翻译水平调控基因的表达。
本实验通过生物信息学分析软件TargetScan 预测到基因3'UTR 存在一个miR-25 的结合位点,推测可能是miR-25 的靶基因。为了验证上述假设,开展了下述一系列工作:构建包含miR-25 结合位点的3'UTR 野生型双荧光素酶报告基因质粒,并通过融合PCR 将结合位点突变、删除构建突变型和删除型双荧光素酶报告基因质粒;将构建的3 种质粒分别与miR-25 mimics 和mimics NC 共转染MDBK 细胞,测定双荧光素酶活性,结果证实miR-25 可通过预测到的结合位点与基因靶向结合。为进一步研究miR-25 对表达量的影响,将miR-25 mimics、mimics NC、miR-25 inhibitor、inhibitor NC 分别转染MDBK 细胞,荧光定量PCR 和Western blot 检测的表达量,结果显示miR-25 mimics 显著抑制的表达,而抑制miR-25 后的表达量显著上升,表明miR-25 对基因发挥抑制作用。
4 结论
本实验通过生物信息学分析软件预测可能是miR-25 的靶基因,通过构建3'UTR 双荧光素酶报告基因质粒、细胞共转染、测定双荧光素酶活性、荧光定量PCR 及Western blot 验证了miR-25 与肉牛基因之间的靶向关系,为今后进一步开展miR-25 调控肉牛肌内脂肪生成的分子机制研究奠定基础。
——一道江苏高考题的奥秘解读和拓展

