CT增强动脉晚期扫描技术对原发性肝癌介入术后残癌的诊断价值探讨
彭 川,罗 威,钟能枝
(中山大学肿瘤防治中心影像科 广东 广州 510060)
原发性肝癌(primary carcinoma of liver,PHC)是我国高发的消化系统恶性肿瘤,起病隐匿,早期症状不明显,大多数患者确诊时已处于中晚期,手术切除机会小,预后差,死亡率高[1]。经肝动脉化疗栓塞术(transhepatic artery chemoembolization,TACE)是中晚期PHC首选治疗方法,能够直接阻塞肿瘤供血动脉,灌注化疗药物,有助于提高肿瘤抑制力,延长生存时间,改善生活质量[2-3]。但TACE不能完全根除肿瘤,部分患者术后仍有残瘤存在,因此,如何准确评估TACE术后疗效,对制定后续治疗方案、判断预后等至关重要。影像学检查是判断PHC患者TACE术后残癌的主要方法,CT平扫能够评估肝内碘油沉积情况、观察肿瘤大小及形态等,而增强CT扫描的组织对比度更高,能够明确肿瘤血供,判断局部肿瘤病灶有无残留以及肿瘤病灶的活性,特别对门静脉内癌栓的显示效果好[4-5]。而MRI检查虽然对组织密度的分辨率高,可根据动脉周期性变化呈现强弱信号,对<5 cm的肿瘤病灶诊断灵敏度、特异度高于CT诊断,但MRI对门静脉内癌栓的检查效果不及CT增强扫描[6-7]。本文选取2018年1月—2020年12月在中山大学肿瘤防治中心治疗的60例原发性肝癌介入术后患者的临床资料,进一步分析CT增强动脉晚期扫描技术对PHC在TACE术后残癌的诊断价值,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月—2020年12月在中山大学肿瘤防治中心治疗的60例PHC介入术后患者的临床资料。60例患者中男38例,女22例;年龄39~68岁,平均年龄(56.88±2.74)岁;病灶直径为5~13 cm,平均(8.03±0.76)cm;病灶数量为1~4个,平均(2.02±0.29)个。纳入标准:①患者均有腹部钝痛、肝区不适、腹部包块、食欲下降、乏力等临床症状;②均行病理活检证实为PHC者;③病理分期在Ⅲ~Ⅳ期;④均使用TACE治疗,术后均复查CT,评估有无残癌;⑤入院时病理资料完整,能够配合本研究者;⑥患者及家属均知情并签署知情同意书。排除标准:①合并其他恶性肿瘤者;②有TACE治疗禁忌者;③存在呼吸或循环系统功能障碍者;④合并精神疾病或意识障碍者。
1.2 方法
所有患者均使用TACE治疗,局部麻醉,经股动脉行改良Seldinger穿刺,进入肿瘤所在血管,造影后评估肝脏的肿瘤数目、大小等,明确各个病灶的主要供血动脉;经肝动脉注入化疗栓塞药物,完成化疗栓塞,具体剂量视肿瘤大小而定,直至完全将肿瘤填充为宜。
CT检查:患者术前禁食12 h,检查前10~20 min饮用温水600~1 000 mL,采用GE HD750宝石能谱CT,患者取平卧位,先行常平扫,患者深吸气下屏气,一次性完成全肝扫描,扫描参数:层厚及层距均为5 mm,螺距1,管电压120 kV,管电流150~250 mAs,重建矩阵512×512;了解全肝情况、观察病灶及与周围组织的关系。之后行增强扫描,采用CT高压专用注射器,经上肢肘静脉注射碘海醇(320 mgI/mL),流速2.5~3 mL/s,剂量60~80mL,注药38 s、60 s、180 s后进行连续扫描肝动脉期、门静脉期、延时期;扫描结束后,将原始轴位图像经薄层处理,获得病灶部位的多平面重建(multiplanar reconstruction,MPR)和曲面重建(surface reconstruction,CPR)图像,由影像学科两名临床经验在5年以上的医师通过双盲法进行独立诊断,观察TACE术后有无残留动脉期强化区。
残癌诊断方法:在CT检查1周内由专科医生综合诊断作为残癌诊断的金标准。
1.3 评价标准及观察指标
肿瘤残留强化5分制评价标准:无肿瘤残留强化为1分;可能没有肿瘤残留强化为2分;不确定是否有肿瘤残留强化为3分;可能存在肿瘤残留强化为4分;存在肿瘤残留强化为5分。
统计两组检查结果与专科医生综合诊断结果;统计对TACE术后残癌的诊断效能,计算诊断灵敏度、特异度、准确性、漏诊率、误诊率、阳性预测值、阴性预测值;评估两组肿瘤残留强化分值,记录4~5分病灶的最短径、最长径。
1.4 统计学方法
采用SPSS 21.0统计软件进行数据处理。计量资料以均数±标准差()表示,采用t检验;计数资料以频数(n)、百分比(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两种方法诊断结果与专科医生综合诊断结果对照
专科医生综合诊断结果显示,阳性37例,阴性23例;CT增强扫描结果显示,阳性34例(真阳性32例,假阳性2例),阴性26例(真阴性21例,假阴性5例);CT平扫结果显示,阳性35例(真阳性27例,假阳性8例),阴性25例(真阴性15例,假阴性10例),见表1。
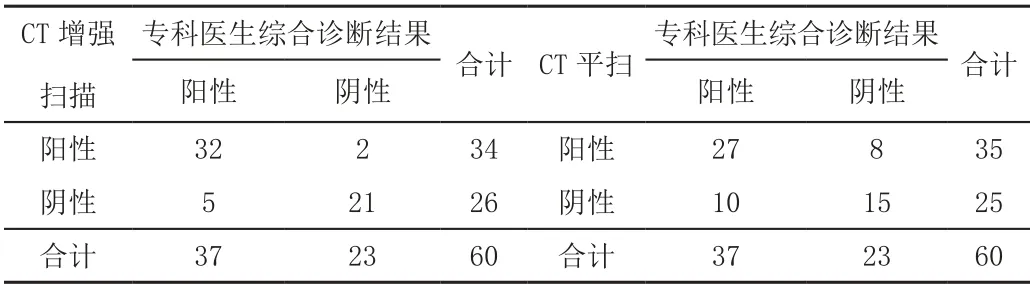
表1 两种方法诊断结果与专科医生综合诊断结果对照 单位:例
2.2 两种方法对TACE术后残癌的诊断效能比较
CT增强扫描诊断的灵敏度、特异度、准确性、阳性预测值、阴性预测值均显著高于CT平扫,漏诊率、误诊率显著低于CT平扫(P<0.05),见表2。
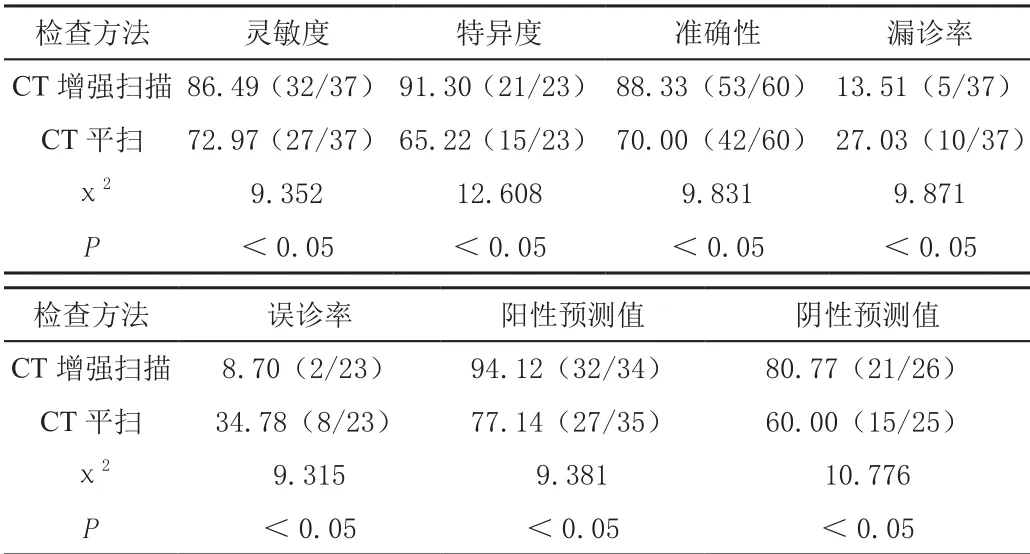
表2 两种方法对TACE术后残癌的诊断效能比较[%(n/m)]
2.3 两种检查方法的肿瘤残留强化评分及肿瘤残留的最长径、最短径笔记比较
CT增强扫描肿瘤残留强化评分显著高于CT平扫,肿瘤残留的最长径、最短径显著长于CT平扫(P<0.05),见表3。
表3 两种检查方法的肿瘤残留强化评分及肿瘤残留的最长径、最短径笔记比较(±s)

表3 两种检查方法的肿瘤残留强化评分及肿瘤残留的最长径、最短径笔记比较(±s)
检查方法 肿瘤残留强化评分/分 肿瘤残留最长径/cm 最短径/cm CT增强扫描 4.10±0.37 3.42±0.13 1.10±0.54 CT平扫 3.02±0.46 3.01±0.14 0.79±0.38 t 3.098 3.041 3.032 P<0.05 <0.05 <0.05
3 讨论
PHC的发病机制复杂,早期症状不明显,诊断较为困难,大多数患者待出现症状后已发展至中晚期,病情进展迅速,预后差。目前,TACE是中晚期PHC的治疗方法,能明显提升治疗效果,延长生存时间,对改善预后有一定帮助[8-9]。TACE具有创伤小、操作简便、可重复性好等优点,通过灌注化疗药物,阻塞肿瘤供血血管,达到抑制肿瘤生长的目的[10]。但TACE不能完全根治肿瘤,术后仍可能存在残癌,需要临床及时诊断并评估,不断优化治疗方案。
临床可供选择的影像学检查手段较多,常规B超检查分辨率较低,对微小或隐匿病灶容易发生漏诊,且B超医师的检查经验及操作技能水平均对检查结果有一定影响,整体的诊断效果一般[11]。MRI是PHC诊断的有效手段,具有组织分辨率高、无辐射等优点,可根据动脉周期性变化呈现出不同的信号强弱变化,特别对于直径<3 cm的肿瘤病灶诊断效果优于CT检查[12]。但MRI也有一定缺点,其价格较高,且对于门静脉内癌栓的检出率不及CT,也存在一定漏诊率[13]。CT是诊断PHC患者TACE术后有无残癌的重要影像学手段,常规CT平扫可显示出肝脏及肿瘤的形态特点,但对比度相对较低,对肿瘤病灶的大小、与周围组织关系、血供等显示效果一般[14]。增强CT扫描通过肘静脉注入对比剂,能小范围重点检查肝脏肿瘤病灶情况,组织对比度更高,能清晰显示TACE术后有无残癌以及残癌的大小、数目、血供等情况,特别能显示有无门静脉受累,观察门静脉内癌栓情况,这点明显优于MRI[15]。同时CT拥有图像重建技术,可根据病灶具体情况选择不同角度进行重建,全面评估残癌情况[16]。考虑到TACE阻断了肝脏正常血供,导致术后残癌的血供较差,扫描时在常规动脉期25~30 s后延迟15 s左右再扫描,可通过侧支血管的造影剂对比来显示病灶,从而提升了残癌诊断效果[17-18]。
本文结果显示,CT增强扫描诊断的灵敏度、特异度、准确性、阳性预测值、阴性预测值均显著高于CT平扫,漏诊率、误诊率明显低于CT平扫(P<0.05);CT增强扫描的肿瘤残留强化评分显著高于CT平扫,肿瘤残留的最长径、最短径显著长于CT平扫检查(P<0.05)。充分证明动脉晚期增强CT扫描能有效提高对PHC患者TACE术后残癌的诊断效果,显像清晰,肿瘤病灶与周围组织的对比度高,具有较高的诊断灵敏度、特异度和准确性,能准确测定肿瘤残留病灶大小,为临床评估TACE疗效及确定后续治疗方案提供了可靠依据,同时也为临床判断预后提供了参考。
综上所述,CT增强动脉晚期扫描技术对PHC行TACE术后残癌的诊断价值确切,明显提高了残癌检出率,为临床制定后续治疗方案、评估预后提供了有利依据,值得推广使用。

