呼吸道微生物区系与牛呼吸道疾病综合征发生的关系
曹兆立,徐正中,陈 祥,焦新安
(扬州大学江苏省人兽共患病学重点实验室//扬州大学江苏省动物重要疫病与人兽共患病防控协同创新中心/扬州大学农业农村部农产品质量安全生物性危害因子(动物源)控制重点实验室,江苏扬州225009)
牛呼吸道疾病综合征(Bovine respiratory disease complex,BRDC)又称运输热(Shipping fever),是肉牛养殖业中最常见也是造成经济损失最大的疾病之一,每年造成超过10亿美元的损失[1-2]。作为一种复杂的多因素疾病,BRDC危害严重,肉牛发病率可达75%,病死率可达50%,是引起美国养牛场肉牛死亡的主要原因[3]。尽管新超声检查技术的出现或许可以降低BRDC诊断难度,但总体而言,该病诊断较为困难,常常导致病牛无法被及时隔离和治疗[4]。12.8%的牛接受了针对BRDC治疗[5],每头牛治疗费用高达数百美元[6],可仍有0.8%的牛死于BRDC,并且治疗还引发耐药性扩散、药物残留等问题[7]。疫苗效果同样不佳,有学者评价牛嗜血杆菌(Hemophilusbovis)、溶血曼海姆氏菌(Mannheimiahaemolytica)和多杀性巴氏杆菌(Pasteurellamuliocida)疫苗接种肉牛后的效果,发现作用甚微[8]。即使到了采取现代化的饲养方式和预防控制措施的今天,BRDC的临床影响仍在继续。
BRDC的发病机制较为复杂,包括环境应激如集约化养殖、极端天气、长途运输、断奶、阉割与断角等,病原体如溶血性曼氏弧菌(Vibriomansonihaemolyticus)、多杀性巴氏杆菌(Pasteurellamultocida)昏睡嗜血杆菌(Histophilussomni)、化脓隐秘杆菌(Arcanobateriumpyogenes)等细菌,牛疱疹病毒(Bovine herpes virus 1,BHV1)、牛副流感病毒3型(Bovine parainfluenza type 3 virus,BPI3V)、牛病毒性腹泻病毒(Bovine viral diarrhea viruses,BVDV)、牛呼吸道合胞体病毒(Bovine respiratory syncytial virus,BRSV)、牛冠状病毒(Bovine coronavirus,BCoV)等病毒,以及牛支原体(Mycoplasmabovis)等支原体,以及一些其他因素,包括年龄与体重、性别、抗菌药使用和品种等。简而言之,多种易感因素,如环境应激、动物自身状态、抗菌药物使用等影响了宿主对于BRDC的易感性[9-10],最终导致疾病的发生(图1)。作为家畜的第一道防线,呼吸道黏膜启动了多种天然和获得性免疫机制从而防止细菌黏附[11],但病原体的感染可干扰这一过程。牛呼吸道合胞体病毒感染可导致上皮细胞坏死,使得黏膜清除率降低,呼吸道积聚的液体增多,为细菌定植提供了适宜环境[12];牛冠状病毒通过上调牛呼吸道上皮细胞受体的表达来增强细菌黏附。应激原会增加血液皮质醇浓度,进而削弱宿主防御,减少了对上呼吸道中病原体的控制[13]。
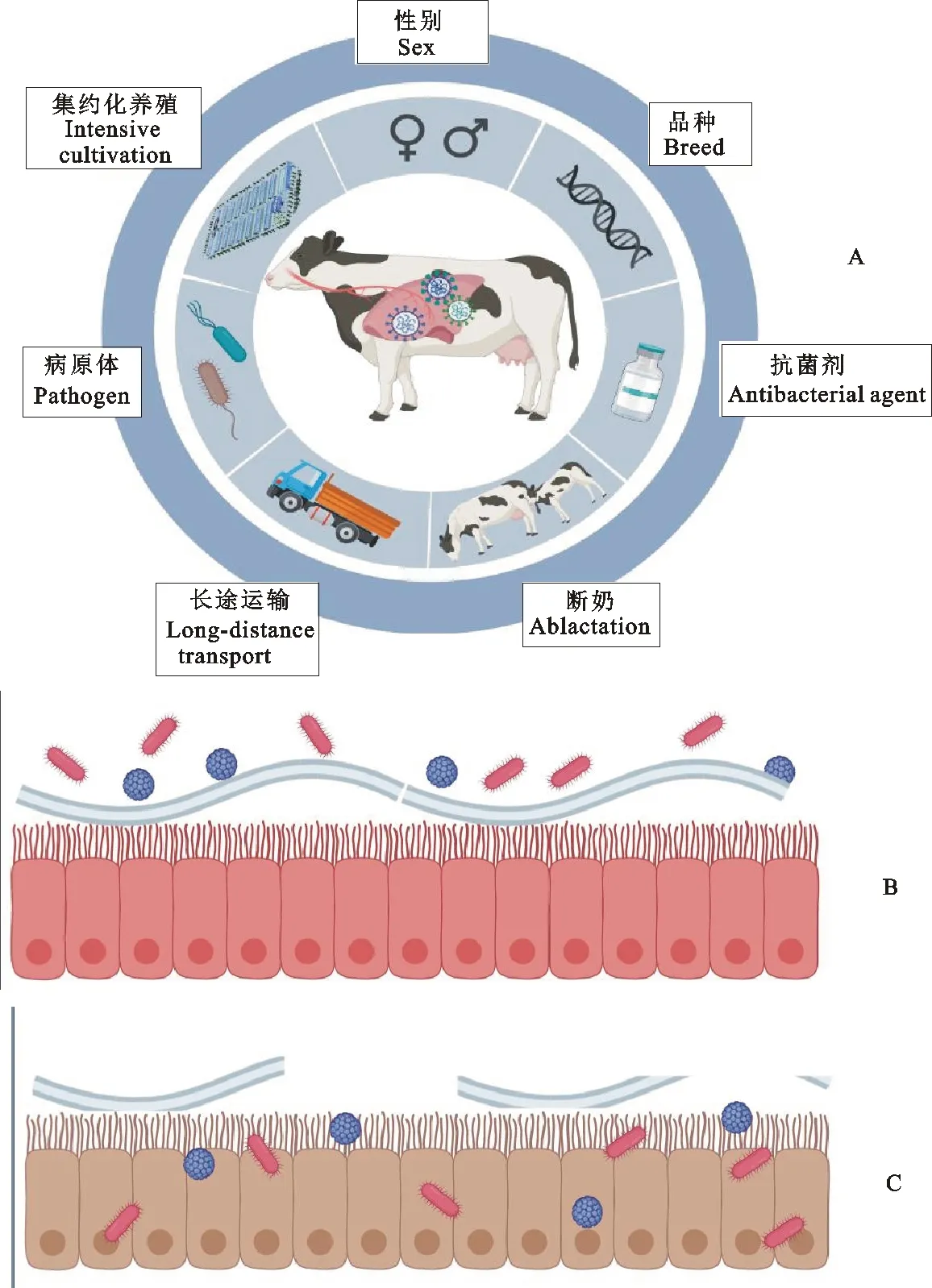
健康状态下,呼吸道微生物区系保持动态平衡,黏膜屏障功能完好。当动物受多种易感因素影响,呼吸道黏膜屏障功能丧失,导致了病原体的黏附、定植,微生物区系失调,进入疾病状态
黏膜微生物区系对于黏膜健康有着重要意义,但研究对象主要集中在消化道与生殖道黏膜。自2011年通过深度测序发现肺内存在细菌以来,呼吸道微生物区系的重要性便被逐渐发现[14]。新近的研究肯定了呼吸道黏膜微生物区系对牛的呼吸道健康的重要性,发现正常的黏膜微生物群可下调毒力因子的产生,对宿主起到一定保护作用[15],并且认为处于相对平衡状态的黏膜微生物区系可降低BRDC的发病率。本文对牛呼吸道微生物区系的研究现状及其在BRDC中的作用进行综述,为呼吸道感染和BRDC的防治提供一定的见解。目前对于病毒、噬菌体和真菌对呼吸道微生物区系的影响知之甚少,因此本文讨论主要限于细菌。
1 呼吸道微生物区系的发育及影响因素
传统观念认为羊水中不存在微生物,但随着检测技术的进步,研究发现羊水中存在细菌DNA[16],这意味着微生物区系在妊娠期便可逐步建立。人类的健康新生儿出生后的几个小时内便可在其上呼吸道中检测到微生物[17]。对猪而言,胎儿分娩后的微生物区系和母体相似,主要取决于分娩途径[18-19]。牛呼吸道微生物区系的形成同样发生于出生不久后,其变化受到多种内在、外在因素的影响,包括饮食、遗传、年龄等[20]。
断奶与其他环境应激因素的组合对犊牛呼吸道微生物组成影响最大,这与在实际生产中犊牛突然断奶并被运送至饲养场相对应。送至饲养场头2天内,犊牛鼻咽部微生物区系发生了显著变化。在系统发育多样性和丰富度方面都有所增加,在运送到饲养场之前的第0天,所有牛鼻咽部菌群共有76个运算分类单位(operational taxonomic unit,OUT),在第2天则达到292个OTU[21];另一个学者也得出了相似的结论,在属水平上,各时间点之间(断奶、到场、到场40 d后)的犊牛鼻咽部微生物区系特征发生了明显的变化,非参数多元方差分析表明时间是变异的重要来源[22]。呼吸道黏膜层含有抗菌肽、糖蛋白和IgA,在调节微生物区系平衡方面起着重要作用。当犊牛处于应激状态,黏膜分泌去甲肾上腺素和肾上腺素,与病原体相互作用并影响它们的生长和毒力相关因子的表达[23]。犊牛来到新环境易受呼吸道病毒感染,病毒感染后在呼吸道上皮细胞中复制,引起黏膜炎症,通过上调黏附受体、剥离上皮等方式促进病原菌的黏附和复制,还可以延长细菌脱落的持续时间[24],从而间接改变了微生物区系。
在生产周期中BRDC的易感期,采取对应的管理措施或许可通过改变犊牛鼻咽部微生物区系多样性,从而对呼吸道健康产生有利影响。在断奶早期,饮食改变可引起的肠道微生物区系的变化,对呼吸道微生物区系可能同样有影响。给断奶犊牛饲喂含硒苜蓿干草,犊牛鼻腔微生物区系更为丰富,拟杆菌目与梭菌目细菌数量增加[25]。益生菌可以调节微生物群落,常被用于治疗肠胃疾病,这一过程在犊牛上呼吸道中同样可以实现,可为BRDC的治疗提供了一种新的策略[26]。牛肠道微生物区系影响呼吸微生物区系的机制还没有完全阐明,但在其他物种中已有了较为详细的研究[27]。
抗菌药物的使用是预防和治疗呼吸道疾病的常用手段,使用克拉霉素和甲硝唑治疗患者,根据Bray-Curtis分析,患者的喉咙和粪便菌群与治疗前的组合物有很大差异,放线菌水平极低,并且一些影响可持续到4年后[28]。在儿童中,抗菌药物的使用降低了上呼吸道有益微生物区系的相对丰度,并增加了感染的发生率[29]。给饲养场的牛单次注射土霉素或图拉霉素,60 d后鼻咽部微生物区系OUT数量和香农指数减少[30]。犊牛鼻腔滴注一氧化氮释放液与静脉注射替米考星,第10天时其鼻咽微生物区系的组成发生了明显的变化[31]。
2 呼吸道微生物区系的组成
早在20世纪,就有学者通过分离培养的方法确认了部分与牛呼吸道疾病相关的细菌[32]。这些细菌主要从下呼吸道中分离,在健康牛与患病牛中均有发现,因此被认为是一种条件性致病菌。虽然高通量测序技术已有了长足发展,但时至今日,只有为数不多的研究报道了关于牛呼吸道微生物区系的组成。研究发现健康牛气管微生物区系以牛支原体、溶血曼海姆氏菌和多杀性巴氏杆菌为主,鼻咽部则主要由棒状杆菌属、Jeotgalicoccus、嗜冷杆菌属、游动球菌属组成[33]。Holman D B等[34]从门的角度观察,发现变形菌门与厚壁菌门占主导地位,放线菌门、拟杆菌门、软壁菌门所占比例较低。牛鼻咽微生物区系在门水平上与人类婴儿和猪的微生物区系相似[35-36]。就分类数量而言,牛鼻咽微生物区系非常的多样化,迄今已确定近500个独特的属,但区系易受单一属的支配,且大多数属的相对丰度较低(P<0.01%)。牛鼻咽部微生物区系在个体间表现出很大的变异性,且多数试验中试验对象数量较少,因此很难去描述何为“正常的微生物区系”。
多数对呼吸道黏膜微生物区系的研究将目光聚焦于上呼吸道,因为“健康的肺部无菌”这一观念广为流传,并且在一些教科书中出现[37]。但高通量测序技术的发展否定了这一观念,研究表明健康的下呼吸道包含复杂且多样化的微生物群落[26,38-39]。对在健康的饲养牛进行检测,发现上呼吸道中的细菌群落与下呼吸道中不同,这表明在不同生物地理位置存在不同的微生物群落[40]。相比于上呼吸道微生物区系,下呼吸道微生物区系占主导地位的细菌主要为巴氏杆菌属、拟杆菌属、曼海姆氏菌属与脲解支原体属,这与健康人类下呼吸道微生物区系类似[41]。成人口咽部是肺部微生物区系的主要来源,而新生儿肺部微生物区系的来源更可能是上呼吸道和口咽部[22]。
3 微生物区系在呼吸道健康中的作用
呼吸道微生物区系的组成、多样性和稳定性既可增加牛患BRDC的机率,也可保护牛免受呼吸道细菌病原体的侵袭与定植。
致病菌的存在显然会增加BRDC发生的机率。引起BRDC的主要微生物类群包括昏睡嗜血杆菌、溶血曼海姆氏菌、多杀性巴氏杆菌、化脓隐秘杆菌、牛支原体、牛鼻支原体(Mycoplasmabovirhinis)等[42],这些条件性致病菌在健康和患病的牛身上都很常见[43],在特定情况下于上呼吸道中增殖并侵入肺部。但这些细菌并非在所有牛身上都存在,普通牛群中溶血曼海姆氏菌的携带率可能在13%~20%之间,而在急性和致命性肺炎病例中,这一概率可高达85%~100%[44]。此外,与阴性的牛相比,到达饲养场时溶血曼海姆氏菌阳性的牛更有可能感染支气管肺炎[46]。这些数据表明,限制条件性致病菌的定植将减少牛呼吸道疾病的发生[47-48]。因此,目前减轻呼吸道疾病的管理策略旨在通过使用抗菌剂和疫苗接种计划来减少病原体[49]。然而,在畜牧业生产中预防性使用抗菌药物引起了公众和学者的关注。并且,由于存在病原体免疫抑制等原因,当前的疫苗也不能完全预防感染[1],因此寻找其他的防止方法是非常重要的。
与前文所述的机会性致病菌不同,呼吸道中一些特定共生菌对犊牛呼吸道健康有积极影响,可防止呼吸道病原体定植下呼吸道黏膜、抑制病原体生长等[16],也因此有了“呼吸益生菌”这一概念。进入饲养场时,鼻腔中乳酸杆菌科与芽孢杆菌科的成员丰度较高的犊牛发生BRDC的几率较小[12]。将健康牛与患有BRDC的牛气管微生物区系进行比较,健康牛具有更多的殊异支原体(Mycoplasmadispar),乳酸乳球菌(Lactococcuslactis),干酪乳杆菌(Lactobacilluscasei)[32。这一保护性过程可能是通过竞争效应、改善局部环境、激活抗菌分子的产生以及调节黏膜炎症来实现的[35]。就竞争效应来说,一些乳酸菌在牛支气管上皮细胞的黏附能力强于牛支原体[50];就改善微环境以及产生抗菌分子来说,人类口腔中的唾液链球菌可通过产生细菌素来抑制上呼吸道中致病性酿脓链球菌(Streptococcuspyogenes)的生长[51];就调节黏膜炎症来说,共生菌可增强对病原体的定植抵抗力,研究者发现共生唾液链球菌抑制了人支气管上皮细胞的炎症反应(即下调了NF-κB途径),促进了宿主微生物的稳态[52]。共生菌群还可通过激活炎症小体来调节呼吸道黏膜免疫力[53]。虽然缺乏直接的证据表明以上机制也发生在犊牛呼吸道中,但越来越的的相关研究已经在进行中。
多样化且稳定的微生物区系有助于抵抗病原体的侵袭[54]。儿童上呼吸道感染急性中耳炎相关病原菌与微生物区系多样性偏低相关[55];紊乱的微生物区系可导致人类婴儿更容易发生疾病[56]。比较了健康牛与患BRDC牛的呼吸道微生物区系差异,发现它们在类、属、门水平上存在显著差异,且患病牛的微生物区系多样性大都偏低,并在疾病易感期发生紊乱[16,29,34-35,57-58]。然而致病菌的过度生长本身就可影响微生物区系多样性及稳定性,因此并没有证据可说明微生物区系的稳定性与多样性与BRDC直接相关。但不可否认的是上述发现进一步支持了微生物生态失调可影响牛的整体健康理论,并证明了研究牛呼吸道微生物区系的必要性。
4 展望
尽管目前已经有许多的工作来探讨微生物区系与BRDC之间的关联,但这一研究领域对于机制的探索仅仅处于初始阶段。呼吸生态系统的复杂性、高通量测序中可能存在的误差(如样品污染)限制了对微生物定植、共生机制的理解,并最终导致难以确切描述微生物对呼吸黏膜健康及变化的贡献。至今已分析了呼吸道中的微生物区系组成和多样性,下一步的任务是通过组学技术从功能上表征呼吸道微生物区系。最后,需要进一步研究来揭示呼吸道微生物区系对黏膜健康和免疫系统调节的具体作用,可为替代疗法的寻找指明方向。

