奶山羊乳房炎二联灭活疫苗的制备及其免疫效果评估
刘程媛,贾延德,张富强,纪甜甜,王天星,姜悦才,赵慧英*,陈德坤*,马文涛*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.西宁市湟中区畜牧兽医站,青海西宁 810099;3.陕西千阳莎能奶山羊发展有限公司,陕西千阳 721100)
乳房炎(Mastitis)是由病原微生物感染乳腺组织引起的炎症性疾病,常发生于泌乳动物。通常根据乳汁及乳房有无可见异常,将乳房炎分为临床乳房炎和隐性乳房炎[1]。临床乳房炎发病迅速,在2 d~3 d内产生严重的炎症反应,导致奶山羊乳房坏死甚至死亡,但其发病率较低,约为2%[2]。隐性乳房炎由于无肉眼可见的症状常被饲养者忽视,但会导致乳汁中体细胞数量升高、乳汁品质降低和患畜产奶量降低[3-5]。在不同奶山羊养殖企业中,由于养殖规模、管理水平、所处地区的流行情况等不同,导致隐性乳房炎的发病率差异较大,一般在30%~80%[6-7]。调查显示,陕西省奶山羊隐性乳房炎的发病率约为45.5%[8]。陕西是我国奶山羊的主要养殖省份之一,奶山羊产业是陕西省农业农村经济的重要支柱。乳房炎不仅对奶山羊养殖企业造成严重的经济损失,乳房炎羊乳中的病原微生物及其治疗产生的抗菌药物残留也对人类健康和食品安全构成了一定的威胁。然而,目前尚无商品化的有效的奶山羊乳房炎疫苗[9-10]。因此,奶山羊乳房炎的预防和治疗是亟待解决的一个棘手问题,对于陕西省打造“千亿羊乳”工程具有重要意义。我们从陕西省武功县某奶山羊养殖场乳房炎乳汁中分离出2种主要病原菌,制备了二联灭活疫苗并评估了免疫效果。
1 材料与方法
1.1 材料
1.1.1 试验用动物 陕西省武功县某奶山羊养殖场的成年泌乳期关中奶山羊32只。
1.1.2 主要试剂及培养基 金黄色葡萄球菌快速鉴定培养基、麦康凯琼脂培养基,青岛高科园海博生物技术有限公司产品;可溶性单组分TMB底物溶液、BCA蛋白质定量试剂盒,北京天根生物技术有限公司产品;Lysis Buffer for Microorganism to Direct PCR,北京宝日医生物技术有限公司产品;GelRed核酸染料,兰杰柯科技有限公司产品;DNA Marker DL 2 000、2×TaqMaster Mix,西安擎科泽西生物科技有限责任公司产品;隐性乳房炎诊断液、转移因子,西北农林科技大学动物医学院兽医免疫学实验室提供;辣根过氧化物酶标二抗(兔抗羊IgG-HRP),Abcam公司产品。
1.1.3 主要仪器 PCR仪(T100),上海伯乐生命医学有限公司产品;高速离心机(Avanti JXN-30),德国Eppendorf生命科技公司产品;恒温培养箱(DNP-9162),美国Thermo公司产品;恒温空气浴摇床(HNY-2102C),天津欧诺仪器股份有限公司产品;超净工作台(SW-CJ-2FD),苏州苏净集团有限公司产品;超声破碎仪(IMS-30),宁波新芝生物科技有限公司产品;多功能酶标仪(Spark),帝肯(上海)贸易有限公司;凝胶成像系统(K8420),南京世研仪器设备有限公司产品。
1.2 方法
1.2.1 乳样采集及乳房炎检测 采集乳样时先将奶山羊乳房擦洗干净,对乳头和采样者双手进行充分消毒后,弃去前2把~3把乳并采集约7 mL乳汁于离心管中,标记样品编号。诊断隐性乳房炎时,将诊断液和乳样各5 mL加于乳房炎诊断盘中,然后作水平同心圆状摇动约5 s,使诊断液和乳样混合均匀,观察并记录诊断结果。诊断后的乳样,置于冰盒中运送至实验室进行病原菌分离鉴定和抗体效价检测。
1.2.2 病原菌分离纯化 参照常规的细菌分离方法进行[11]。主要操作程序是用接种环取乳房炎乳汁接种于山羊血琼脂培养基上,37 ℃培养24 h~36 h后,观察并记录菌落特征。挑取典型菌落分别接种于LB液体培养基中,37 ℃空气浴摇床过夜振荡培养。再用接种环取菌液划线接种于山羊血琼脂培养基上培养,并进行纯化鉴定。
1.2.3 病原菌鉴定
1.2.3.1 细菌形态学观察 纯化的细菌扩大培养后,分别接种于普通琼脂培养基、山羊血琼脂培养基、麦康凯琼脂培养基和金黄色葡萄球菌快速鉴定培养基,37 ℃培养24 h~48 h。观察并记录细菌的生长情况、菌落的大小、形态、溶血性等特征。取菌液涂片,革兰氏染色后镜检,观察并记录细菌的形态、大小、染色情况等。
1.2.3.2 分离菌16S rDNA片段扩增与序列比对 挑取单克隆菌落于50 μL Lysis Buffer for Microorganism to Direct PCR中充分混匀,80 ℃水浴15 min,低速离心,上清液即为细菌的基因组DNA,将其作为模板用细菌16S rDNA通用引物进行PCR扩增。PCR反应体系为25 μL:2×TaqPCR Master Mix 12.5 μL,27F 0.5 μL,1492R 0.5 μL,DNA模板 2.0 μL,ddH2O 9.5 μL。反应程序为:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,共32个循环;72 ℃终延伸10 min;4℃结束反应。将电泳鉴定结果与预期相符的PCR产物送西安擎科泽西生物科技有限责任公司测序。将测得的序列通过NCBI数据库的Blast程序与收录的序列进行比对。
1.2.3.3 分离菌基因组特异性序列的PCR扩增 根据本实验室设计的金黄色葡萄球菌和大肠埃希氏菌的特异性引物序列合成上、下游引物[12]。进行基因组特异性序列的PCR扩增并将PCR产物用20 g/L琼脂糖凝胶电泳鉴定,特异性PCR反应体系为25 μL:2×TaqPCR Master Mix 12.5 μL,上、下游引物各1.0 μL,DNA模板 2.0 μL,ddH2O 9.5 μL。反应程序为:94 ℃预变性5 min;94 ℃ 30 s,57 ℃ 45 s,72 ℃ 60 s,共30个循环;72 ℃终延伸10 min;4 ℃结束反应。
1.2.4 细菌扩大培养 将菌株分别接种于10 mL LB液体培养基,37 ℃空气浴摇床过夜振荡培养。再将扩菌后的菌液接入装有500 mL LB液体培养基的锥形瓶中,37 ℃空气浴摇床振荡培养12 h~18 h至菌液密度为1×109CFU/mL,离心,收集菌体沉淀。
1.2.5 细菌的灭活及灭活效果检测 用适量的无菌生理盐水以8 000 r/min室温离心10 min后弃去上清的方法,将1.2.4中获得的菌体沉淀洗涤3次,再用500 mL含50 mg/mL甲醛的生理盐水将菌体沉淀重悬,置于37 ℃空气浴摇床中振荡灭菌处理,大肠埃希氏菌处理72 h,金黄色葡萄球菌处理96 h。
取100 μL灭活后的菌液涂布普通琼脂培养基,37 ℃培养24 h。若平板上无菌落形成,证明灭活成功;否则继续振荡灭菌。
1.2.6 铝胶盐-转移因子佐剂的制备 先配制50 mg/mL的硫酸铝溶液:称取25 g硫酸铝粉加入250 mL蒸馏水中充分混匀;再配制50 mg/mL的氢氧化钠溶液:称取5 g氢氧化钠粉末加入100 mL蒸馏水中充分混匀。然后将这两种溶液充分混匀后在室温下静置,待其自然沉降分层后,用生理盐水洗涤2次。最后,用本实验室制备的转移因子将其定容到500 mL,即为铝胶盐-转移因子佐剂。
1.2.7 二联灭活疫苗的制备 将500 mL灭活好的菌液用适量的无菌生理盐水洗涤3次以除去甲醛,再用500 mL无菌生理盐水重悬起来。将两种菌液按照1∶1的比例混合,再将混合菌液与铝胶盐-转移因子佐剂等体积充分混匀,即得奶山羊乳房炎二联灭活疫苗,置于4 ℃保存备用。
1.2.8 奶山羊免疫试验 对养殖场的全部泌乳期奶山羊进行隐性乳房炎检测,随机选取其中的32只进行乳房炎灭活疫苗的免疫试验。将其分为疫苗免疫组和对照组,每组16只(其中乳房炎阳性和阴性的奶山羊各8只)。对照组不做任何处理,免疫组动物颈部皮下注射疫苗2 mL/只,并在首免后第15天以相同的方式和剂量进行第2次免疫。
在免疫前、二免后第0、15、35、60天采集所有奶山羊的血液和乳汁样本,分离血清和乳清保存于-20 ℃,用于抗体效价的测定。
1.2.9 试验羊的抗体测定和体细胞检测 参照本实验室建立的方法[13]进行。测定结果用GraphPad Prism 6软件进行数据分析。
2 结果
2.1 分离菌的形态学观察结果
从奶山羊乳房炎乳汁中分离纯化出的病原菌,按照其菌落形态特征(图1)和革兰氏染色镜检结果(图2),可以分为2类:
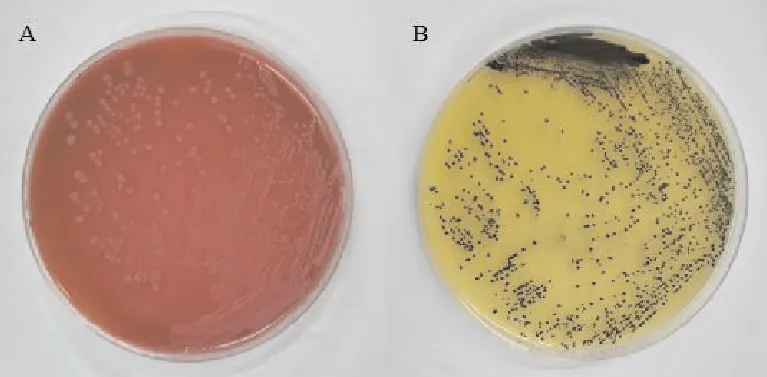
A.A类细菌在麦康凯琼脂培养基上的菌落形态;B.B类细菌在金黄色葡萄球菌快速鉴定培养基上的菌落形态
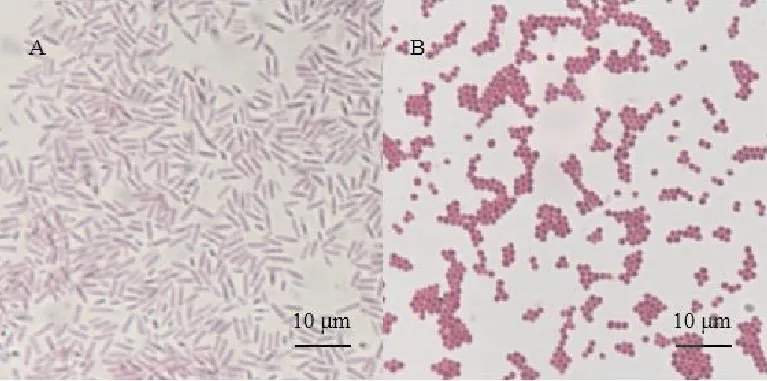
A.A类细菌;B.B类细菌
A类菌落:在普通琼脂培养基上形成光滑、湿润、灰白色的圆形菌落;在山羊血琼脂平板上部分菌株有溶血现象;在麦康凯琼脂培养基上形成粉红色的菌落。革兰氏染色呈阴性,无荚膜、无芽孢,短小杆状、两端钝圆,单个或成对排列。
B类菌落:在普通琼脂培养基上形成光滑、湿润、黄色的圆形菌落;在金黄色葡萄球菌快速鉴定培养基上形成黑色、有光泽的圆形菌落,其周围有不透明圈,最外有清晰带。革兰氏染色呈阳性,无荚膜、无芽孢,圆形,呈葡萄串状排列。
2.2 分离菌16S rDNA的序列比对
测得分离菌16S rDNA序列的相似性比对结果见表1。比对结果显示A类细菌为大肠埃希氏菌,B类细菌为金黄色葡萄球菌。两者与对应的收录序列的相似性均超过99.9%。

表1 分离菌16S rDNA的序列比对结果
2.3 分离菌基因组特异性序列的PCR扩增
以分离菌基因组DNA为模板,用对应的细菌特异性引物分别进行PCR扩增。琼脂糖凝胶电泳的检测结果见图3。该结果表明,A类细菌为大肠埃希氏菌,B类细菌为金黄色葡萄球菌。

M.DNA 标准DL 2 000;1.A类细菌;2.阴性对照;3.B类细菌
2.4 乳房炎二联灭活疫苗免疫效果的评估
在二免后的60 d内,免疫组奶山羊血清中针对两种病原菌的抗体水平均显著升高(P<0.05),而对照组变化不显著,结果见图4~图7。二免后第15天,免疫组血清中的抗体效价达到峰值,约为210,为对照组的32倍。之后血清中的抗体效价略有下降,但仍显著高于对照组。乳清中的抗体效价与血清类似,在二免后60 d内显著升高,在二免后第15天达到峰值,且乳清中的抗体效价总是略高于血清中的抗体效价。

图4 血清中大肠埃希氏菌的抗体效价
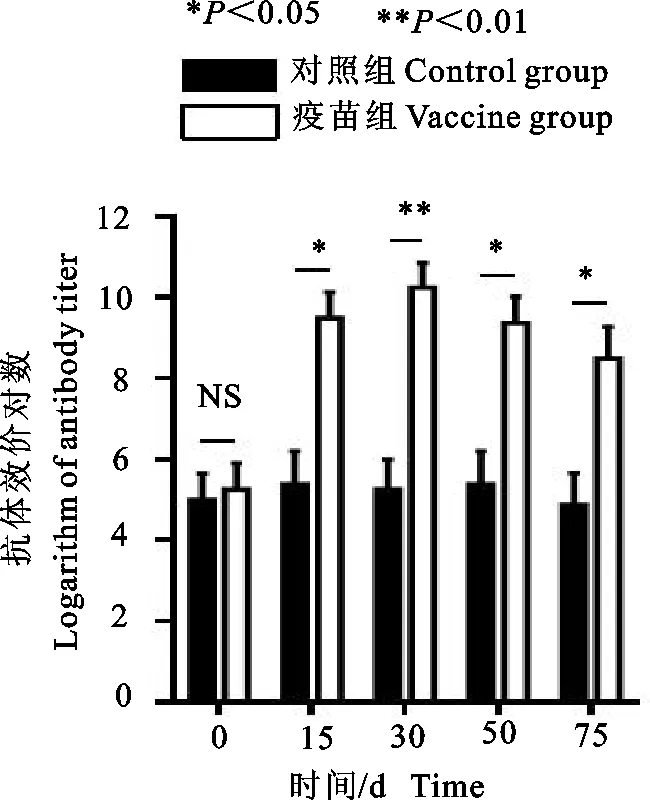
图5 血清中金黄色葡萄球菌的抗体效价

图6 乳清中大肠埃希氏菌的抗体效价

图7 乳清中金黄色葡萄球菌的抗体效价
在二免后60 d内,用CMT诊断液对对照组和免疫组的奶山羊进行隐性乳房炎的检测。结果显示,对照组奶山羊隐性乳房炎的检出率始终维持在40%以上;相比而言,免疫组的隐性乳房炎检出率显著下降:免疫前的检出率为50%,在二免时下降到了18.75%,在二免后第35天下降到6.25%(图8)。以上结果表明,本研究制备的乳房炎灭活二联疫苗对奶山羊隐性乳房炎的治疗效果显著。

图8 隐性乳房炎检出率
3 讨论
本实验室对陕西、山东、云南省3个主要奶山羊养殖地区的调查结果显示,金黄色葡萄球菌和大肠埃希氏菌分别占我国奶山羊乳房炎病原菌的17%和16%。这与国际上的病原学统计结果高度一致,即大肠埃希氏菌和金黄色葡萄球菌是奶山羊乳房炎最主要的病原菌[7,14]。因此,本研究以武功奶山羊养殖场乳房炎乳中分离出的这2种病原菌为材料,制备乳房炎二联灭活疫苗并评估其免疫效果,以期为奶山羊乳房炎的防治提供参考。
乳房炎的主要病原菌都属于胞外寄生菌,因此体液免疫对于病原菌的清除具有重要意义。乳腺组织体液免疫产生的抗体不仅能通过凝集作用抑制细菌的生长及其对乳腺上皮细胞的吸附,也可以通过与补体结合发挥溶菌和调理作用[15-16]。因此,测定免疫后特异性抗体的效价是评估疫苗免疫效果的关键指标之一。本研究中,二免后60 d内免疫组血清和乳清中针对2种分离菌的抗体效价均显著高于对照组,效价最高时约为对照组的32倍,表明该疫苗能有效刺激动物机体产生较强的体液免疫。免疫前隐性乳房炎检出率为50%,在二免后第35天下降到6.25%。本实验室同时用上述的免疫方法对其他羊群免疫后发现,1只患有临床乳房炎的奶山羊,其乳汁由免疫前的紫黑色在二免后第35天转为了乳白色。隐性乳房炎检出率的显著降低和临床乳房炎病情的改善,表明该疫苗对乳房炎还具有一定的治疗作用,但其作用机理还有待进一步的研究阐明。

