氟与砷单独及联合暴露对子代大鼠肾脏毒性损伤与细胞自噬的影响
田晓琳,杨玲玲,赵 倩,仇玉兰,孙子龙,牛瑞燕,*,阎小艳,*
(1.山西农业大学动物医学学院,山西省环境兽医重点实验室,山西 晋中 030801;2.山西医科大学公共卫生学院卫生毒理学教研室,山西太原 030001)
无机氟和砷是自然界中广泛存在的环境污染物。中国是全球地方性氟、砷中毒较为严重的国家,由于特殊的气候、地貌和地质特征,我国面临着地下水中多种地质污染的情况,其中高氟与高砷的共存现象广泛分布在高碱度的半干旱地区,包括河套盆地、大同盆地、松嫩平原及准葛尔盆地等[1-3]。因此我国地下水氟、砷的广泛分布对人类和动物健康产生有害影响,成为最严重的公共卫生问题之一[4]。
慢性氟中毒与慢性砷中毒均集中表现为全身多器官、多系统的损伤。众多研究表明,肾脏作为机体主要的排泄器官,是机体氟、砷代谢的必经之路。1937年Dharmaratne 等[5]首次发现氟暴露可能导致机体肾脏组织发生病变。随后的流行病学表明,氟一方面改变肾功能相关酶的代谢活力,导致肾功能紊乱[6],另一方面导致人体肾小管上皮细胞产生病变,促进慢性肾脏疾病的发生[7-8]。砷在1978 年被国际癌症研究机构(IARC)确定为致癌物,其中饮用水中砷长期暴露不仅增加机体非癌病变风险,而且引发癌变[9]。2021 年美国环境保护署学者,基于美国疾病控制与预防中心提供的砷暴露数据与国家癌症研究所2011—2015年的癌症数据,采用回归模型预测发现每年砷的累计浓度与肾癌的发生率呈正相关[10]。可见,氟和砷的单独暴露可对肾脏造成毒性损伤,然而现阶段关于氟与砷联合中毒的相关研究仍处于初期阶段。
细胞自噬不仅参与了肾脏正常的发育及衰老过程,更多的体现在其对急性肾损伤、肾纤维化、免疫性肾小球疾病、足细胞病及IgA 肾病等疾病发生发展的调控[11]。可见,在肾脏发育及疾病中,细胞自噬在肾小球与肾小管中均发挥了重要的作用。因此,为进一步完善氟、砷暴露对肾脏的毒性损伤机制,本研究建立妊娠期至成年期氟、砷单独及联合暴露大鼠模型,初步评估了氟、砷单独及联合暴露对模型大鼠肾脏组织形态学、超微结构的毒性影响,并进一步探究细胞自噬在氟、砷所致肾脏毒性损伤中的作用。
1 材料与方法
1.1 主要试剂
氟化钠与亚砷酸钠(美国Sigma公司);Masson染色试剂盒(碧云天生物技术有限公司);LC3抗体和p62抗体(美 国CST 公 司);Beclin1 抗 体(美 国Abcam 公司);GAPDH抗体(美国Abcam公司);荧光二抗(中国博士德生物有限公司)。
1.2 实验仪器
JEM-1011 透射电子显微镜(日本JEOL 公司);酶标仪(美国Bio-Tek 公司);莱卡切片机(德国Leica 公司);Chemi-Doc 成像系统(英国Bio-Rad 公司);CK40倒置显微镜和正置荧光显微镜(日本Olympus公司)。
1.3 妊娠期至成年期氟、砷单独及联合暴露动物模型的建立
本研究SD 大鼠由山西医科大学实验动物中心提供,动物使用许可证号:SYXK(晋)2019-0007。研究建立妊娠期至成年期氟与砷单独及联合暴露的子代雄性大鼠模型,采用饮水染毒方式,分为4 组即对照组(蒸馏水)、氟暴露组(100 mg/L 氟化钠)、砷暴露组(75 mg/L亚砷酸钠)、氟与砷联合暴露组(100 mg/L氟化钠+75 mg/L 亚砷酸钠)。子代大鼠在妊娠期经其母体宫内暴露于氟、砷;哺乳期(出生后第0 天至第21 天断乳)经母乳暴露于氟、砷;断乳后,通过饮水染毒方式暴露至120 d 后,各组随机选6 只子代雄性大鼠作为本研究最终试验大鼠。采集肾脏组织,称量体质量与肾脏质量,并计算肾系数。
1.4 肾脏组织病理学观察
采集子代雄性大鼠新鲜肾脏皮质部分组织,固定于多聚甲醛中;经过脱水、透明后将组织包埋成蜡块;切为厚3 μm 的切片,并确保切片中有肾小球与肾小管的分布;最后采用Masson染色试剂盒染色并评估肾脏组织形态学改变。
1.5 肾脏组织超微结构的观察
采集子代雄性大鼠新鲜的肾脏皮质部分组织,切成1 mm3大小的切块,经过固定、脱水、包埋后进行切片与染色,此过程中需要经过半包埋技术以确定所包埋组织中均包含有肾小球与肾小管的分布,最后每个组织制备2~3 张切片在透射电镜下观察肾脏组织中肾小管及肾小球的超微结构变化。
1.6 Western blot 测定肾脏组织自噬相关蛋白的表达
取30 mg肾脏皮质部分组织,加入300 μL裂解液混合物,研磨仪破碎组织后,1×104r/min 离心5 min,采用BCA法测定蛋白浓度,计算并配制体系后将蛋白煮沸变性备用。配制分离胶与浓缩胶,加样后采用恒压电泳与恒流转膜,之后将膜封闭2 h,一抗孵育过夜,洗涤3 次后再孵育二抗,膜上滴加ECL 发光液后上机曝光,最后获得条带并保存。本实验中涉及的一抗包括: 自噬基因Atg6 同系物(homologue of autophagy gene Atg6,Beclin1)、微管相关蛋白轻链3(microtubule-associated proteins light chain 3,LC3)、泛素结合蛋白p62(ubiquitin-binding protein p62,p62)、植物磷酸甘油酸脱氢酶(GAPDH)。GAPDH、Beclin1、LC3 与p62 的一抗稀释比例分别为1∶10 000、1∶2 000、1∶1 000、1∶1 000;二抗稀释比例均为1∶4 000。
1.7 免疫荧光测定肾脏组织自噬相关蛋白的表达
切取3 μm 肾脏组织白片60 ℃烘烤3 h 后进行脱蜡与复水,使用过氧化氢溶液去除内源性酶,柠檬酸钠溶液进行抗原修复,滴加5% BSA 封闭15 min,并依次在湿盒中滴加一抗(稀释比例为1∶200)过夜,随后滴加荧光二抗(稀释比例为1∶100)在室温孵育2 h,最后使用DAPI 染细胞核,用荧光猝灭剂封片后使用荧光显微镜观察自噬相关蛋白Beclin1、LC3 与p62 的荧光强度与分布情况(避光环境下操作)。每组随机选取3 只大鼠肾组织切片,每张切片随机选择6 个视野进行定量分析并取平均值。
1.8 统计学分析
应用SPSS 24.0 软件进行统计分析。数据采用xˉ±s进行统计描述,单因素方差分析进行组间比较,LSD-t进行两两比较,交互作用采用析因分析,检验水准为α=0.05。
2 结 果
2.1 氟与砷单独及联合暴露对大鼠肾系数的影响
基于氟、砷单独及联合暴露的子代SD 大鼠模型,肾系数的改变如图1 所示,相较于对照组,砷暴露组肾系数显著升高(P<0.01),而氟暴露组与联合暴露组肾系数未见显著性改变。
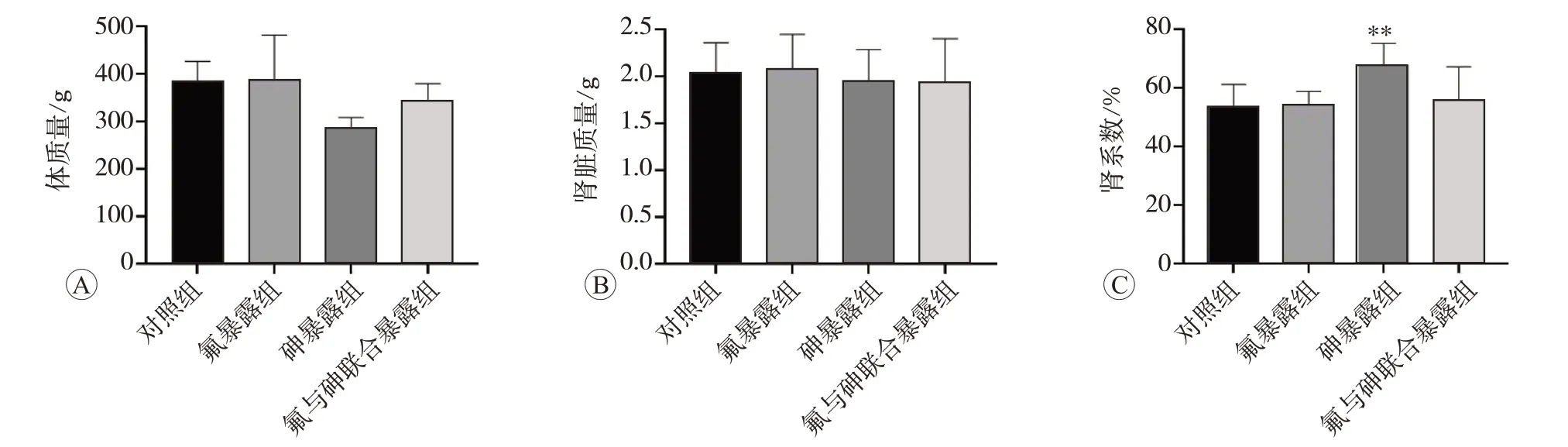
图1 氟、砷暴露对肾系数的影响(n=6)
2.2 氟与砷单独及联合暴露对大鼠肾脏组织纤维化病变的影响
Masson 染色结果见图2。肾小球肾小管上皮细胞胞浆、间质细胞胞浆、肌纤维呈红色,胶原纤维呈蓝色。对照组肾小球肾小管完整,肾小管肾间质纤维化不明显;氟暴露组着色较深,肾小球和肾间质毛细血管内红细胞淤积增多,肾小管肌纤维化轻微加重,肾小球旁的肾小管排列紊乱,肾间质纤维化加重;砷暴露组肾小球基底膜断裂,肾小管轻微扩张,肌纤维化加重,肾间质纤维化加重;氟与砷联合暴露组,肾小球萎缩并伴有系膜增生,肾小管扩张并伴有上皮细胞碎片脱落,肾间质纤维化加重。

图2 氟、砷暴露对肾脏组织结构的影响(标尺50 μm,20 μm)
2.3 氟与砷单独及联合暴露对大鼠肾小球系膜细胞的影响
肾小球系膜细胞的超微结构观察如图3 所示,相较于对照组,各暴露组系膜细胞数量增多,氟暴露组与砷暴露组中肾小球系膜数量增多,氟与砷联合暴露组中系膜细胞数量增多的同时并伴随胞浆内容物的蓄积。
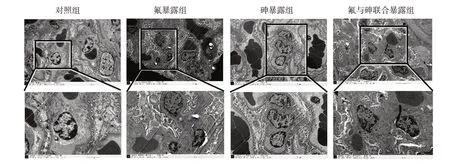
图3 氟、砷暴露对肾小球系膜细胞的影响(标尺5 μm,2 μm)
2.4 氟与砷单独及联合暴露对大鼠肾小球足细胞超微结构的影响
足细胞内细胞器的超微结构如图4 所示,相较于对照组,各暴露组中大鼠肾脏组织足细胞内线粒体空泡化,部分嵴断裂;氟暴露组中发生了严重的内质网扩张;砷暴露组中观察到典型的自噬小体。

图4 氟、砷暴露对肾小球足细胞的影响(标尺2 μm,500 nm)
2.5 氟与砷单独及联合暴露对大鼠肾脏自噬相关蛋白荧光分布及表达的影响
自噬相关蛋白Beclin1、LC3、p62 在肾脏组织中的表达水平见图5。与对照组相比,各暴露组中Beclin1、LC3、p62 蛋白的表达显著增加(P<0.05)。细胞自噬相关蛋白Beclin1、LC3、p62 分别在肾小球与肾小管中的荧光分布情况见图6 和图7。与对照组相比,各暴露组中自噬蛋白的荧光强度增加且荧光分布面积增大;进一步的统计学分析结果如图8 所示,在肾小球与肾小管中,氟、砷单独及联合暴露导致组织中自噬蛋白Beclin1、LC3、p62 的表达水平均显著升高(P<0.01)。
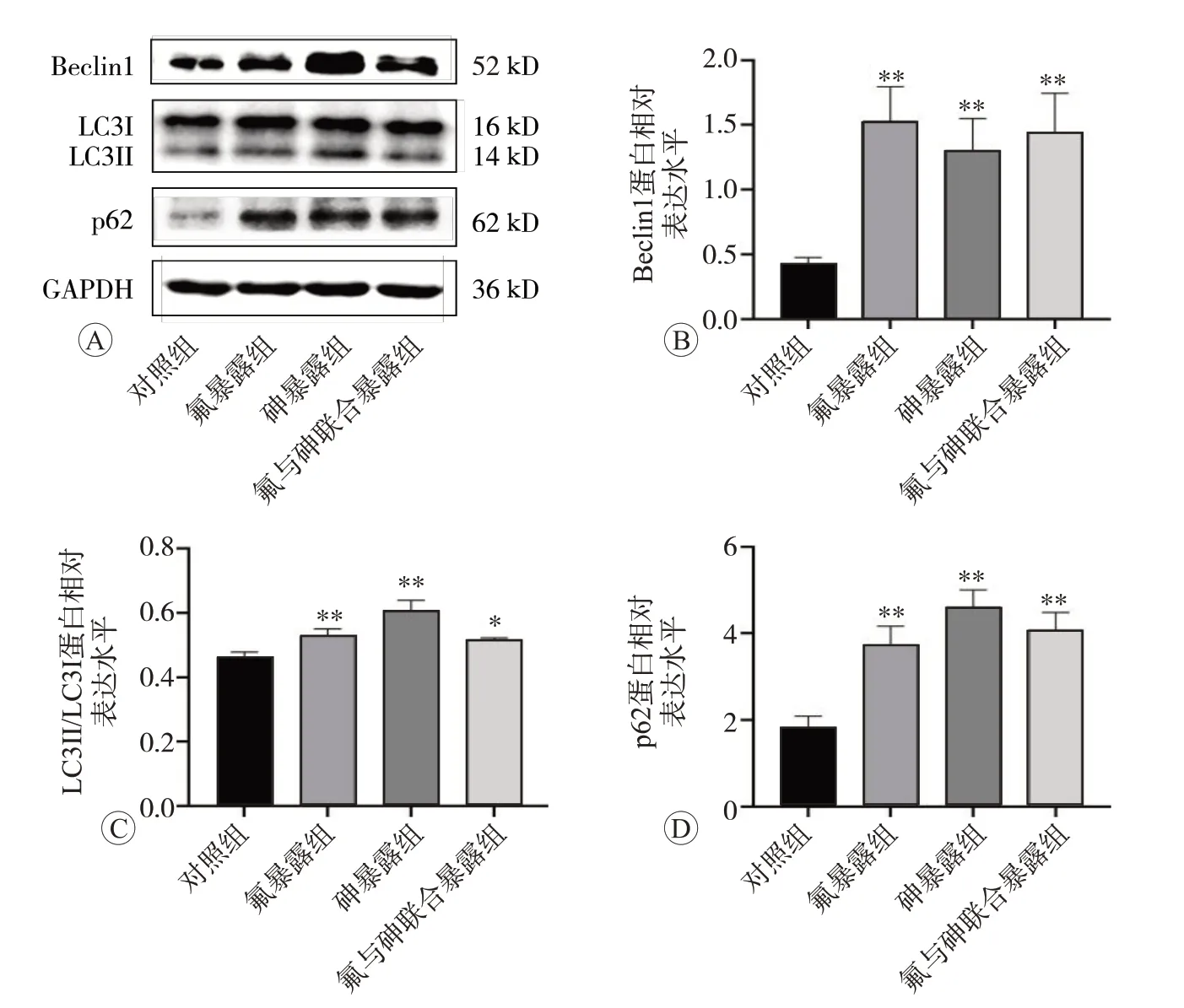
图5 氟、砷暴露对肾脏组织中Beclin1、LC3、p62蛋白表达水平的影响(n=6)
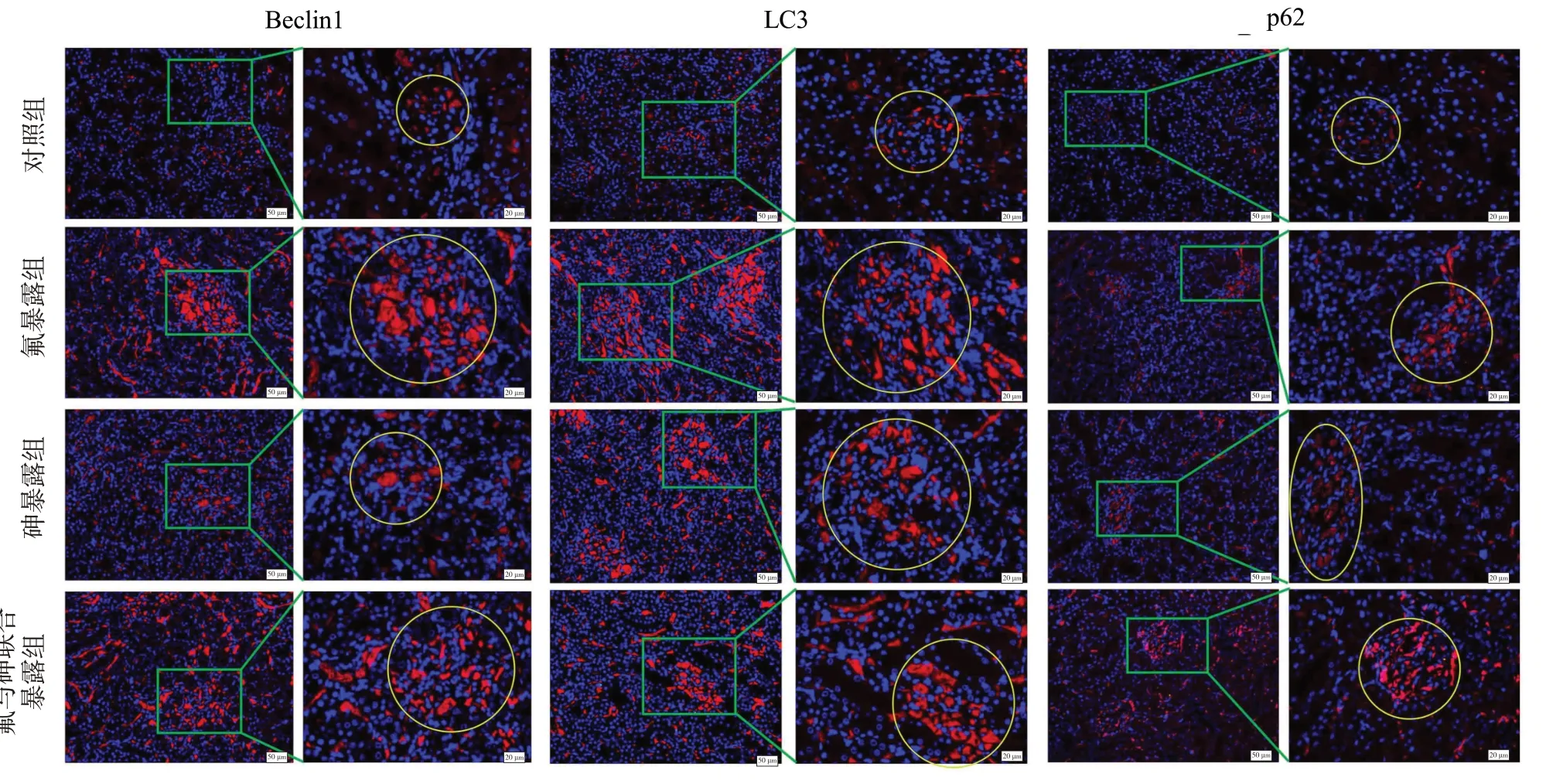
图6 氟、砷暴露对肾小球中Beclin1、LC3、p62蛋白表达的免疫荧光分布的影响(标尺50 μm,20 μm)

图7 氟、砷暴露对肾小管中Beclin1、LC3、p62蛋白表达的免疫荧光分布的影响(标尺50 μm,20 μm)

图8 氟、砷暴露对自噬相关蛋白的免疫荧光分布的影响(n=3)
2.6 氟与砷在对肾脏自噬相关蛋白荧光分布及表达的交互影响
肾脏组织中细胞自噬相关蛋白Beclin1、LC3、p62的表达水平结果中,氟与砷的析因分析见表1,结果显示氟与砷均存在交互作用(均为P<0.01)。肾小球与肾小管中细胞自噬相关蛋白Beclin1、LC3、p62 的荧光表达强度结果中,氟与砷的析因分析见表2。结果显示在各指标中,氟与砷存在交互作用(均为P<0.01)。由于各指标在氟与砷联合暴露组中的表达低于单独氟暴露组与砷暴露组之和,推测氟与砷交互作用可能为拮抗作用。

表1 氟与砷在Beclin1、LC3、p62蛋白表达水平中的析因分析表
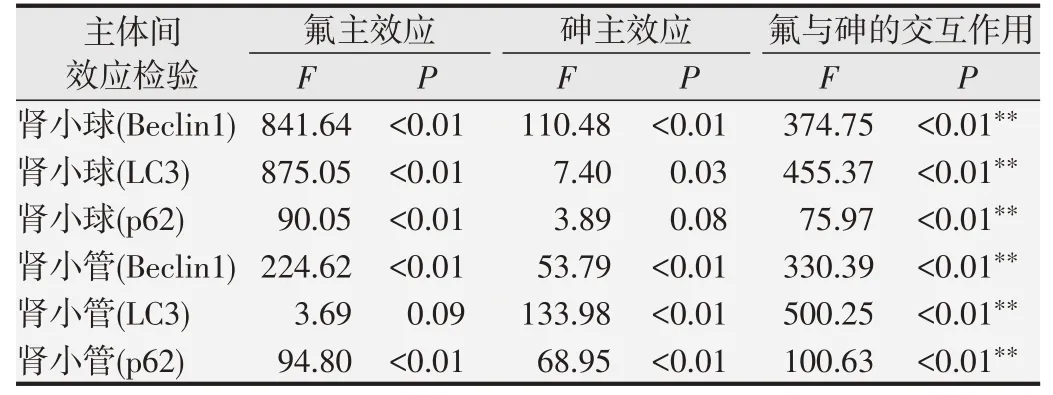
表2 氟与砷在Beclin1、LC3、p62免疫荧光指标中的析因分析表
3 讨 论
长期饮用氟或砷污染的地下水,对机体发育与健康构成威胁,智利的一项流行病学调查显示生命早期(子宫内和婴幼儿时期)暴露于砷环境可以增加暴露人群的死亡率[12]。多项研究表明,在生命早期,机体更容易受到砷的毒性危害,影响了婴儿和儿童的生长发育[13-14]。此外,氟化物的暴露也增加婴幼儿患氟斑牙风险,并与儿童肾脏损害密切相关[15-17]。印度雅鲁藏布江平原的流行病学调查显示,相较于成人,地下水中氟和砷同时暴露给儿童带来更为严重的健康风险[18]。综合以上结果,生命早期暴露于氟和砷的群体具有更高的患病风险。因此,为了更好的模拟地下水氟和砷的实际暴露情况,本课题建立了妊娠期至成年期的氟、砷单独及联合暴露的大鼠模型,氟与砷的暴露过程包括了母体的宫内与母乳暴露方式及子代断乳后自由饮水暴露方式。
研究表明肾脏组织病理学改变是氟和砷中毒性肾脏损伤的重要指标之一[19-20]。高浓度的氟暴露可引发肾小管扩张、变性、炎症及纤维化[21],而砷暴露也可导致肾小球萎缩、肾小管上皮细胞脱落等病变的发生[22]。这些报道与本研究中肾小管及肾小球的病理损伤结果相一致。此外,线粒体是为肾脏足细胞提供所需的能量的重要细胞器。多项研究表明,足细胞损伤伴随着线粒体功能障碍的发生,加入线粒体呼吸链复合物抑制剂后氧化应激水平降低,同时有效的缓解了足细胞的损伤[23];另一项研究也通过促进与抑制线粒体裂变,进而调控足细胞凋亡、足突消失等足细胞损伤的发生[24]。本研究首次在染毒组中观察到肾小球足细胞中细胞器的改变,主要体现在线粒体的空泡化损伤,再次证实了线粒体在肾脏足细胞中的重要性。最重要的是在超微结构中还观察到典型自噬小体的分布,这一结果为我们提供了自噬相关研究的思路。
大量研究已表明,细胞自噬参与了氟和砷暴露对机体多器官毒性损伤的过程,如海马、肝脏、睾丸与肾脏等[25-26]。可见,细胞自噬在氟、砷致病机制中发挥了重要的作用。自噬体的形成是一个动态过程,主要分为起始阶段、延伸阶段及成熟与降解阶段[27-28],在此过程中,任何一个环节出错均可能打乱体内细胞自噬的平衡[29]。在起始阶段,Beclin1招募自噬相关蛋白形成复合物,启动自噬蛋白的级联反应,调控细胞自噬水平[30]。本研究结果中发现氟、砷单独及联合暴露促进了肾小球与肾小管中Beclin1蛋白的表达,提示肾脏组织中细胞自噬流已经启动。而在延伸阶段,LC3 泛素样连接系统发挥重要作用,促进了自噬囊泡的形成,LC3 是自噬小体生成的标志因子之一[31]。此外,自噬小体的成熟与降解阶段是自噬发生过程中非常重要的一个环节,其中p62 水平的高低是评估细胞自噬流中自噬小体正常降解的重要指标,报道显示p62的蓄积预示着自噬流末端阻遏现象的发生[32]。我们的实验设计中,发现延伸阶段中LC3在肾小球与肾小管中的表达升高,且氟、砷暴露后可增加自噬下游调控蛋白p62 的表达水平。近期的多项研究表明,在肾小管上皮细胞中,单独的氟或砷暴露后可诱导Beclin1、LC3 与p62 等自噬相关蛋白表达上升,促进细胞自噬的发生[33-36],与我们的结果相一致。
此外,为阐明氟与砷的联合效应,在细胞自噬指标中,我们发现氟与砷之间存在交互作用。虽然从地球化学角度考虑,氟、砷两种元素不存在相似性或耦合,但是有多项研究报道氟、砷之间存在明显的相关性,并且这种相似性可能源于二者在碱性的地下水中均呈现负离子的形式[37-38]。此外,近年来多项研究试图阐明氟与砷在机体中的联合毒性效应,但尚未有明确的定论,Mittal等[39]在氧化应激指标中发现氟与砷联合暴露减弱了单独的氟与砷暴露的毒性作用;但是在发育神经毒性研究中发现,氟与砷联合暴露体现出更强的毒性作用[40];除此之外,本课题组前期建立的氟、砷单独及联合对睾丸自噬[41]、心脏内质网应激[42]以及肾脏氧化应激[43]的研究中,均发现氟与砷之间的交互作用。因此,本研究得出在肾脏组织细胞自噬水平中氟与砷之间呈现出拮抗作用,进一步结合上述已报道的文献得出氟与砷对机体多器官毒性中可能存在联合作用的初步结论,但是未来仍需进一步的探索。
总而言之,本研究表明妊娠期至成年期氟、砷单独及联合暴露可造成肾脏组织肾小管、肾小球及其内部细胞器病变,并首次在肾小管与肾小球中发现细胞自噬的发生,并进一步在细胞自噬水平中发现氟与砷的联合效应,为完善氟与砷联合中毒的分子机制及预防干预提供了理论基础。

