DNAJB6b通过激活AKT通路增强结直肠癌细胞的侵袭迁移能力
陈丁雄,朱依青,史建红,蔡 岩,郝佳洁,王明荣,梁建伟,张 钰,*
(1.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院,分子肿瘤学国家重点实验室,北京 100021;2.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院,结直肠外科,北京 100021)
结直肠癌(colorectal cancer,CRC)是影响人类健康的常见恶性肿瘤之一,其发病率和死亡率分别位居我国恶性肿瘤的第3位和第5位[1]。早期CRC 患者的5年生存率可达90%,但中晚期患者的5 年生存率不足20%[2]。在我国,约60%的CRC 患者确诊时已为中晚期,尽管治疗方法和手段不断改善,但晚期患者的5年生存率仍一直徘徊在10%左右[3-4]。目前CRC的病因尚不明确,亟待进一步研究阐明其发生发展的分子机理,为研发更多有效的靶向药物提供理论依据。
DnaJ 热休克家族成员B6(DnaJ heat shock protein family member B6,DNAJB6)属于DnaJ热休克蛋白家族(Hsp40)B 亚族成员,又称DnaJ 的哺乳动物亲属(mammalian relative of DnaJ,MRJ)。DNAJB6基因定位于染色体7q36.3,可剪接形成3 个转录本,编码产生DNAJB6a、DNAJB6b 和DNAJB6d 共3 种蛋白异构体。DNAJB6作为辅助伴侣分子,可参与底物蛋白的正确折叠及转运,阻止蛋白质异常聚集,调控蛋白降解及重塑等过程[5]。既往研究显示DNAJB6功能失调不仅与多种疾病相关,在肿瘤发生进展过程中也发挥重要作用[6-9]。值得注意的是,DNAJB6的a和b两个异构体的功能存在明显差异。有研究提示DNAJB6a可发挥抑癌作用,而DNAJB6b 发挥促癌作用[10-14]。而且,上述两个异构体的表达具有明显的组织特异性,在不同类型的肿瘤中变化趋势也有所不同[9-10]。目前,在肿瘤中的研究多集中于DNAJB6a,DNAJB6b的作用还鲜有报道。
我们在前期研究中通过免疫组织化学(immunohistochemistry,IHC)分析发现,DNAJB6 在CRC 组织中表达上调,其高表达是CRC患者预后不良的一个独立预测因素。同时,功能研究提示DNAJB6 过表达可以显著增强CRC 细胞的侵袭迁移能力[9]。由于相关研究提示DNAJB6的异构体a和b在表达和功能上存在较大差异,这两个异构体在CRC中的表达变化和功能作用尚需进行深入研究。
在本研究中,我们首先对CRC 组织中DNAJB6 的异构体a 和b 的表达改变进行分析,并根据分析结果,使用基因表达敲降、Western blot检测、Transwell侵袭迁移实验及挽救实验,探讨了CRC组织中异常表达的DNAJB6 异构体对CRC 细胞侵袭运动能力的影响及其作用的分子机制。
1 材料与方法
1.1 试剂和仪器
细胞培养基DMEM、RPMI 1640 和IMDM 购自北京细工生物,胎牛血清购自Newzerum 公司,SDSPAGE 凝胶配制试剂盒购自碧云天生物,Lipofectamine 2000转染试剂购自Invitrogen公司,BCA蛋白定量试剂盒、Opti-MEM 培养基、嘌呤霉素和ECL 化学发光检测试剂购自Thermo Scientific 公司。AKT 和p-AKT(Ser473)抗体购自CST 公司,HA 标签抗体购自MBL 公司、DNAJB6 和GAPDH 抗体购自Proteintech公司。DMSO购自Sigma公司,BEZ235购自Selleck 公司,Matrigel 和Transwell 细胞培养小室购自Corning 公司。电泳仪购自Bio-Rad 公司,酶标仪购自BioTek Instrument公司,倒置光学显微镜购自Olympus公司,低温台式高速离心机和二氧化碳恒温培养箱购自Thermo Scientific 公司,化学发光成像仪购自Beckman,数字切片扫描仪购自Hamamatsu公司。
1.2 方法
1.2.1 CRC 肿瘤组织和正常组织mRNA 表达数据的获取在NCBI 的GEO 数据库中下载数据集GSE32323的表达矩阵数据和探针平台矩阵数据,从中选取17对配对的CRC 肿瘤和癌旁正常组织的mRNA 表达数据。利用探针平台矩阵,获取DNAJB6a、DNAJB6b对应的探针209015_s_at 和208810_at。结合探针矩阵和表达矩阵,得到DNAJB6 的两个转录本DNAJB6a 和DNAJB6b mRNA的表达数据。
1.2.2 细胞培养人胚胎肾细胞293FT、CRC 细胞系DLD-1 和HCT116 购自南京科佰生物,分别使用添加10%胎牛血清、青霉素(100 U/mL)和链霉素(0.1 mg/mL)的DMEM、RPMI 1640和IMDM培养基,于CO2体积分数为5%的37 ℃恒温孵箱中培养。所有细胞系均经短串联重复序列鉴定无误。
1.2.3 siRNA转染DNAJB6b特异性的siRNA的靶序列 为:siDNAJB6b-T1,5′-GCACGCACTTAACAGAA AT-3′;siDNAJB6b-T2,5′-GCTCATCGGAGCCTCTA TT-3′。阴性对照siRNA 的靶序列为:5′-TTCTCCGA ACGTGTCACGT- 3′ 。 使 用Opti- MEM 培 养 基 和Lipofectamine 2000转染试剂瞬时转染siRNA至CRC细胞,按产品说明书进行操作。转染后培养48 h,收获细胞沉淀进行Western blot检测。
1.2.4 构建稳定敲降DNAJB6b 表达的CRC 细胞株pLKO.1-shDNAJB6b-puro 和pLKO.1-阴性对照shRNA质粒由本实验室构建并保存。shDNAJB6b的靶序列与siDNAJB6b-T1 一致,阴性对照shRNA 的靶序列与阴性对照siRNA一致。在293FT细胞中,使用Opti-MEM培养基和Lipofectamine 2000 转染可表达DNAJB6b shRNA(简称shDNAJB6b)或阴性对照shRNA 的转移质粒和病毒包装质粒,收集病毒上清感染DLD-1 和HCT116 细胞,使用嘌呤霉素筛选获得稳定细胞株,用于后续的Western blot分析和挽救实验。
1.2.5 抑制剂处理在CRC 细胞系DLD-1和HCT116中,使用20 nmol/L的PI3K-mTOR双重抑制剂BEZ235处理细胞,以溶剂DMSO 处理细胞作为对照。处理24 h后,将各组细胞接种至Transwell上室进行侵袭迁移实验,上室中的培养基仍含有相应的药物。
1.2.6 挽救实验在稳定敲降DNAJB6b 的DLD-1 和HCT116 细胞中,分别转染组成型活化的myr-AKT 质粒和空载质粒(方法同siRNA 转染),阴性对照shRNA组仅转染空载体质粒,收集各组细胞进行Western blot检测和Transwell实验。
1.2.7 Western blot检测使用含有蛋白酶抑制剂和磷酸酶抑制剂的裂解液提取分离经上述各种实验处理细胞的总蛋白,经BCA法测定蛋白浓度,按常规方法进行PAGE 凝胶电泳并转移至PVDF 膜,与AKT、p-AKT(Ser473)、DNAJB6及HA-tag抗体进行杂交并使用ECL 检测试剂显示杂交信号,以GAPDH 作为内参对照。
1.2.8 Transwell 实验分为侵袭实验和迁移实验。侵袭实验:将Matrigel 基质胶稀释后铺于Transwell 小室上室,下室加入含20%胎牛血清的新鲜培养基。在上室中接种1.5×105个细胞,培养48 h 后固定染色,统计穿膜细胞数量。迁移实验:无需提前在Transwell上室铺Matrigel 基质胶,细胞培养时间为36 h,其余步骤与侵袭实验一致。
1.2.9 统计学分析使用SPSS Statistics 21软件进行统计分析,使用GraphPad Prism 7 软件进行图表制作。使用配对样本t检验分析CRC 肿瘤组织和癌旁正常组织中DNAJB6 不同转录本mRNA 表达水平的差异;使用独立样本t检验分析BEZ235 处理组和DMSO对照组CRC细胞侵袭迁移能力的差异;使用单因素方差分析法(one-way ANOVA)分析挽救实验中各组细胞间侵袭迁移能力的差异,在方差齐性的前提下,使用Turkey-HSD 法进行组间比较。当P<0.05 时,为组间差异具有统计学意义。
2 结 果
2.1 DNAJB6 不同转录本在结直肠癌组织中的mRNA表达水平存在差异
从NCBI 的GEO 公共数据库中下载数据集GSE32323的表达矩阵数据和探针平台矩阵数据,选取17例手术切除的配对正常及肿瘤组织,提取DNAJB6a(209015_s_at探针)和DNAJB6b(208810_at探针)的mRNA表达数据进行统计分析。结果显示,与癌旁正常组织相比,DNAJB6a在CRC组织中的mRNA表达差异无统计学意义(P=0.458,图1A),而DNAJB6b在CRC 组织中的mRNA表达显著上调(P<0.05,图1B)。
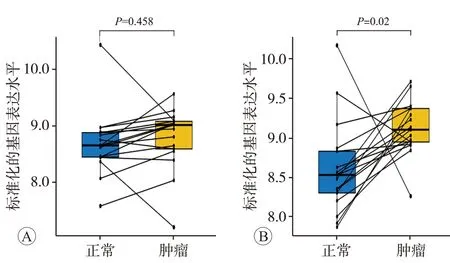
图1 CRC组织中DNAJB6不同转录本的mRNA表达变化情况
2.2 DNAJB6b正向调控AKT的活性
我们在前期研究中发现,敲降DNAJB6 表达可以显著降低CRC 细胞的侵袭迁移能力[9]。由于有研究显示AKT通路异常活化在CRC细胞的侵袭转移过程中发挥重要作用[15-16],而且我们也发现PI3K-AKT-mTOR信号通路在CRC组织中过度活化并与患者的不良预后显著正相关[17],因此在本研究中我们探讨了AKT 异常活化在DNAJB6b介导的CRC细胞侵袭迁移表型中的作用。首先,我们检测了DNAJB6b表达水平对AKT活性的影响。我们在DNAJB6b 高表达的两个CRC 细胞系DLD-1 和HCT116 中,使用两个独立的siRNA 特异性敲降DNAJB6b 的表达,发现瞬时敲降DNAJB6b 的表达可使细胞中p-AKT(Ser473)的水平明显降低(图2A、B)。类似地,我们使用慢病毒感染DLD-1 和HCT116细胞,通过病毒载体表达的shRNA稳定敲降DNAJB6b的表达,同样可以观察到细胞中p-AKT(Ser473)水平的明显下调(图2C、D)。
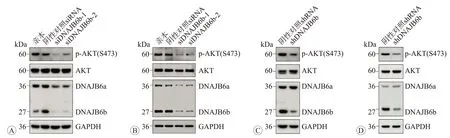
图2 敲降DNAJB6b表达后下调p-AKT的蛋白表达水平
2.3 AKT 通路活化增强结直肠癌细胞的侵袭迁移能力
为证实AKT 信号通路活化在CRC 细胞系DLD-1和HCT116中对侵袭迁移能力的影响,我们使用PI3KmTOR 双重抑制剂BEZ235 处理这两个细胞并进行Transwell 侵袭和迁移实验。分析结果显示,使用BEZ235 处理抑制AKT 通路的活性可导致细胞侵袭迁移能力显著降低(均为P<0.01,图3)。

图3 抑制AKT通路活性可降低CRC细胞的侵袭迁移能力
2.4 DNAJB6b 可通过激活AKT 通路增强CRC 细胞的侵袭迁移能力
为进一步证实AKT通路过度活化是否在DNAJB6b介导的侵袭迁移表型中发挥重要作用,我们进行了挽救实验。分析结果显示,在稳定敲降DNAJB6b 的DLD-1 和HCT116 细胞中,通过外源过表达组成型活化的AKT(myr-AKT)上调p-AKT(Ser473)的水平(图4),可以显著回复由于敲降DNAJB6b表达所致的细胞侵袭迁移能力降低(图5)。
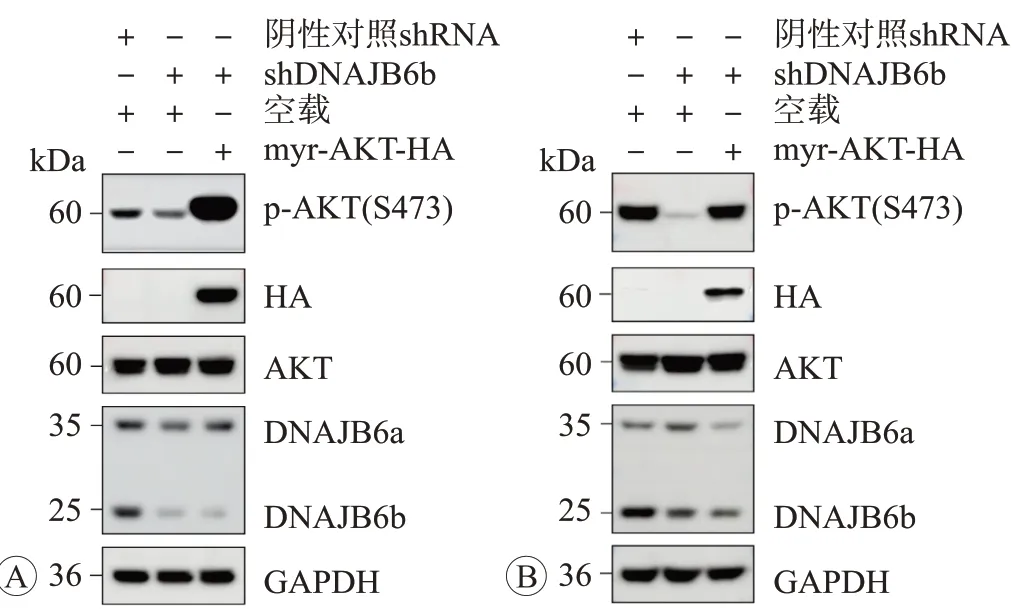
图4 在DNAJB6b 稳定敲降及外源myr-AKT 过表达的Western blot检测结果
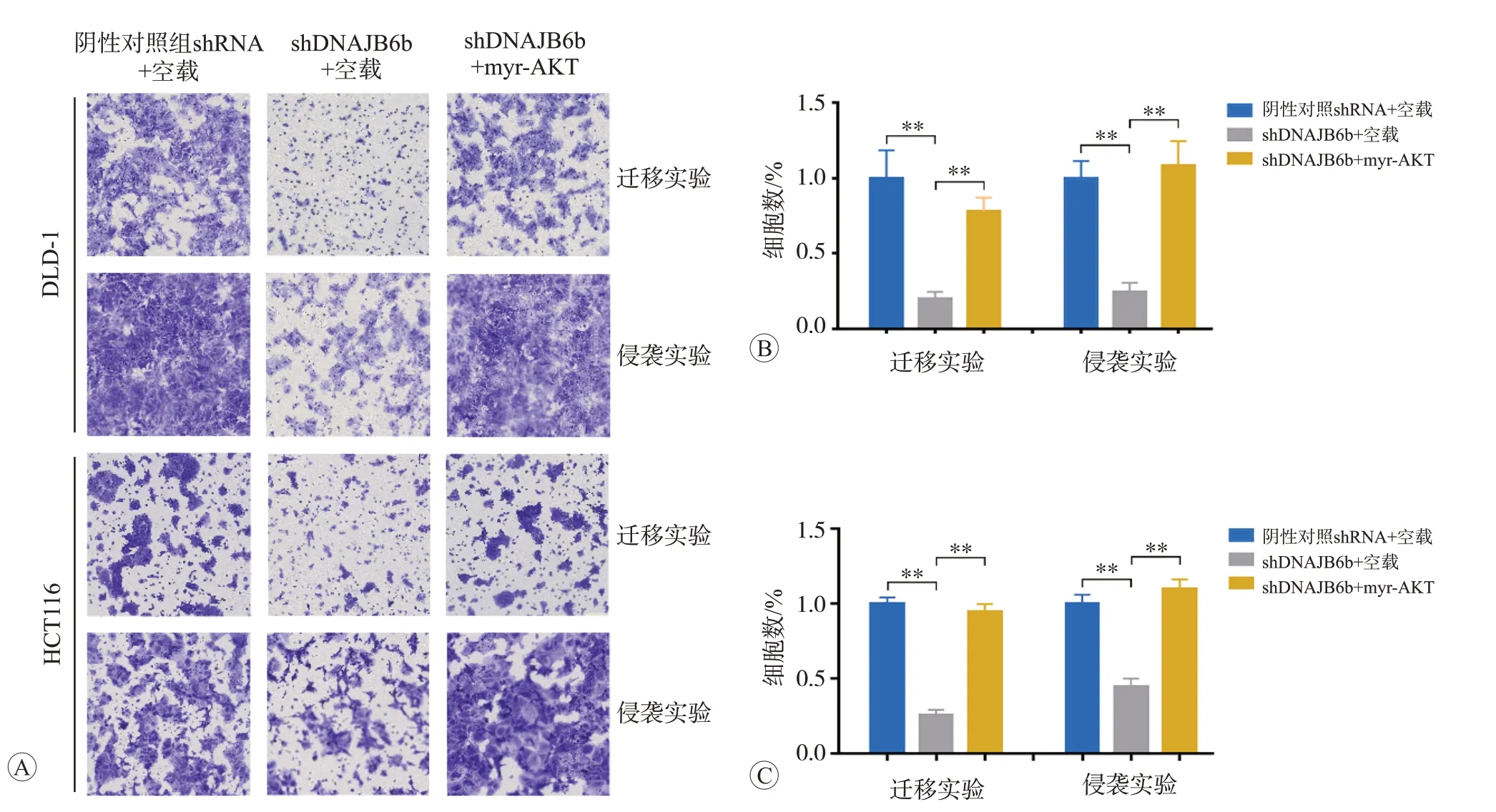
图5 过表达myr-AKT可逆转DNAJB6b敲降导致的CRC细胞侵袭迁移能力降低
3 讨 论
CRC 中DNAJB6 异构体的作用尚未见文献报道。在本研究中,我们分析发现,与正常癌旁组织相比,CRC组织中DNAJB6的异构体DNAJB6b mRNA的表达水平显著上调,而DNAJB6a mRNA 的表达无显著改变。而且,我们进一步研究发现,DNAJB6b高表达可通过激活AKT通路的活性增强CRC细胞的侵袭迁移能力,提示DNAJB6b异常过表达可能在CRC的发生发展过程中发挥重要作用。
以往的研究显示,DNAJB6 在不同类型的肿瘤组织中表达变化趋势不同。例如免疫组织化学(IHC)分析结果显示在食管癌、乳腺癌组织中DNAJB6 表达下降,而在肺癌和结直肠癌中的表达水平升高[9,14,18-21]。然而由于现有商售抗体不能对DNAJB6 的不同异构体加以区分,IHC 分析实际上无法反映单个异构体的表达改变。近期,有研究报道,在食管鳞癌中DNAJB6a mRNA 表达水平显著下调并发挥抑癌作用,而DNAJB6b mRNA的表达水平无显著变化[10]。尽管我们的IHC 分析结果显示DNAJB6 在CRC 组织中表达上调,但Western blot 分析结果显示DNAJB6 的异构体a和b 在CRC 组织中的表达丰度存在明显差异[9]。不仅癌组织中DNAJB6b的表达水平明显高于正常组织,而且DNAJB6b 的表达丰度也远高于DNAJB6a,提示DNAJB6b可能是在CRC细胞中发挥功能作用的优势异构体。为验证这一发现,在本研究中我们对GEO数据库中的mRNA 表达数据进行分析,发现DNAJB6b mRNA 在CRC 组织中表达显著上调,而DNAJB6a mRNA 的表达并无明显改变。而且,使用siRNA 和shRNA特异性地敲降CRC细胞中DNAJB6b的表达,可以显著抑制CRC 细胞的侵袭迁移能力。上述结果表明,DNAJB6b 而非DNAJB6a 在CRC 组织中表达上调,同时提示DNAJB6b过表达在CRC细胞中发挥促癌作用。
为进一步分析DNAJB6b过表达促进CRC细胞侵袭迁移的分子机制,我们分析了相关信号通路的表达变化,发现p-AKT(Ser437)的表达水平在DNAJB6b 敲降细胞中明显降低。PI3K/AKT信号通路异常活化在多种恶性肿瘤的发生发展中发挥重要作用。既往有大量文献报道,PI3K/AKT 信号通路的活化与CRC 细胞的侵袭转移密切相关[15-16]。在本研究中,我们使用PI3K/mTOR 通路双重抑制剂BEZ235 处理DLD-1 和HCT116细胞,证实AKT通路的活化确实可以增强这两个CRC细胞系的侵袭迁移能力。进而,我们通过挽救实验证实,AKT的激活在DNAJB6b过表达介导的CRC细胞侵袭迁移过程中发挥重要作用。
综上所述,本研究结果提示DNAJB6b异常过表达在CRC细胞中发挥促癌作用,而且DNAJB6b可通过正向调控AKT的活性增强CRC细胞的侵袭迁移能力。同时,本研究结果提示,DNAJB6b可能作为潜在的分子靶点,用于CRC,特别是转移性CRC 的治疗。目前,DNAJB6b调控AKT活性的具体分子机制还未阐明,也未见到有关DNAJB6b特异性抑制剂的报道。后续的研究一方面将深入探索揭示DNAJB6b促癌作用的分子机制,同时需要筛选鉴定DNAJB6b的靶向抑制剂并探索联合靶向治疗策略。

