静水压诱导翘嘴鳜雌核发育的研究
李勇明 桂 彬 黎阳雨 李扬扬 陈亮明 黄 容 廖兰杰 汪亚平
(中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072)
雌核发育是鱼类单性生殖中一种重要的生殖方式, 与传统的同胞近亲交配选择育种技术相比,由于雌核发育后代的遗传物质完全来自母本, 因而可以作为快速建立高纯合度品系的有效手段, 在鱼类染色体操作、遗传改良及性别控制等方面都具有潜在的应用价值[1,2]。20世纪90年代以来, 研究人员对鱼类人工雌核发育的研究报道较多, 已先后在草鱼(Ctenopharyngodon idella)[3]、鲤(Cyprinus carpio)[4]、鲢(Hypophthalmichthys molitrix)[5]、大菱鲆(Scophthalmus maximus)[6]等10 余种鱼类中成功获得了雌核发育二倍体后代。
人工诱导鱼类的雌核发育包括两个方面: 精子染色体的遗传失活及卵子染色体的二倍体化[7]。用紫外线照射精液, 使精子遗传物质失活的方式最为普遍, 在诱导鱼类人工雌核发育中大都使用此法。在卵子染色体的二倍化方面, 诱导的方法主要有温度处理(冷休克或热休克) 、化学药物和静水压。最常用的是温度休克法, 尤其是冷休克对大多数鱼类雌核发育二倍化的形成有效[8]。也有研究人员使用秋水仙素溶液浸泡受精卵, 获得了二倍体雌核发育个体[9]。用静水压来阻止卵子第二极体的排出或受精卵的第一次有丝分裂, 同样可实现卵子的二倍化, 因其对胚胎的损伤小, 且成活率高, 近年来得到广泛应用[7]。
鳜是我国重要的淡水名特优养殖鱼类, 属鲈形目、脂科、鳜属。目前用于池塘养殖的鳜主要是翘嘴鳜(Siniperca chuatsi)、大眼鳜(S. kneri)和斑鳜(S. scherzeri)三个种, 其中以翘嘴鳜的养殖规模最大, 翘嘴鳜中雌性比雄性生长快, 经济价值更高[10]。2019年, 鳜养殖产量达33700 kg[11]。随着鳜养殖业的快速发展, 养殖密度不断增加, 养殖病害频繁暴发, 生长速度减缓, 野生种质资源受到过度捕捞和种质混杂的威胁。对翘嘴鳜进行种质资源挖掘, 创制单性或新的种质资源, 从而选育出生长快、抗逆性好的翘嘴鳜优良品系非常必要[12,13]。
本文以翘嘴鳜为研究对象, 对静水压诱导雌核发育过程中的精子灭活时间、静水压处理前受精时间、静水压强度及持续处理时间进行探索, 以期获得静水压诱导翘嘴鳜雌核发育的最佳参数。
1 材料与方法
1.1 雌核发育亲本的来源及催产方法
一冬龄性成熟翘嘴鳜(雌雄各30尾)购买自湖北武穴燕中水产品养殖有限公司, 暂养于水泥池1周,保持饵料鱼和溶氧充足。人工繁殖前1天, 雌鱼每公斤体重经胸鳍下注射DOM 1 mg; LHRH-A2 5 μg;HCG 1000 IU, 雄鱼剂量减半。注射后测量水温为26℃, 效应时间预计21h。
1.2 精子灭活时间的选择
采集3尾雄性鳜精液, 按1∶10 的比例加入hanks保存液混匀, 冰上避光保存。解剖镜下加水分别观察精子活力, 确认每尾雄鱼的精子具有足够的活力。然后各取15 mL 共45 mL精液于大玻璃皿中混匀, 置于摇床上, 在两只15 w的紫外灯管下(培养皿与紫外灯管的垂直距离约17 cm)缓慢摇动, 分别于0、9min、12min、15min、18min、21min和24min时取2 mL精液, 冰上避光保存。
采集3尾雌性鳜的卵子混匀, 按体积等分为7等份, 分别与紫外照射0、9min、12min、15min、18min、21min、24min的精液干法受精, 受精后置于7个孵化桶中26℃水温孵化, 12h (原肠晚期)统计受精率, 24h统计畸形率, 72h统计存活率。
1.3 静水压诱导前受精时间的选择
采集3尾雄性鳜的精液并确认精子具有足够活力, 按1∶10 的比例分别加入hanks保存液混匀, 各取15 mL按照1.2确定的紫外照射时间灭活精子。采集3尾雌性鳜的卵子混匀, 按体积等分为5等份, 各加入2 mL灭活的精液干法受精, 再加入曝气水继续受精2min、3min、4min、5min和6min后, 置于静水压装置中, 30s内将压力升至68 MPa持续1min诱导受精卵, 后置于5个孵化桶中26℃水温孵化,12h、24h和72h时分别统计受精率、畸形率和存活率。
1.4 静水压强度以及持续时间的选择
采集3尾雄性鳜的精液并确认精子具有足够活力, 按1∶10 的比例分别加入hanks保存液混匀, 各取15 mL按照1.2确定的紫外照射时间灭活精子。采集6尾雌性鳜的卵子, 混匀后按体积等分为16等份,部分放入一次性打包袋中充氧遮光保存, 各加入2 mL灭活的精子干法受精, 依据1.3确定的受精时间加水继续受精, 在58、63、68和73 MPa 静水压下, 分别持续1min、2min、3min和4min。孵化桶中26℃水温孵化, 12h、24h和72h时分别统计受精率、畸形率和存活率。
1.5 最优受精时间及静水压持续时间诱导雌核发育的效果
采集3尾雄性鳜的精液并确认精子具有足够活力, 按1∶10 的比例分别加入hanks保存液混匀, 各取30 mL按照1.2确定的紫外照射时间灭活精子。采集3尾雌性鳜的卵子, 每尾雌鱼的卵子按体积等分为3等份, 分别与1尾雄鱼未灭活的精子受精设为对照组1; 与灭活的精子受精设为对照组2; 最后一份与灭活的精子受精后设为实验组, 按照1.3的结果选择受精时间, 1.4的结果选择静水压强度和持续时间进行雌核发育。每尾雌鱼产生3组群体, 3尾雌鱼共9组受精卵分别放入9个孵化桶中26℃水温孵化。12h、24h和72h时统计受精率、畸形率和存活率,48h时体视显微镜(Olympus SZ61TR)观察出膜后的正常和畸形鱼苗并拍照。采用SPSS软件, 对组间数据进行单因素方差分析和两两比较。雌核发育群体开口后混合养殖, 直至可剪尾鳍进行性别鉴定。
1.6 雌核发育个体的性别鉴定
选取30尾雌核发育个体及其亲本(雌雄各3尾),分别剪取部分尾鳍放入96孔板。利用chelex100煮沸法, 在96孔板中一步完成DNA样品的制备。操作步骤为将150 μL 5%浓度的chelex100加入装有尾鳍的96孔板, 58℃消化1h, 100℃煮沸8min, 4000转离心5min。取1 μL上清作为PCR模板, 在本实验室发掘的一个鳜性别特异性标记上设计引物(F: 5′-CAAACTACATGAGAAACTCTTGGTTGAC-3′; R:5′-CTTTATCCATAGCCCCTCAGCCTTG-3′)进行PCR扩增。扩增体系为10×Buffer(Mg2+plus)1 μL,LC Green 1 μL, dNTP(10 mmol/L each)0.2 μL, F primer(10 mmol/L)0.2 μL, R primer(10 mmol/L)0.2 μL,Taq酶(5 U/μL)0.1 μL, 模板DNA 1 μL, 最后补充ddH2O至10 μL。扩增条件为94℃预变性4min, 94℃变性30s, 55℃退火30s, 72℃延伸25s, 40个循环后72℃延伸5min, 4℃保存。扩增完成后采用LightS-canner 96(美国Idaho Technology公司)进行HRM分析, 区分雌性和雄性个体。
2 结果
2.1 精子灭活时间的选择
3尾雌鱼卵子混匀后等分的7份卵子, 分别与紫外照射0、9min、12min、15min、18min、21min和24min的精子受精孵化。12h、24h和72h时分别统计受精率、畸形率和存活率, 并绘制折线图(图 1)。结果发现, 紫外灭活0—24min精子的受精率变化并不大, 从0的最高值90.12%降至24min的最低值72.47%, 总体上紫外照射的时间越长则受精率越低。畸形率则随着紫外照射的时间越长比率越高,从对照的0增加至15min的100%, 15min后基本稳定在100%。存活率则随着紫外照射的时间越长数值越低, 从对照的85.57%降至18min的0, 18min后所有鱼苗全部死亡。结果表明在本研究使用的紫外照射强度下, 翘嘴鳜精子的最佳灭活时间为18min。
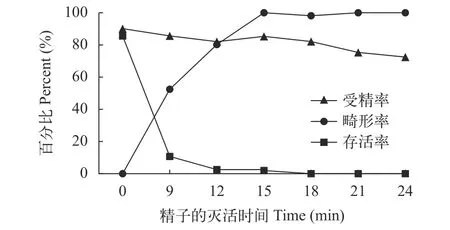
图1 不同灭活时间精子与正常卵子受精的受精率、畸形率和存活率Fig. 1 Fertilization rate, deformity rate and survival rate of normal eggs fertilized with sperms at different inactivation times
2.2 静水压诱导前不同受精时间的效果比较
3尾雌鱼卵子混匀后等分为5份, 分别与2 mL的灭活精子, 加水受精2min、3min、4min、5min和6min, 于68 Mpa静水压下持续处理受精卵1min。5种受精时间的受精率、畸形率和存活率的折线图显示, 受精率在76.24%—82.84%; 畸形率从2min的86.46%降至5min的62.64%, 受精6min的比率又稍微升高; 5种受精时间的存活率变化不大, 但比较起来5min时存活率最高, 为3.45%(图 2)。结果说明受精5min后进行静水压诱导为最合适的受精时间。
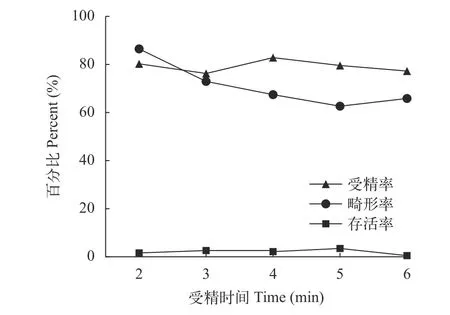
图2 不同受精时间受精卵的受精率、畸形率和存活率Fig. 2 Fertilization rate, deformity rate and survival rate of fertilized eggs at different fertilization times
2.3 静水压强度以及持续时间的效果比较
6尾雌鱼卵子混匀后等分的16份卵子, 分别与2 mL灭活精子, 加水受精5min 后, 在58、63、68和73 MPa 静水压下, 各分别持续处理1min、2min、3min和4min。12h、24h和72h时分别统计受精率、畸形率和存活率(表 1)。与上述结果相似, 受精率在不同的静水压及不同的持续处理时间变化均不大, 最大值为58 Mpa静水压持续处理3min的受精率(85.56%), 最低为58 Mpa静水压持续处理4min的受精率(70.25%); 畸形率则介于62.47%—78.25%, 73 Mpa静水压持续处理3min的畸形率最高, 63 Mpa静水压持续处理4min的畸形率最低; 存活率介于0—6.99%,63 Mpa静水压持续处理2min的存活率最高。综合评估63 Mpa静水压持续处理时间2min为净水压诱导翘嘴鳜雌核发育的最佳参数。
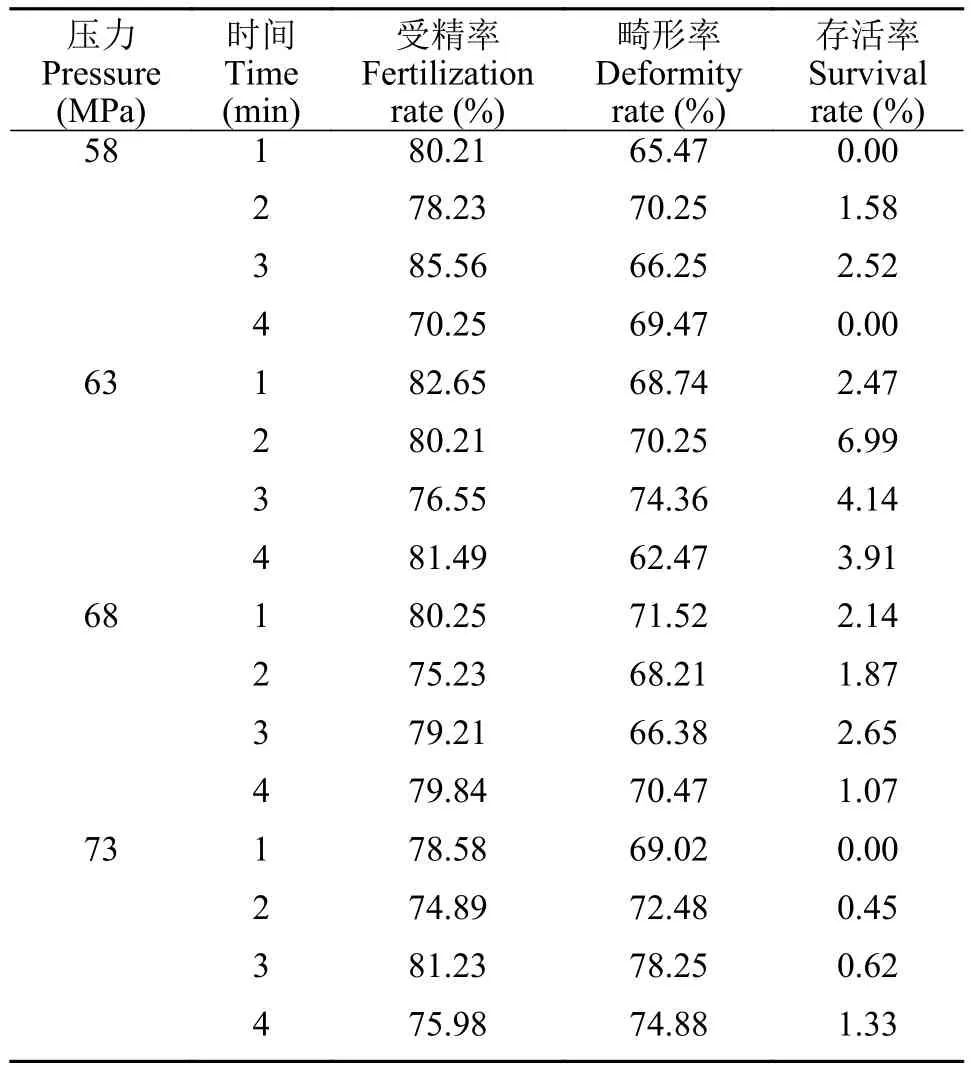
表1 不同静水压强度及不同持续处理时间的受精率、畸形率和存活率Tab. 1 Fertilization rate, deformity rate and survival rate of different hydrostatic pressure intensity and different durations
2.4 最优受精时间及静水压持续时间诱导雌核发育的效果
3尾雌鱼卵子每尾3等份, 分别与3尾雄鱼未灭活的精子受精(对照组1)、灭活的精子受精(对照组2)、灭活的精子受精5min后63 Mpa静水压持续处理2min诱导雌核发育(实验组)。统计9组受精卵的受精率、畸形率和存活率, 对组间数据进行单因素方差分析和两两比较的结果见下表(表 2)。首先从受精率上看, 3组间均无显著性差异(P>0.05); 对照组1和另外两组之间的畸形率均具有显著性差异(P<0.05), 对照组2和实验组之间的畸形率无显著差异(P>0.05); 3组之间的存活率两两比较均具有显著差异(P<0.05)。48h时出膜的畸形鱼苗与正常鱼苗的形态观察如图 3所示, 图 3A中箭头均显示卵子与未灭活的精子受精发育的正常鱼苗; 图 3B中黑色箭头显示单倍体畸形的鱼苗, 身体扭曲、尾巴粗短、眼睛体节显示不清, 具有明显的单倍体综合征;图 3B中白色箭头显示雌核发育二倍化的胚胎, 体型与正常发育的对照鱼苗相似。
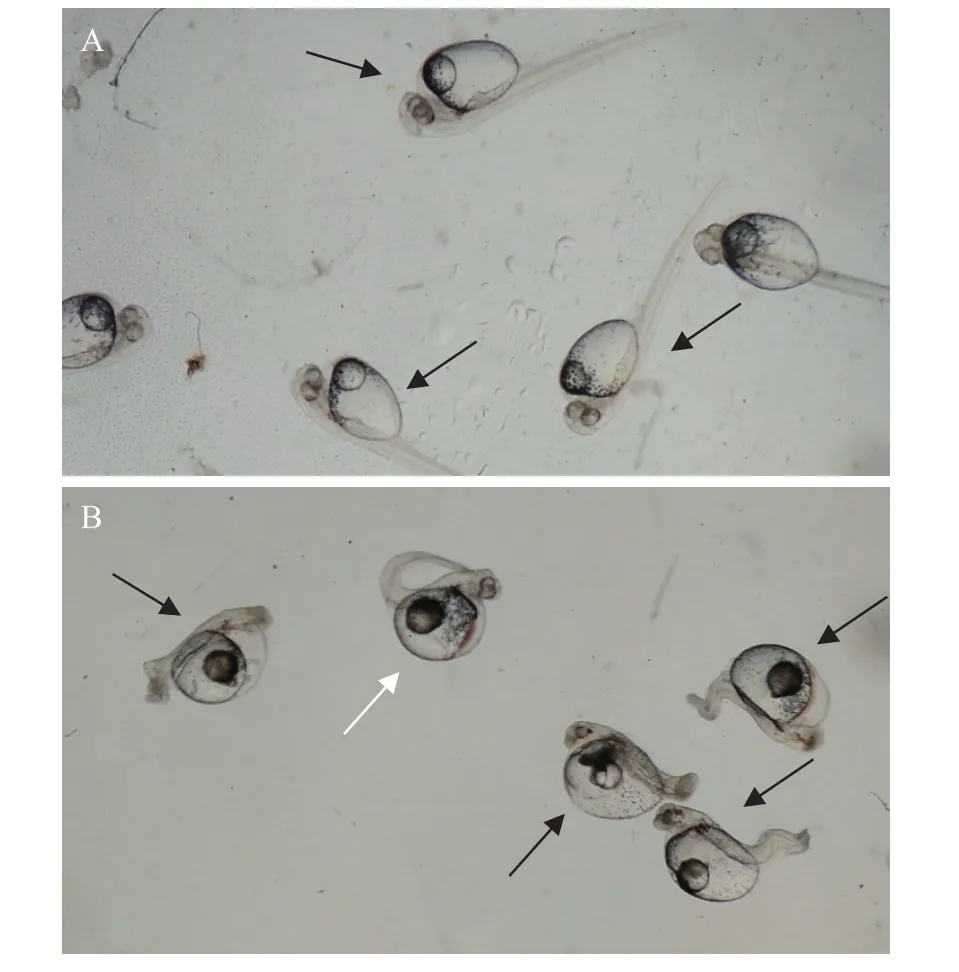
图3 正常鱼苗与畸形鱼苗的形态观察Fig. 3 Morphological observation of normal and abnormal fries
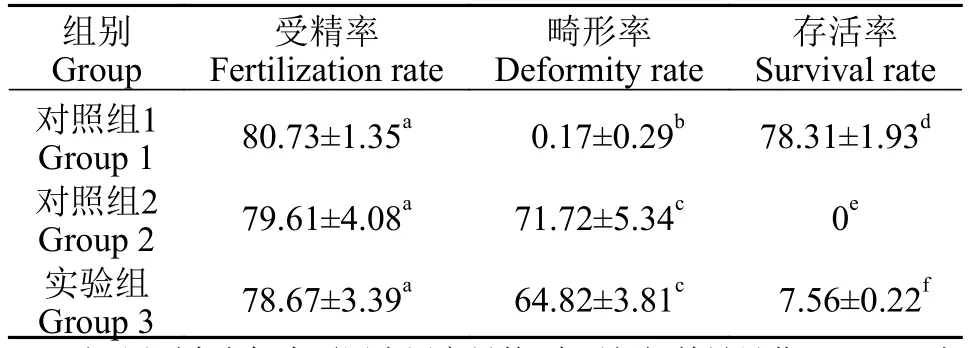
表2 对照组与最优诱导条件下受精卵的受精率、畸形率和存活率比较Tab. 2 Comparison of fertilization rate, deformity rate and survival rate of fertilized eggs between control group and optimal induction condition (%)
2.5 雌核发育个体的性别鉴定
图4显示了36尾个体的溶解曲线, 从图中可以看出, 雌性和雄性个体明显区分为2个部分: 33尾雌性个体(30尾雌核发育个体和3尾雌性亲本)和3尾雄性亲本。结果显示我们随机选择的30尾雌核发育个体全部为雌性, 雌性率为100%, 说明本研究探索的翘嘴鳜静水压诱导参数是有效的。
3 讨论
本文对静水压诱导翘嘴鳜雌核发育进行了初步研究, 获得了静水压诱导翘嘴鳜雌核发育的最优参数。该方法简单快捷, 诱导孵化率(受精后72h的存活率)达到7.56%。
该方法流程为: 翘嘴鳜卵子与紫外灭活的精子受精5min, 于63 Mpa静水压下持续处理2min, 孵化桶中常规孵化。整个过程与目前一般使用的冷休克法的处理时间15—45min相比, 优势较明显, 如已报道的翘嘴鳜的最合适冷休克时间为30min[14], 红鲤的冷休克时间为30min[15], 草鱼为15—20min[3,16],牙鲆(Paralichtys olivaceus)为45min[17]。与一般使用的热休克的处理时间1—3min相比, 则时间相当,导稀有鲫(Gobiocypris rarus)的热休克时间为1—3min[16], 锦鲤(C. carpiod)为1min[18], 鲢(Hypophthalmichthys molitrix)为1min[19]。
该方法的诱导孵化率为7.56%, 与余锐等[14]报道的冷休克方法诱导翘嘴鳜雌核发育的孵化率(4.72%)相比较高, 这可能是静水压诱导与温度休克法诱导相比, 对受精卵伤害相对较小的原因, 这在楼允东等报道的虹鳟中也得到证实[20]。但与其他几种鱼类雌核发育的孵化率相比则偏低, 如半滑舌鳎(Cynoglossus semilaevis)的孵化率为8%[21], 牙鲆的孵化率为13.7%[22], 大黄鱼(Larimichthys crocea)的孵化率为45.5%[23]。各鱼类之间诱导孵化率的差异较大, 这一方面可能与每种鱼类精子和卵子的敏感性或抗逆性有关。在一般鱼类的雌核发育中, 温度或压力诱导等都是利用了一种亚致死的条件来抑制第二极体的排出, 处理时间加长或强度太大均会导致胚胎畸形或死亡, 处理时间缩短或强度太小则无效果。本研究对翘嘴鳜的精子灭活时间、静水压处理前受精时间、静水压强度和持续处理时间都进行了梯度实验, 并未获得更高的孵化率, 因此推测翘嘴鳜的卵子或精子的抗逆性可能比其他鱼类低。
另一方面, 各研究者对每种鱼雌核发育后孵化率的统计时间点并不一致, 这可能也导致了孵化率之间的差异。本研究在对静水压诱导翘嘴鳜受精卵的观察中发现, 受精卵在约40h出膜后仍然有较多的畸形鱼苗陆续死亡, 我们统计诱导孵化率的时间在受精后72h, 此时鱼苗的存活率已经相对稳定。而半滑舌鳎中雌核发育8%孵化率的统计时间是原肠胚时期[21], 大黄鱼中45.5%孵化率的统计时间则是在受精后60h[23], 翘嘴鳜中4.72%和牙鲆中13.7%孵化率的统计时间未明确说明[14,22]。因此,我们推测雌核发育诱导孵化率的高低可能与不同物种本身精子和卵子的抗逆性有关, 此外也可能与孵化率的统计时间点有关。

