温度对池蝶蚌雌雄同体和性逆转的影响
徐红琴 马慧妹 曾 起 胡蓓娟 盛军庆 洪一江
(1. 南昌大学生命科学学院, 南昌 330031; 2. 江西省水产动物资源与利用重点实验室, 南昌 330031)
在池蝶蚌(Hyriopsis schlegelii)养殖过程中发现, 成熟池蝶蚌中雌蚌比例偏高。这种现象在其他贝类中也普遍存在, 例如如马氏珠母贝Pinctada martensi, 雄蚌先熟, 随着贝龄的增加, 比例逐渐减少, 三龄之后, 雌蚌比例占优势[1,2]。在贝类性腺发育过程中, 发生了一定程度的性逆转。在无脊椎动物软体动物门中的雌雄同体现象也有不少报道, 如在牡蛎Saccostrea echinata[3]、栉孔扇贝Chlamys nobilis[4]、虾夷扇贝Patinopecten yessoensis[5]、马氏珠母贝[6]、菲律宾蛤仔Ruditapes philippinarum[7]和池蝶蚌[8]等贝类中发生雌雄同体或者性逆转现象, 且以海水贝类雌雄同体现象为主要报道, 淡水贝类雌雄同体现象目前有扭蚌Arconaia lanceolata[9]、褶纹冠蚌cristaria plicata[10]和池蝶蚌[8], 研究都不深入, 关于雌雄同体现象或性逆转发生的机制仍不清楚。
物种的性别可以通过两种方式来决定[11,12]: 基因(基因型性别决定或Genotypic Sex Determination,GSD), 即受精时染色体的组成决定了物种的性别;环境(环境性别决定或Environmental Sex Determination, ESD), 即胚胎发育过程中遇到的外在条件决定了物种的性别。但是即使都是GSD型, 不同物种的性别决定机制仍存在很大差异。如, 哺乳动物通过Sry(Sex-determining region on Y)[13,14]调控Sox9(Sry-box 9)与促进雌性发育的Wnt/β-catenin相互抑制共同决定个体的性别[15], 其中能独立决定雌性性别发育的Foxl2[16], 也与Sox9存在抑制作用[17]; 黑腹果蝇通过性染色体与常染色体的比例(X∶A)决定性别: 当X∶A≥1时, 机体释放雌性遗传信号激活Sxl(Sex lethal)[18]表达蛋白,Tra(Transformer)mRNA前体与之结合后发生雌特异性的可变剪接,激活Dsx(Doublesex)发生雌特异性剪接, 表达出雌特异DSX蛋白, 个体发育为雌性[19]。当X∶A=0.5时,机体释放雄性遗传信号,Sxl和Tra均未活化,Dsx直接发生雄特异性剪接, 表达雄特异DSX蛋白, 个体发育为雄性[20]; 秀丽隐杆线虫通过性染色体的数量决定性别: XO(1条X染色体)个体释放雄性遗传信号激活Her-1(Hermaphrodization)表达蛋白, 抑制Tra-2的表达, 激活雄性性别决定必需基因Fem(Feminization)[21]表达FEM蛋白, 抑制Tra-1后又进一步激活DM域转录因子的表达, 发育为雄性。XX个体Her-1不表达蛋白,Tra-2被激活[22], 抑制Fem表达[23],Tra-1被激活[24], 表达TRA1蛋白抑制DM域转录因子转录, 促进卵巢的发生, 发育为雌雄同体[25,26]。ESD型物种决定性别的方式也很多样, 其中比较普遍的是ESD中的TSD型(Temperature Sex Deterination), 如爬行动物[27]。
于非非等[28]曾探讨过双壳类的性转换现象及其机理, 认为影响双壳类性别转换的关键因素在于基因和环境因素(营养条件、水温、群体性别构成)两个方面, 但双方在双壳类性别转换中的主导地位, 有待于进一步研究。已知温度能增加贝类第一次性腺分化和配子发生的动力学[29], 影响淡水贝类的配子发育[30]。本文探究了温度对池蝶蚌雌雄同体和性逆转的影响, 结合性别相关基因的表达变化, 说明温度对池蝶蚌生殖滤泡的分化有影响, 并且可能是通过影响Dmrt1等性别决定相关基因的表达发挥作用。
1 材料与方法
1.1 实验动物
池蝶蚌取自于江西省抚州市南城县池蝶蚌良种场。
雌雄同体蚌筛选材料(表 1): 2017年5月繁育的26—32月龄雌雄蚌(取样时间为2019年7月—2020年1月)、2018年5月繁育的26、29—31月龄雌雄蚌(取样时间为2020年7月、10—12月)和2020年5月繁育的6月龄雌雄蚌, 共960只(表 1)。
温度刺激实验材料: 2018年5月繁育的26月龄雌雄蚌, 雌、雄蚌各45只; 2019年6月繁育的13月龄雌雄蚌, 雌、雄蚌各40只。
时空表达实验材料: 分别是2017年5月繁育的27—32月龄雌雄蚌, 每月定期取样1次, 共6次, 每次雌、雄蚌各9只; 胚胎及2019年6月繁育的1—7月龄蚌, 每月定期取样一次, 共8次, 每次30—50只。
Dmrt1原位杂交: 6月龄雌雄蚌、31月龄雌雄同体蚌。
1.2 雌雄同体蚌筛选及其发育跟踪观察
2019年7月17日开始逐月筛选雌雄同体蚌,2020年11月20日结束筛选。2019年10月10日抽样观察233只29月龄蚌, 获得20只雌雄同体蚌。其中10只刻字标记(编为1—10号), 每月跟踪观察一次, 2020年7月结束, 共4次; 2020年10月04日—2020年10月05日抽样观察190只29月龄蚌,获得8只雌雄同体蚌, 刻字标记(编为11—18号),每月跟踪观察一次, 2020年12月结束, 共2次;2020年11月06日—2020年11月07日抽样观察150只30月龄蚌, 获得1只雌雄同体蚌, 刻字标记(编为19号), 每月跟踪观察1次, 2020年12月结束,共1次。
1.3 温度刺激
基地抽取池蝶蚌性腺, 镜检分雌雄, 各自编号标记, 带回实验室, 室温暂养1周。准备两套相同的养殖系统, 一套养殖系统内包含4口小缸, 长48 cm、宽30 cm、高40.5 cm (SUNSUN HE-480桌面小鱼缸)和1口大缸, 长60 cm、宽35 cm、高40 cm, 4台鱼类专用冷水机、2个加温棒和10个增氧石(统一开到最大, 控制溶氧量)。置水(4个蚌5 L水, 32个蚌40 L水, 大约在小缸的高27.8 cm处, 42个蚌52.5 L水, 大约在大缸的高25 cm处, 控制养殖密度), 另一套换水备用。设置5个温度梯度: (15±1)℃、(19±1)℃、(23±1)℃、(27±1)℃和(31±1)℃(池蝶蚌养殖水域最低温为1月份10℃左右, 最高温为繁殖季节30℃左右[31])。将170只蚌分为5组, 每小组的蚌数和蚌号如表 1。在温度刺激30d后, 13月龄的第22号雌蚌、26月龄的第26号雄蚌、26月龄的第10、第12、第20、第21、第30号雌蚌死亡。
1.4 总RNA提取
TRIzol法提取。在时空表达材料中, 大龄蚌每次3只蚌1组混样(雌雄分开), 小龄蚌每次10—15只混样, 平行混3组; 在温度刺激材料中, 存活的同温度蚌2只蚌1组混样(雌雄分开), 每个温度约3个平行组; 在雌雄同体材料中, 29月龄和31月龄的雌雄同体蚌单只蚌成组。在每只蚌开壳后, 剪开内脏团表皮, 从中间部位夹取适量性腺颗粒, 置于加入RNAiso Plus裂解液的离心管内, 过液氮, 研磨仪研磨, 氯仿分离总RNA, 异丙醇沉淀, 75%的无水乙醇洗涤,DEPC水溶解。
1.5 qRT-PCR
根据已克隆出来的Tra2a、Fem1b、Fem1c、Sox9、Dmrt1和Foxl2六个基因的 cDNA, 使用 Oligo7.0 软件设计qRT-PCR引物(表 2)。采用2-ΔΔCt法,以β-actin基因作为内参基因评估结果。
1.6 HE染色
将温度刺激的蚌取性腺组织分块。14月龄蚌取部位1、2和3进行HE染色(qRT-PCR检测部位4,图 1A); 27月龄取部位1、2、3、4和5进行HE染色(qRT-PCR检测部位6, 图 1B)。同时镜检2020年筛选的9只雌雄同体蚌, 将仍有同体现象的16号、18号、19号31月龄雌雄同体池蝶蚌性腺分8块(参照本实验室前期分块方法[32], 如图 1C和1D, 部位7用于原位杂交分析), 并随机挑选12只6月龄小蚌,性腺组织对半分2块。
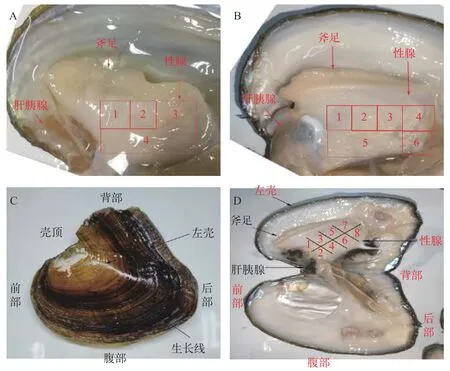
图1 池蝶蚌性腺组织分区Fig. 1 Gonadal tissue division of H. schlegelii
中性通用型组织固定液固定24h以上, 无水乙醇梯度脱水, 纯二甲苯透明, 石蜡包埋(6月龄蚌的性腺全部包埋在同一蜡块内)。切片厚度6 μm, 二甲苯脱蜡, 乙醇梯度复水, 蒸馏水流洗(用于原位杂交的切片烘干备用, 不进行下一步的染色), 苏木精染色, 1%盐酸99%乙醇分化, 3%氨水返蓝, 乙醇梯度脱水, 曙红染色, 无水乙醇脱水, 二甲苯透明, 中性树脂封片, 烘干, 镜检。
1.7 Dmrt1原位杂交
构建带有EcoRⅠ酶和XhoⅠ酶切位点的pET-32a-Dmrt1重组质粒(表 2), 将生工测序正确的菌液提取重组质粒为cDNA模板, 设计探针引物(表 2),克隆目的序列并回收PCR产物为制备探针模板, 按照T7 High Efficiency Transcription Kit (Tranagen,Beijing)试剂盒的说明将dNTP Mix换成地高辛标记的RNA Labeling Mix, 合成探针后立即按照Easy®RNA Purification Kit说明书纯化, 并稀释至0.5—2 μg/mL备用。

表2 本实验所用引物序列Tab. 2 Primers used in this study
取6月龄雌、雄蚌, 31月龄雌雄同体蚌(部位7),中性通用型组织固定液(含有1/1000 DEPC)固定1.5h, 常规脱水, 包埋。切片厚度6 μm, 常规脱蜡,复水, 烘干, 组化笔圈住组织, mRNA核酸片段暴露,预杂交, 杂交, 封闭, 孵生物素化鼠抗地高辛, SABCAP和BCIP/NBT显色, 充分水洗, 封片。
2 结果
2.1 雌雄同体池蝶蚌筛选和跟踪观察
本实验室前期已在26—32月龄发现雌雄同体池蝶蚌[32], 本研究两年内不断地对6月龄和26—32月龄池蝶蚌性腺进行雌雄同体现象筛选, 并将筛选出的雌雄同体蚌定期跟踪观察, 结果显示池蝶蚌在6、28和29月龄较容易出现雌雄同体现象(表 3), 且雌雄同体蚌在发育至30月龄左右向不同性别分化:77.8%分化为雄蚌、16.7%维持雌雄同体现象和5.5%分化为雌蚌(表 4和图 2)。
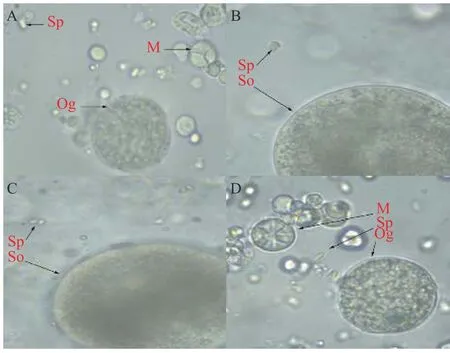
图2 跟踪观察的雌雄同体蚌Fig. 2 The regular observation of hermaphroditic H. schlegelii
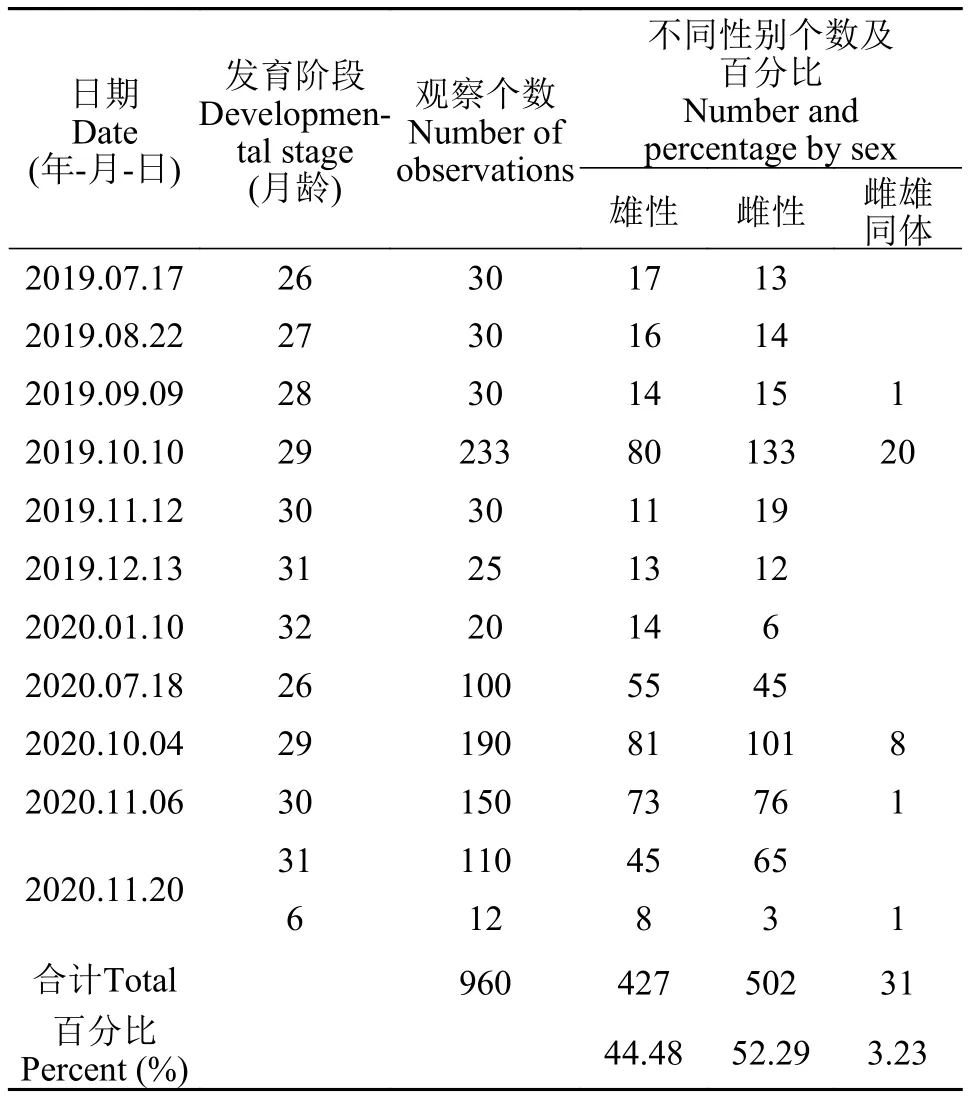
表3 雌雄同体蚌筛选情况Tab. 3 The screening situation of hermaphrodite H. schlegelii

表4 雌雄同体蚌跟踪观察Tab. 4 Tracking observation of hermaphrodite H. schlegelii
2.2 温度影响池蝶蚌雌雄生殖滤泡分化
本研究对随机筛选的6月龄蚌和已镜检确定的31月龄雌雄同体蚌性腺组织切片观察, 结果显示6月龄蚌出现雌雄同体现象, 雌性生殖滤泡占70%,雄性生殖滤泡占30%(图 3A—C); 31月龄雌雄同体蚌内出现三种生殖滤泡: 雌性生殖滤泡、雄性生殖滤泡和雌雄生殖细胞共存滤泡(图 3D—F), 同时发现其内的雄性生殖滤泡有向雌性生殖滤泡转分化的趋势(图 3G—J), 初步认定筛选到的28月龄雌雄同体蚌(9月份)可能由雄蚌变化而来。结果表明池蝶蚌生殖滤泡具有多能性, 性腺中雌雄同体现象有三种产生方式: 一个个体中同时分化出雌和雄两种生殖滤泡、一个生殖滤泡中同时分化出雌和雄两种生殖细胞、雄性生殖滤泡转分化为雌性滤泡的过渡阶段。
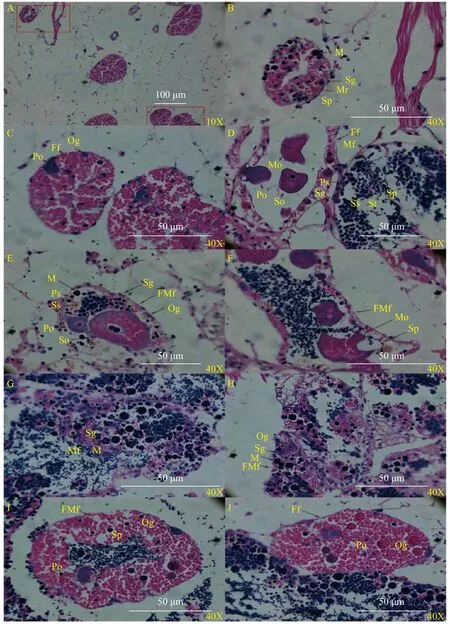
图3 池蝶蚌性腺发育期间的雌雄同体现象Fig. 3 Hermaphroditic phenomenon during development of H. schlegelii
另一方面, 本研究利用32℃、27℃、23℃、19℃和15℃五个温度诱导13、26月龄雌和雄蚌生殖滤泡分化, 30d后, 切片结果显示(图 4): 32℃诱导,14月龄雄蚌出现12.5%雌雄同体现象; 27℃诱导,14月龄雄蚌和27月龄雄蚌分别出现37.5%和12.5%性逆转; 23℃诱导, 14月龄雌蚌出现14.29%性逆转; 19℃诱导, 14月龄雌蚌出现25%性逆转。不包括死亡的蚌。
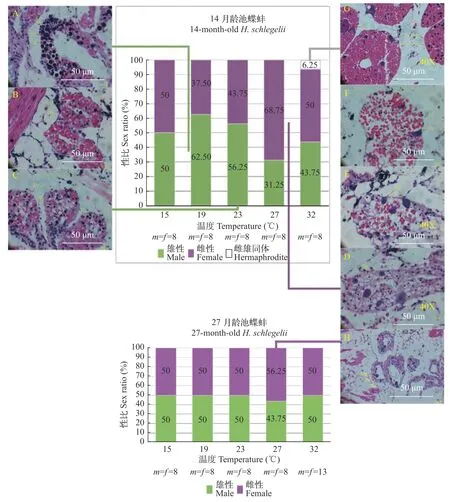
图4 14、27月龄池蝶蚌在5个温度(15℃、19℃、23℃、27℃和32℃)下的性比柱状图Fig. 4 Histograms of sex ratio of 14-month-old and 27-month-old H. schlegelii at five temperatures (15℃, 19℃, 23℃, 27℃ and 32℃)
以上结果表明, 池蝶蚌生殖滤泡在4月龄—37月龄具有多能性, 温度影响其分化: 27℃及以上的高温容易诱导雄蚌向雌蚌逆转或产生雌雄同体现象, 23℃及以下的低温容易诱导雌蚌向雄蚌逆转。且性腺发育早期受温度影响更大。
2.3 池蝶蚌性别调控机制的初步探究
本研究利用qRT-PCR技术检测池蝶蚌胚胎、1—7月龄内脏团及27—32月龄雌、雄蚌性腺内Tra2a、Fem1b、Fem1c、Sox9和Dmrt1五个基因的时空表达水平, 结果显示:Tra2a、Fem1b、Fem1c和Sox9四个基因在1—7月龄的mRNA水平与胚胎期相比没有明显变化, 但是Tra2a、Fem1b和Fem1c三个基因的mRNA水平有相同的变化趋势, 而Sox9基因在5月龄内脏团内, 呈现与之相反的表达趋势(图 5)。同时Tra2a、Fem1b、Fem1c和Sox9四个基因在27—32月龄的雌、雄蚌中均有表达, 其中Tra2a和Sox9在雄蚌中表达高于雌蚌。并且Tra2a、Fem1b和Fem1c三个基因在雌、雄蚌中的表达趋势一致, 而Sox9基因在27—30月龄的表达趋势与三者一致, 31、32月龄的表达趋势与三者相反(图 6)。这说明Fem1b和Fem1c的时空表达趋势基本一致, 与Tra2a大体一致, 在5、32月龄与Sox9相互抑制。
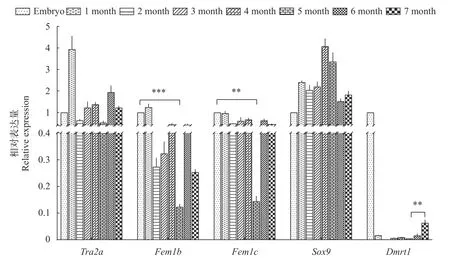
图5 池蝶蚌胚胎以及1—7月龄内脏团内性别决定相关基因的mRNA表达水平Fig. 5 mRNA expression levels of sex-determining related genes in embryo and visceral mass of H. schlegelii at 1—7 months of age
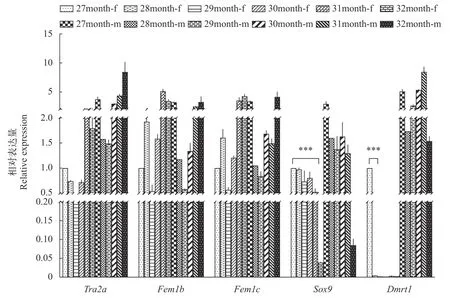
图6 27—32月龄池蝶蚌性腺组织内性别决定相关基因的mRNA表达水平Fig. 6 mRNA expression levels of sex-determining related genes in gonad of H. schlegelii at 27—32months of age
另一方面Dmrt1基因在1—7月龄的mRNA水平与胚胎期相比, 1—5月龄基本上不表达, 直到6、7月龄才开始表达量有显著性上升, 并且在27月龄雄蚌中表达高于雌蚌, 之后在28—32月龄的雄蚌中特异性表达。这说明Dmrt1基因可能与原始生殖细胞的分化以及雄蚌的发育有关。
本研究利用qRT-PCR技术检测13、26月龄雌和雄蚌性腺在15℃、19℃、23℃、27℃和32℃五个温度刺激下Tra2a、Fem1b、Sox9、Dmrt1和Foxl2五个基因的表达水平, 结果显示(图 7): 不同发育阶段的雌、雄蚌的Tra2a、Fem1b和Sox9三个基因在不同温度下的变化趋势总体上一致; 不同发育阶段的雌、雄蚌的Dmrt1基因与Tra2a、Fem1b和Sox9三个基因在15、19和23℃变化趋势相同, 在27和32℃变化趋势不稳定, 但是在27月龄雄蚌中与Fem1b基因变化趋势一致, 与Sox9基因在27和32℃的表达趋势相反; 另一方面, 雄蚌中的Foxl2基因基本不表达, 14月龄的雌蚌的Foxl2与Tra2a、Fem1b、Sox9、Dmrt1四个基因在不同温度下表达趋势基本相反, 但在27℃与Fem1b基因相同; 27月龄雌蚌的Foxl2与Fem1b基因在不同温度下的变化趋势基本一致, 与Dmrt1基因在不同温度下的变化趋势基本相反, 与Tra2a和Sox9两个基因在15、19℃下变化趋势相同, 在23、27和32℃下变化趋势相反。
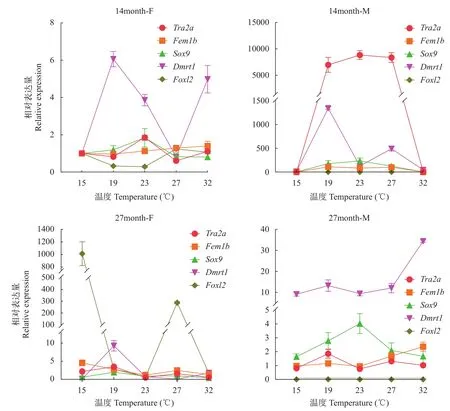
图7 在不同温度刺激下13、26月龄雌和雄蚌性腺内性别决定相关基因的mRNA表达水平Fig. 7 mRNA expression levels of sex-determining related genes in gonad of female and male H. schlegelii at 13 and 26 months of age
本研究利用qRT-PCR技术分别检测29和31月龄雌、雄、雌雄同体蚌性腺内Tra2a、Fem1b、Fem1c、Sox9、Dmrt1和Foxl2六个基因的表达水平, 结果显示(图 8):

图8 29、31月龄雌、雄和雌雄同体蚌性腺组织内性别决定相关基因的mRNA表达水平Fig. 8 mRNA expression levels of sex-determining related genes in gonad of female, male and hermaphrodite H. schlegelii at 29 and 31 months of age
与同期雄蚌比较, 29和31月龄雌雄同体蚌的Tra2a、Fem1b、Sox9和Dmrt1四个基因在开始阶段先全部表达量上升, 之后又下降。与同期雌蚌相比, 31月龄雌雄同体蚌的Foxl2基因的表达量明显降低。
2.4 池蝶蚌Dmrt1 mRNA 在雌、雄、雌雄同体蚌性腺中的细胞学定位
Dmrt1mRNA原位杂交结果显示, 在雄性生殖滤泡精原细胞、桑葚胚结构、精母细胞和精细胞上检测到阳性信号(图 9D), 在雌性生殖滤泡初级卵母细胞上未出现阳性信号(图 9B), 在雌雄同体生殖滤泡成熟卵母细胞上检测到阳性信号(图 9G)。这说明Dmrt1不仅与雄性原始生殖细胞分化有关, 同时与成熟卵母细胞的发育有关。
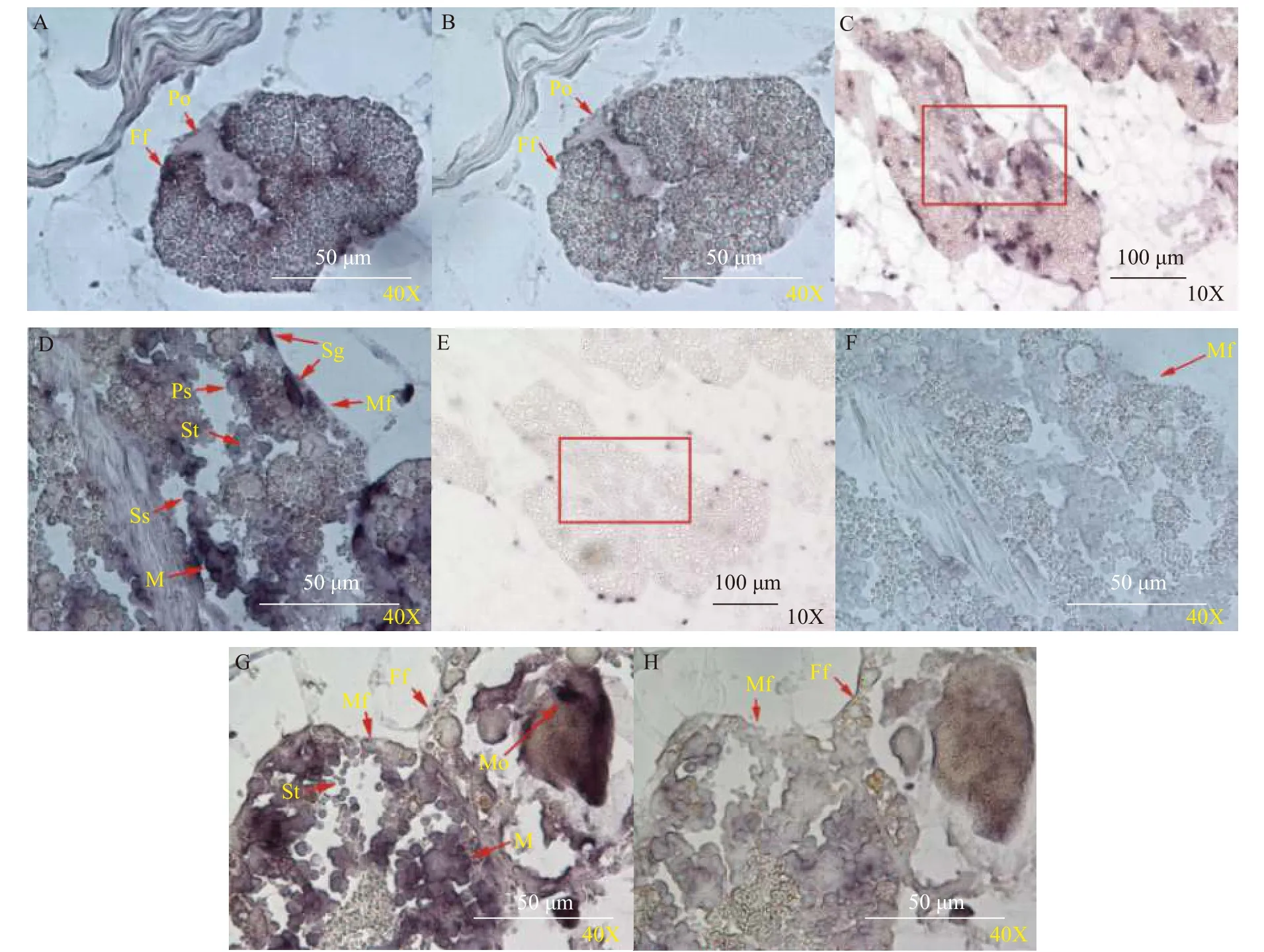
图9 池蝶蚌 Dmrt1 mRNA 在性腺中的细胞学定位Fig. 9 Localization of Dmrt1 mRNA in H. schlegelii gonads at the mature stage demonstrated by in situ hybridization
3 讨论
3.1 温度对淡水贝类性腺发育的影响
本研究中, 在自然条件下, 6月龄蚌(12月份左右)中发现以雌性滤泡为主的雌雄同体池蝶蚌, 说明某些6月龄池蝶蚌在前期性别分化时, 原始生殖滤泡可能优先分化为雌性滤泡, 后期由于持续低温的诱导, 原始生殖滤泡又分化为雄性滤泡, 从而出现雌雄同体现象, 这表明低温可能有利于雄蚌发育;28月龄蚌(9月份左右)中发现雄性滤泡为主的雌雄同体池蝶蚌, 说明某些28月龄池蝶蚌前期是雄蚌,由于持续高温的诱导, 原始生殖滤泡又开始分化出雌性滤泡, 这表明高温可能有利于雌蚌的发育。另外, 本实验室研究人员最开始在26月龄左右蚌内发现雌雄同体现象[32], 与后期研究者在28月龄左右蚌内发现雌雄同体现象有明显的月龄差异[8], 但是因为双方的研究对象分别为秋繁蚌和春繁蚌, 所以均是在历经酷暑的9月份左右发现蚌内出现雌雄同体现象, 这进一步说明雌雄同体蚌的产生需要一定时间以及一定强度的温度刺激。而且温度对池蝶蚌生殖滤泡分化的影响可能比较大, 一方面是因为本文在观察雌雄同体蚌的性腺组织时发现同一个生殖滤泡内能分化出雌雄两种生殖细胞; 另一方面是因为前期分析池蝶蚌雌雄线粒体DNA双重单性遗传时发现没有明显的性别连锁线粒体遗传现象[33]。
因此本文设计了温度刺激实验, 证实了温度影响池蝶蚌原始生殖滤泡的分化, 27℃及以上的高温容易诱导雄蚌向雌蚌逆转或产生雌雄同体现象,23℃及以下的低温容易诱导雌蚌向雄蚌逆转。但是仍然还有一些问题亟须解决, 比如贝类性腺发育的整个生殖周期均会受到温度的影响吗? 所有贝类的性腺均具有分化出两种生殖细胞的潜能吗? 性腺发育受到温度影响的贝类在下一个发育周期是维持影响后的性别还是再次回归原本的性别呢?这些都需要进一步研究。
3.2 温度影响淡水贝类性腺发育的分子机制
温度仅仅只是一种外在刺激, 它能增加贝类第一次性腺分化和配子发生的动力学[29], 但最终影响仍需通过内在性别决定与分化机制级联放大表现出来。本研究检测了池蝶蚌性别决定相关基因(Tra2a、Fem1b、Fem1c、Sox9、Dmrt1和Foxl2)在不同发育阶段以及不同组织中的表达量, 发现Dmrt1在胚胎和6、7月龄表达显著高于其他时期。且Dmrt1mRNA原位杂交在6月龄雄蚌生殖滤泡精原细胞、“桑葚胚”结构、精母细胞、精细胞和发育后期的卵母细胞中检测到阳性信号。这说明Dmrt1不仅参与6月龄雄性生殖细胞的分化, 而且参与在27月龄雌蚌生殖滤泡内成熟卵母细胞的排放。并且在这个时期, 雄蚌内Sox9的表达高于其他时期, 雄蚌内Dmrt1可能与其一起在此时调控DNA甲基化从而调节雄性生殖干细胞的多能性, 因此导致28月龄出现雄性滤泡转分化的雌性滤泡, 如Dmrt1-Sox2级联调节精原干细胞(Spermatogonial stem cells,SSCs)的多能性[34]。另外,Dmrt1在胚胎期表达高可能是因为此时开始发生遗传上的性别决定,开始激活雄性特异性基因的表达, 类似于小鼠性腺分化时Dmrt1的表达变化, 开始在雌雄胚胎的生殖嵴内表达差异不明显, 随着性腺的分化, 雌雄胚胎间Dmrt1表达量发生巨大变化[35]。
在本研究中, 在池蝶蚌性腺中,Fem1b和Fem1c有相同的表达趋势, 且两者在5和29月龄表达均低于其他时期, 说明它们可能行使同一种功能。池蝶蚌内脏团在5月龄时期出现性腺组织, 发育至29月龄时, 性腺组织滤泡数目增多, 体积增大[36],Fem基因在这两个阶段受到抑制, 是否同线虫XX个体发育, 抑制Fem表达, 进而抑制DM域基因表达,卵巢发生, 形成雌雄同体[25,26]。Foxl2为雌性特有,能独立地决定雌性性别发育, 这已经在多种物种中得到证实[16]。本文27℃下的27月龄雌蚌性腺内Foxl2的表达量显著高于其他温度, 说明27℃有利于雌蚌发育。23℃下的14和27月龄雄蚌性腺内Sox9的表达量显著高于其他温度, 19℃下的14和27月龄雌蚌性腺内Dmrt1的表达量显著高于其他温度, 说明19和23℃有利于雄蚌发育, 并且Dmrt1可能参与19℃下诱导雌蚌性逆转的过程。同时在雌雄同体蚌内,Tra2a、Fem1b、Fem1c、Sox9和Dmrt1五个基因都存在先高表达, 再低表达的趋势。总之,这五个基因可能都参与雌雄同体的形成以及性逆转的发生, 并且可能位于多条调控通路上, 因为它们彼此之间没有很明显的表达互抑现象。而Sox9可能在Dmrt1上游, 一方面是Dmrt1启动子上有Sry、Sox5等性别相关转录因子的结合位点[37], 另一方面是凝胶阻滞分析Sox9和Dmrt1两个启动子调控结果, 发现Sox9可能自调控, 也可能调控Dmrt1[38]。
综上, 温度影响池蝶蚌生殖滤泡的分化, 27℃及以上的高温容易诱导雄蚌向雌蚌逆转或产生雌雄同体现象, 23℃及以下的低温容易诱导雌蚌向雄蚌逆转; 并且温度可能是通过调控Dmrt1等性别相关基因的表达量, 从而调节生殖滤泡分化的。

