花斑裸鲤胚胎/仔鱼型血红蛋白基因家族成员鉴定与时序表达研究
王发艳 刘 丹 高 强 晁 燕 聂苗苗 杨朝杰 倪伟琳 王丽晗 祁得林
(1. 青海大学省部共建三江源生态与高原农牧业国家重点实验室, 西宁 810016; 2. 青海大学生态环境工程学院, 西宁 810016;3. 青海大学农牧学院动物科学系, 西宁 810016)
血红蛋白(Hemoglobin, Hb)是承担转运氧气和二氧化碳的功能的必须蛋白, 几乎存在于所有的脊椎动物红细胞(除南极冰鱼类[1])及部分无脊椎动物组织中[2]。脊椎动物的血红蛋白是由2个α-珠蛋白亚基和2个β-珠蛋白亚基组成的四聚体。随着个体发育, 血红蛋白珠蛋白亚基的组成会发生显著的变化, 这种在特定阶段表达特殊的血红蛋白的现象称为血红蛋白的时序转换(Hemoglobin switching)[3—5]。血红蛋白时序转换是一个发展的过程, 涉及多个血红蛋白编码基因的动态转录调控, 该过程与造血系统发育密不可分, 在血红蛋白向组织输送氧气的过程中起着重要作用[5]。
人类血红蛋白包括胚胎型(HbE)、胎儿型(HbF)和成年型(HbA)血红蛋白, 在卵黄囊发育的红系祖细胞中表达HbE血红蛋白[6], 第1次时序转换发生在怀孕后第12周, 胚胎型血红蛋白HbE的表达急剧下调, 直至由胎儿型血红蛋白HbF所取代[7], 第2次血红蛋白时序转换发生在新生儿出生后6周左右, HbF血红蛋白表达水平下降并由成年型血红蛋白HbA所取代[8]。斑马鱼(Danio rerio)胚胎发育早期血红蛋白由7个基因(hbae1、hbae3、hbbe1、hbae4、hbbe3、hbae5和hbbe2)所编码, 称为胚胎/仔鱼型血红蛋白[9,10]。与人类血红蛋白转换表达相似, 斑马鱼胚胎发育早期经历两次血红蛋白时序转换, 即第1次由胚胎型到仔鱼型血红蛋白转换发生在受精后24—36h, 其显著特征是hbbe3基因表达急剧下降而基因开始表达, 仔鱼期hbbe2基因表达显著上升并伴随hbae5基因的表达; 第2次由仔鱼型到成年型的血红蛋白转换发生在受精后22d, 其显著特征是hbbe1/hbae1和hbbe2基因表达持续下降, 开始表达成年型血红蛋白, 直到受精后32d完全建立成年型血红蛋白体系[9,10]。
研究表明, 硬骨鱼类全基因组复制事件促进了硬骨鱼类包括血红蛋白基因家族在内的多个基因家族大量扩增, 导致血红蛋白基因家族的功能多样性, 从而使基因家族成员获得截然不同的生化功能或呈现特异的表达特征[11—13]。裂腹鱼亚科鱼类是伴随青藏高原隆升过程进化形成的一个自然类群,被认为经历了第4轮全基因组复制[14], 研究其血红蛋白家族成员的组成及血红蛋白时序转换具有重要意义。花斑裸鲤(Gymnocypris eckloni)属鲤形目(Cypriniformes)、鲤科(Cyprinidae)、裂腹鱼亚科(Schizothoracinae)、裸鲤属(Gymncypris)[15], 是裂腹鱼亚科鱼类的代表种之一, 对高原缺氧环境有极强的适应性, 但在血红蛋白表达调控方面并无研究报道。研究表明, 花斑裸鲤受精卵在14—16℃水温条件下, 48h形成肌节, 进入器官形成阶段, 96h进入心脏跳动期, 120h开始破膜, 144h破膜结束, 432h卵黄囊消失, 鱼鳍发育较为完全, 初步具备成鱼的体型[16,17]。本文以花斑裸鲤为研究对象, 参照胚胎发育的关键时间节点采集样本[16,17], 利用整胚原位杂交技术研究胚胎/仔鱼型血红蛋白在花斑裸鲤胚胎发育阶段的时空表达转换特征, 为进一步研究血红蛋白时序转换及造血系统发育积累科学数据。
1 材料与方法
1.1 实验用鱼
实验中花斑裸鲤胚胎样品由青海省循化县苏只黄河鱼类人工增殖站提供。
1.2 整胚原位杂交实验试剂与仪器
主要试剂总RNA提取试剂盒(TaKaRa RNAiso Plus)、反转录试剂盒(TaKaRa PrimeSscript RT reagent kit with gDNA eraser)、胶回收试剂盒(TaKaRa MiniBEST Agarose Gel DNA Extraction Kit)、普通PCR反应试剂盒(TaKaRa PremixTaqplus dye); pGEM-T载体(PROMEGA pGEM-T Easy Vector), 质粒DNA提取试剂盒(TIAN Rapid Mini Plasmid Kit); SP6 RNA Polymerase(Roche)、T7 RNA Polymerase(Roche)、Anti-Digoxigenin-AP(Roche)、NBT/BCIP Stock Solution(Roche)、DIG RNA Labeling Mix(Roche), tRNA(Roche)。
主要仪器NanoPhotometer NP80微量核酸蛋白测定仪, NiKon SMZ25体式显微镜。
1.3 花斑裸鲤胚胎/ 仔鱼型血红蛋白基因CDS序列获取
以实验室前期测得的花斑裸鲤基因组序列构建本地数据库(国家基因库生命大数据平台https://ftp.cngb.org/, ID: CNA0035945),以 NCBI 中已公布的斑马鱼胚胎/仔鱼型血红蛋白编码基因hbae1(NM_182940)、hbae3(NM_183066)、hbae4(NM_001082834)、hbae5(NM_001326701)、hbbe1(NM_198073)、hbbe2(NM_212846)和hbbe3(NM_001015058)的CDS 序列为搜索条件(Queries), 通过 TBtools v1.098669软件[18]获取花斑裸鲤胚胎/仔鱼型血红蛋白基因 CDS 序列。
1.4 花斑裸鲤胚胎样品
采样地点位于青海省循化县苏只黄河鱼类人工增殖站, 花斑裸鲤人工繁殖时选择年龄4—8龄、体重400—1400 g、发育良好、无伤无病的雌、雄鱼作为催产的亲鱼。对亲鱼进行称重, 根据体重提前1周注射促黄体素释放激素和多潘立酮。雌、雄鱼分开养殖1周左右, 等待其性成熟后按照雌雄比为3∶1进行人工授精和胚胎孵化[孵化温度为(13±1)℃]。
参照花斑裸鲤胚胎发育研究结果, 采集受精后48h 、72h 、96h、120h、144h、168h、192h、216h、240h、288h、312h、336h、360h、384h、408h和432h的胚胎各两份。1份用4%多聚甲醛(PFA)固定24h后, 在-20℃保存于100%甲醇中, 用于后续整胚原位杂交实验;1份液氮保存, 用于提取RNA。
1.5 探针载体的构建与RNA探针制备
构建探针载体提取花斑裸鲤胚胎样品总RNA, 反转录获得cDNA, 根据已经获得的血红蛋白基因CDS序列设计特异性探针引物, 所有引物由上海生工生物合成(表 1), 以上述cDNA为模板对目的基因进行扩增, 经切胶回收纯化后, 将目的基因连接到pGEM-T载体中, 获得对应重组载体后转入大肠杆菌感受态中, 筛选阳性克隆送至生工生物测序, 测序结果采用NCBI-Blast-2.2.28 +软件(http://www.ncbi.nlm.nih.gov/)中的Blastn命令搜索实验室前期构建的花斑裸鲤基因组本地数据库。取测序正确的质粒提取质粒DNA作为探针合成的模板。

表1 整胚原位杂交探针引物Tab. 1 Primer information used for whole embryo in situ hybridization
体外转录RNA探针反应取10 μg酶切得到的DNA,基因插入方向为正向, 则加入10×buffer B(add BSA)10 μL, Enzyme SacII 5 μL, 最后用DEPC水补充至100 μL; 基因插入方向为反向, 则加入buffer Trago(with BSA)10 μL, EnzymeSpeI 5 μL, 最后用DEPC水补充至100 μL。37℃孵育2h, 1.0%的琼脂糖凝胶电泳检测孵育结果, 后测定浓度以用于RNA 探针制备。
取1 μg孵育的DNA, 加入10×transcription buffer 2 μL, DIG-RNA labeling 2 μL, RNase inhibitor 1 μL, polymerase(正向为T7 polymerase, 反向为SP6 polymerase)5 μL, 用DEPC水补充至20 μL。短暂低速离心后封口膜封口, 37℃水浴2h后, 加入2 μL RNase free DNase, 37℃加热15min, 加入适量的LiCl和预冷的无水乙醇, 将上述反应液在-20℃保存过夜。将反应液从-20℃取出后4℃、12000 r/min离心30min, 去除废液, 加入1 mL冰预冷的70%乙醇, 上下颠倒混匀, 使沉淀悬浮, 离心弃废液, 管底是一层白色沉淀, 超净工作台干燥后加入55℃预热的DEPC水, 轻弹溶解, 获得反义RNA探针, 正义探针的合成需要相反的酶。琼脂糖凝胶电泳检测探针质量后保存于-80℃。
1.6 整胚原位杂交实验
整胚原位杂交方法参考文献[19, 20], 显色后用70%酒精洗涤3次, 每次30min, 去除背景颜色。显微镜下观察结果, 采集图像, 更换新的70%酒精, 避光保存于-20℃。
2 结果
2.1 花斑裸鲤胚胎/仔鱼型血红蛋白基因 CDS序列
通过本地数据库搜索, 鉴定到花斑裸鲤5个胚胎/仔鱼型血红蛋白基因, 包括3个α-珠蛋白基因:hbae1、hbae4和hbae5, CDS序列全长分别为432、426和432 bp, 分别编码143、141和143个氨基酸;2个β-珠蛋白基因hbbe1和hbbe3, CDS序列全长分别为444和441 bp, 分别编码147和146个氨基酸。搜索结果中没有发现花斑裸鲤基因组中与斑马鱼hbae3和hbbe2基因同源的序列。将鉴定得到的花斑裸鲤胚胎/仔鱼型血红蛋白氨基酸序列与斑马鱼中对应基因的氨基酸序列进行同源性比对, 结果显示两个物种α-珠蛋白hbae1、hbae4及hbae5基因的氨基酸序列同源性分别为88.11%、87.23%和79.02%, β-珠蛋白hbbe1和hbbe3基因的氨基酸序列同源性为82.99%和 79.59%。
2.2 探针的合成效果与特异性验证
将阳性克隆测序结果与花斑裸鲤基因组的本地数据库进行比对发现, 扩增片段与目的片段完全一致, 提取质粒DNA后进行酶切, 得到探针模板用于制备整胚原位杂交实验正、反义探针。
2.3 花斑裸鲤胚胎型血红蛋白基因在胚胎发育中的整胚原位杂交表达
hbae1与hbae4、hbae5、hbbe1和hbbe3核酸序列相似性为30.79%、28.29%、34.54%和32.38%;hbae4与hbae5、hbbe1和hbbe3核酸序列相似性为34.03%、38.65%和36.13%;hbae5与hbbe1和hbbe3核酸序列相似性为34.54%和37.9%;hbbe1和hbbe3核酸序列相似性为35.08%。
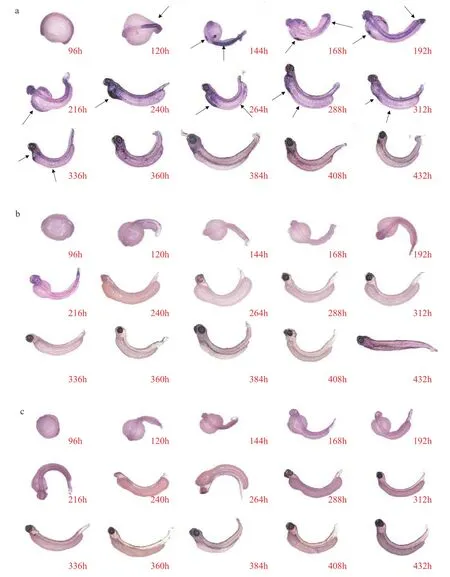
整胚原位杂交结果显示,hbae1基因(图 1a)在花斑裸鲤胚胎受精后120h开始表达, 杂交信号持续表达至受精后432h, 在192—288h期间杂交信号最为强烈, 后呈下降趋势。hbae4基因 (图 1b)与hbae5基因(图 1c)在整个胚胎发育阶段未观察到杂交信号。hbbe1基因(图 1d)在花斑裸鲤胚胎受精后96h开始表达, 杂交信号持续表达至受精后432h, 整体表达趋势与hbae1基因相同。hbbe3基因(图 1e)在受精后120—384h内均能观察到杂交信号, 在192—288h期间杂交信号最为强烈, 但相较于hbae1和hbbe1基因,hbbe3基因杂交信号持续时间较短。

图1 花斑裸鲤胚胎/仔鱼型血红蛋白基因整胚原位杂交结果Fig. 1 Whole embryo in situ hybridization results of embryo/larval hemoglobin gene
虽然不同的花斑裸鲤胚胎/仔鱼型基因的表达情况有所不同, 但观察到杂交信号的hbae1、hbbe1与hbbe3基因在胚胎发育阶段的表达位点基本相同。在胚胎发育的96h在胚胎肌节形成初期正中轴处出现杂交信号, 胚胎发育至120h杂交信号迁移至胚胎躯干中央, 发育至144h在胚胎正中轴两侧及位于肾节部位的中央细胞团部位均能观察到杂交信号, 胚胎发育至168h、192h和216h时, 杂交信号随着胚胎造血系统发育转移至胚胎卵黄囊、背主动脉腹侧区(Ventral wall of dorsal aorta,VDA)及尾部造血区(Caudal hematopoietic tissue,CHT), 240h胚胎破膜而出, 在胚胎卵黄部位可以观察到网状的杂交信号, 这种现象一直持续到该基因杂交信号减弱至消失。
3 讨论
脊椎动物在进化早期连续发生两次全基因组复制事件, Amores等[21]研究结果表明硬骨鱼在大约320—400百万年发生了第3次全基因组复制事件,被称为硬骨鱼特异性基因组复制。有研究表明硬骨鱼类在全基因组复制事件中, 一些基因会发生重复复制和删除, 使得胚胎/仔鱼型血红蛋白编码基因的种类和数量在种间存在较大差异[22—24], 例如,青鳉(Oryzias latipes)基因组中拥有9个胚胎/仔鱼型血红蛋白:hbae0、hbae1、hbae2、hbae3、hbae4、hbbe1、hbbe2、hbbe3和hbbe4[25]; 斑马鱼基因组中含hbae1、hbae3、hbae4、hbae5、hbbe1、hbbe2和hbbe3共7个胚胎/仔鱼型血红蛋白[10]; 黄河裸裂尻鱼(Schizopygopsis pylzovi)中共鉴定到4个胚胎/仔鱼型血红蛋白, 分别是hbae1、hbae4、hbbe1和hbbe3[26]。在本研究中, 通过花斑裸鲤基因组数据共鉴定到5个胚胎/仔鱼型血红蛋白, 分别是hbae1、hbae4、hbae5、hbbe1和hbbe3。与斑马鱼相比, 花斑裸鲤基因组缺少hbae3与hbbe2基因, 与黄河裸裂尻鱼相比, 花斑裸鲤基因组中保留了hbae5基因, 因此推测花斑裸鲤在适应高原环境的进化过程当中丢失hbae3与hbbe2基因, 可能与裂腹鱼亚科鱼类第四轮全基因组复制事件后发生的小规模基因删除事件有关。
在斑马鱼胚胎发育的第16个体节期检测到胚胎型血红蛋白hbbe3开始表达, 伴随hbae1、hbae3和hbbe1的表达, 在第1次血红蛋白时序转换时, 胚胎型血红蛋白转换为仔鱼型血红蛋白,hbbe3基因表达水平下降, 而hbbe2基因表达显著上升并伴随hbae5珠蛋白的表达, 第2次血红蛋白时序转换时胚胎/仔鱼型血红蛋白表达水平下降并且转换为成年型血红蛋白[9]。在本研究中, 花斑裸鲤hbae1、hbbe1与hbbe3基因在胚胎器官形成阶段出现杂交信号,表达信号从胚胎期持续至仔鱼期, 且在胚胎向仔鱼转换阶段杂交信号最为强烈, 这与斑马鱼胚胎/仔鱼型血红蛋白基因表达研究大致相似, 说明hbae1、hbbe1和hbbe3基因在花斑裸鲤胚胎发育早期有氧代谢方面发挥了重要作用。斑马鱼仔鱼型血红蛋白编码基因hbae5表达量低且持续时间短[9],在Nefedochkina等[27]的研究发现, 斑马鱼hbae4基因转录水平极低, 仅为hbae5转录水平的2%。在黄河裸裂尻鱼胚胎型血红蛋白转换表达初步研究中, 发现黄河裸裂尻鱼基因组丢失hbae5基因且hbae4基因表达极其微弱[26]。花斑裸鲤胚胎发育过程中并未观察到hbae4与hbae5基因的杂交信号, 由此推测hbae4和hbae5基因可能在裂腹鱼亚科鱼类胚胎发育过程中不发挥生物学功能或出现功能的弱化。与斑马鱼有所不同的是, 在斑马血红蛋白基因家族中hbbe3基因仅在胚胎发育初始阶段高表达, 胚胎破膜后基因表达量下降、杂交信号微弱[9], 而花斑裸鲤胚胎破膜后仍然可以观察到hbbe3基因的杂交信号, 而且表达信号强烈、持续时间较长, 因此, 花斑裸鲤具有与斑马鱼和黄河裸裂尻鱼不同的血红蛋白转换表达特征, 这可能与花斑裸鲤特殊的进化历程和高原环境的适应有关。
在斑马鱼早期胚胎发育过程中, 原始造血有两个起始部位: 前部侧向中胚层(Anterior Lateral Mesoderm, ALM), 这里生成原始髓系细胞; 另一个起始部位时后部侧向中胚层(Posterior Lateral Mesoderm, PLM), 受精后原始造血最先发生于ALM部位, 在受精后18h, PLM部位进一步发育形成中央细胞团结构, 生成红细胞前体并进入血液循环[28]。斑马鱼定向造血起始于VDA区域, 在受精后48h, 定向造血转移至CHT, 在受精后144h定位于生成成熟血细胞的场所肾脏[28]。在本研究中可以观察到花斑裸鲤胚胎早期发育过程中, 杂交信号主要位于胚胎正中轴、胚胎躯干中央、卵黄囊、VDA和CHT部位, 位点与斑马鱼相同, 表明花斑裸鲤造血系统发育可能与斑马鱼相一致。

