浮萍棘尾虫Adss基因克隆及表达载体构建
王 影 范金凤 张 晴 陈 瑛,
(1. 哈尔滨师范大学生命科学与技术学院, 哈尔滨 150025; 2. 哈尔滨工业大学(深圳)土木与环境学院, 深圳 518055)
1956年, Lieberman[1]首次从大肠杆菌菌株中分离得到腺苷酸基琥珀酸合成酶(Adenylosuccinate synthase, 简称Adss), 后续研究发现Adss广泛存在于生物体内, 与不同环境中生存的生命体相适应形成较高的遗传多样性。从细菌到高等哺乳动物腺苷酸基琥珀酸合成酶同源性在40%—60%。NCBI数据库中已登记了约三万种不同生物的Adss基因序列和氨基酸序列, 其中真核生物Adss的共同特征是都含有430—470个氨基酸, 分子量为45—50 kD,而病毒和细菌等非真核生物的Adss长度较短, 约为90—120个氨基酸。1984年, 科学家首次利用同位素标记法在模式动物大鼠体内研究Adss的生物学功能, 发现Adss可以在三磷酸鸟苷(GTP)去磷酸生成二磷酸鸟苷(GDP)的过程中发挥催化作用, 用肌苷酸(IMP)和天冬氨酸(Asp)作为原料合成腺苷酸基琥珀酸, 完成肌苷酸转化为腺苷酸的过程, 是腺苷合成途径最重要的关键酶之一[2,3]。近20年, 各种生物体内Adss的结构特点、功能及其应用也被大量报道[4—13], 其中以Adss作为靶标分子开展的抗生素和抗癌新药研究取得了重要进展。在人肺细胞中Adss的缺失会引起染色体发生变化, 影响遗传物质的正常表达, 导致癌变的产生[14]; 在病原体幽门螺杆菌中Adss以二聚体形式存在时, 具有极强的稳定性, 可以与生活环境高度适应, 对其蛋白结构进行分析可为抑制类药物的研发提供参考[15]。而在原生动物研究领域, Adss同样可以作为抗寄生原虫药物的作用靶标位点, 应用于杜氏利什曼原虫等寄生原虫病的防治[16,17], 在恶性疟原虫嘌呤代谢过程中也有Adss的参与, 抑制Adss的活性可用于抗疟药物的研发[18]。Adss作为生物体内嘌呤合成过程中必需的酶, 在嘌呤核苷酸合成代谢时需要三磷酸腺苷(ATP)帮助, 去调控细胞内核苷酸的平衡[19]。因此, Adss作为一种重要的生物酶, 在生物体内的合成代谢和能量代谢系统中发挥重要的作用。
浮萍棘尾虫(Stylonychia lemnae)是高等自由生原生动物的代表之一, 作为单细胞模型生物物种已经被成功地应用于细胞学、遗传学及毒理学等领域的研究中[20—22]。在研究人表皮生长因子(hEGF)对浮萍棘尾虫二分裂增殖的分子作用机制研究中,发现浮萍棘尾虫Adss基因在hEGF诱导下表达量显著上调, 并与多个细胞分裂相关基因存在关联, 提示该基因可能参与了浮萍棘尾虫细胞分裂和周期的调控过程[23]。因此有必要明确该基因序列和蛋白特征, 以便进一步开展功能和分子机制研究。
本研究在克隆浮萍棘尾虫Adss基因的cDNA全长序列基础上, 详细分析了该基因序列及其编码的氨基酸、蛋白质的生物信息学特征, 以及与其他物种同类蛋白的亲缘关系, 并通过重组质粒构建表达定位载体, 确定Adss蛋白在浮萍棘尾虫细胞中的空间分布, 为后续利用基因工程方法揭示该基因在原生动物中作用机制奠定基础。
1 材料与方法
1.1 实验材料
浮萍棘尾虫准备浮萍棘尾虫(Stylonychia lemnae), 由中国科学院水生生物研究所馈赠, 隶属于纤毛门、多膜纲、下毛目、尖毛科、棘尾虫属[24]。以麦粒浸出液喂食, 在20—25℃的恒温恒湿培养箱中进行大量培养。进行分子实验的前3天, 进行无菌化纯培养和饥饿处理[25]。
主要试剂Taq酶(EasyTaq®DNA polymerase)、T4DNA连接酶、DNA Marker、EcoRⅠ和PstⅠ限制性核酸内切酶和感受态细胞(Trans1-T1 Phage Resistant Chemically Competent Cell)购自北京全式金生物技术有限公司。RNA提取试剂盒(TaKaRa MiniBEST Universa RNA Extraction Kit)和逆转录试剂盒(PrimeScriptTMⅡ 1stStrand cDNA Synthesis Kit)购自宝生物工程有限公司, 普通琼脂糖凝胶DNA回收试剂盒(TIANgel Midi Purification Kit)、pGM-T克隆试剂盒和无内毒素质粒大提试剂盒(DP120)购自天根生化科技有限公司, pEGFPN1质粒(增强型绿色荧光蛋白表达质粒, 所携带的增强型绿色荧光蛋白(Enhanced green fluorescent protein, EGFP), 是一种优化的突变型GFP, 可在细胞内稳定表达, 产生的荧光强度比普通GFP增强约35倍)购自上海吉满生物科技有限公司, Hoechst 33342购自于Solarbio公司, LB培养基和乙醇等其他药品购自上海生工生物工程技术有限公司。
1.2 基因克隆
总RNA提取及cDNA合成吸取悬浮培养的浮萍棘尾虫细胞5000cells于1.5 mL的离心管中,8000×g4℃离心2min, 弃上清。首先根据RNA提取试剂盒操作步骤洗脱获得高质量的RNA, 然后按照逆转录试剂盒操作步骤在Microtube中配制反应混合液: Oligo dT Primer 1 μL, dNTP Mixture 1 μL, 模板RNA 5 μL, RNase free ddH2O 3 μL, 总量为10 μL。首先在65℃条件下保温5min后, 冰上迅速冷却。使模板RNA变性, 提高反转录效率。在上述Microtube管中配制反转录反应液: 上述变性后反应液10 μL, 5×PrimeScript Ⅱ Buffer 4 μL, RNase Inhibitor 0.5 μL, PrimeScript Ⅱ RTase 1 μL, RNase free ddH2O 4.5 μL, 总量为20 μL, 缓慢混合均匀。首先在50℃条件下处理60min, 然后在95℃条件下处理5min, 进行反转录反应。冰上冷却, 产物收于-20℃保存备用。
引物设计与合成根据浮萍棘尾虫基因组数据库(http://stylo.ciliate.org/index.php/home/welcome)中的腺苷酸琥珀酸合成酶基因序列Contig 2018.g2178的序列信息, 依据保守区域的氨基酸序列利用Primer Premier 5.0软件设计引物, 上游引物(Adss-F)为: 5′-GTCTGAGGAACATAGCT-3′, 下游引物(Adss-R)为: 5′-GCATCAAGGCAAGTA-3′, 由北京睿博兴科生物技术有限公司合成。
Adss cDNA的克隆与测序以S. lemnae的cDNA为模板, 用设计的引物Adss-F/Adss-R扩增Adss基因的启动子序列。PCR反应体系: 模板0.5 μL;上、下游引物各0.5 μL; EasyTaq®Buffer 2.5 μL;dNTPs 2 μL; EasyTaq®DNA Polymerase 1 μL;RNase free ddH2O 18 μL, 总量为25 μL。PCR扩增程序: 95℃预变性5min; 95℃变性30s, 退火52℃30s, 72℃延伸30s, 共35个循环; 72℃延伸10min。PCR产物用1.0%的琼脂糖溶液电泳检测, 凝胶成像系统拍照保存, 取鉴定正确的PCR产物依照普通琼脂糖凝胶DNA回收试剂盒操作步骤, 对目的产物进行切胶回收。参考pGM-T克隆连接试剂盒中的说明书将目的基因连接到pGM-T载体上, 转入Trans1-T1感受态细胞中, 通过含有氨苄青霉素的LB固体平板进行抗性筛选, 挑取阳性菌落进行菌落PCR检测, 同时进行LB液体培养基摇菌。选取经菌液PCR检测, 且目标条带大小正确的菌液送哈尔滨博仕生物有限公司进行测序。
1.3 生物信息学分析
使用Prot-Param(http://web.expasy.org/protparam)软件分析Adss蛋白的氨基酸序列、分子质量、等电点及其他相关的理化性质; 通过Signa IP(http://www.cdb.dtu.dk/services/Signa IP/)软件进行蛋白质信号肽的预测; 使用Prot Scale(http://web.expasy.org/protscale/)软件分析Adss蛋白的亲水性和疏水性; NCBI protein BLAST分析, 可获得Adss蛋白的结构域; 用TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)在线软件分析蛋白的跨膜结构域; TASSER蛋白模型(https://zhanggroup.org/I-TASSER/)预测蛋白的二级结构; 运用SWISSMODEL(http://swissmodel. expasy.org/)软件对蛋白序列三级结构进行预测; 利用DNAstar软件包中的MegAlign对Adss蛋白进行多重序列比对和序列相似性分析。
1.4 系统进化树构建
首先在National Center for Biotechnology Information(http://www.ncbi.nlm.nih.gov)数据库中进行BLASTP比对, 选取和浮萍棘尾虫Adss氨基酸序列相似度较高的序列, 进行多重序列比对, 然后进行手工校正, 通过自展(Bootstrap)检验对进化树分支的可信度进行评估。最后, 利用软件MEGA 7.0运用最大似然法ML(Maximum Likehood)构建Adss蛋白的系统进化树。
1.5 Adss基因亚细胞定位表达载体的构建
根据Adss基因起始密码子ATG后的CDS序列内的限制性酶切位点及pEGFP-N1绿色荧光蛋白表达载体多克隆位点的情况, 设计启动子序列扩增引物F/R, 在CDS上下游引物的5′端分别加入EcoRⅠ和PstⅠ两种限制性核酸内切酶的切位点(酶切位点序列用下划线标识)。引物为5′-GAATTCGTCTGAG GAACATAGCT-3′和5′-CTGCAGGCATCAAGG CAAGTA-3′。
以浮萍棘尾虫cDNA为模板, 用设计的引物F/R扩增Adss基因启动子表达序列。PCR扩增体系、PCR运行条件的设置、目的片段回收纯化、连接产物转化、复苏、培养、验证及测序步骤参见上文。使用EcoRI和PstⅠ两种限制性核酸内切同时双酶切pEGFP-N1载体和Adss基因的cDNA片段。酶切体系:Adss或pEGFP-N1载体3 μL, 10×Cutsmart Buffer 5 μL,EcoRI 1 μL,PstⅠ 1 μL, RNase free ddH2O 20 μL, 总量为40 μL。在37℃条件下, 酶切15min。然后用T4DNA连接酶连接, 连接体系:T4DNA连接酶 1 μL, 10×T4DNA Buffer 2 μL, 酶切后pEGFP-N1载体 1 μL, 酶切后AdsscDNA片段3 μL, RNase free ddH2O 3 μL, 总量为 10 μL。 在25℃条件下, 连接10min, 将目的基因Adss启动子区和线性载体的连接产物转化Trans1-T1感受态细胞中, 复苏培养使其形成单菌落。进行菌液PCR鉴定及测序, 测序结果无突变的菌液使用无内毒素质粒大提试剂盒提取重组质粒pEGFP-N1-Adss, 用于转染定位使用。
1.6 重组质粒转染及定位观察
转染方法参考2003年Paschka等[26]的实验方法,通过喂饲法将含有pEGFP-N1-Adss重组质粒的大肠杆菌转进S.lemnae体内, 以pEGFP-N1为空载对照, 同时用Hoechst 33342 (1 μg/mL)进行细胞核染色。转染前1天将细胞接种至六孔板中, 待细胞密度达到30%—40%时进行转染。每孔细胞中加入30 μL的大肠杆菌菌液(A600=0.5), 每24h进行一次补液, 在蔡司荧光显微镜(Axio Imager A2)下观察Adss蛋白的表达分布并采集图像。
2 结果
2.1 Adss基因全长cDNA序列的克隆和分析
以反转录的cDNA为模板, 用引物Adss-F和Adss-R克隆Adss基因启动子序列片段, PCR扩增片段经胶回收、连接转化及测序的序列在NCBI数据库进行BLASTX比对。发现该序列与嗜热四膜虫(Tetrahymena thermophila)和海水派琴虫(Perkinsus marinus)的腺苷酸基琥珀酸合成酶相似度达到50%以上。进一步分析表明, 浮萍棘尾虫Adss基因片段的长度为1396 bp, GC含量占43%。最大开放阅读框为126 bp, 预测分子量约为48.72 kD, 等电点为9.09。
2.2 Adss基因编码氨基酸序列特征
Adss基因编码458个氨基酸, 其中带正电荷氨基酸(K、R)46个, 占10.53%, 带负电荷氨基酸(D、E)39个, 占8.92%, 疏水性氨基酸(A、I、L、F、W、V)152个, 占34.78%, 极性氨基酸(N、C、Q、S、T、Y)133个, 占30.43%, 脂肪族类氨基酸(G、A、V、L、I)151个, 占34.55%, 芳香族类氨基酸(F、W、Y)15个, 占3.43%, 碱性氨基酸(K、R、H)62个, 占14.19%, 酸性氨基酸(B、D、E、N、Q、Z)75个, 占17.16%。亲/疏水性分析结果显示:Adss基因编码的蛋白在1—9、18—31、47—102、115—129、185—189、209—215、231—242、267—279、310—334、376—380和401—410区域为疏水性区域, 在10—17、32—45、104—116、130—139、151—161、165—183、191—202、217—230、245—251、258—265、290—300、335—354、382—400和415—431区域为亲水性区域。不稳定系数为55.19, GRAVY是-0.264, 属于亲水蛋白。信号肽预测结果显示该基因编码的多肽链无信号肽, 未形成跨膜结构域。浮萍棘尾虫属于单细胞生物, 说明该蛋白质属于定位于细胞质基质或细胞器基质中的蛋白质, 不属于膜蛋白或分泌蛋白。
保守结构域分析显示, Adss氨基酸序列包含有一个P-loop NTPase超家族结构域, 也被称为Walker A和Walker B保守基序, 可以与ATP或者GTP结合, 参与细胞的生命活动过程。
同源性分析发现,S.lemnaeAdss基因编码的氨基酸序列与其他纤毛虫Adss的氨基酸序列具有较高的同源性, 与第四双小核草履虫Paramecium tetraurelia、嗜热四膜虫Tetrahymena thermophila、天蓝喇叭虫Stentor coeruleus以及多子小瓜虫Ichthyophthirius multifiliis的Adss氨基酸同源性分别为60.23%、56.84%、56.41%和55.92%。
2.3 Adss氨基酸序列系统发育分析
构建基于Adss氨基酸序列的最大似然树ML(图 1)显示, 浮萍棘尾虫Adss氨基酸序列与草履虫、嗜热四膜虫、多子小瓜虫及天蓝喇叭虫Adss氨基酸序列聚为一簇, 亲缘关系最近。与长双歧杆菌、土星状毛霉以及奥尔森派琴虫等距离较远。
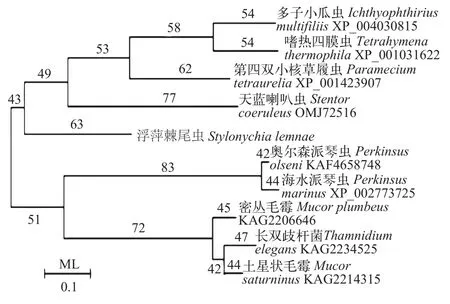
图1 根据不同物种的Adss氨基酸序列构建的最大似然树Fig. 1 Phylogenetic tree inferred from different species of Adss amino acid sequences using ML
2.4 Adss蛋白的空间结构预测
TASSER蛋白模型预测浮萍棘尾虫Adss蛋白二级结构(图 2A), 是由α-螺旋、β-折叠和无规卷曲组成, 分别占比为53.9%、18.1%和27.8%。SWISSMODEL预测浮萍棘尾虫Adss蛋白的空间结构(图 2B),发现其与细胞色素P450结构相似性最高, 这与二级结构分析结果相一致。细胞色素P450是血红素蛋白的超家族, 它存在于所有生物的有机体中, 从细菌、酵母菌、真菌、植物、动物到人体。这种酶的显著特点是能催化多种有机化合物的反应, 并能将有害物质转化为可溶性物质并排出体外[27]。
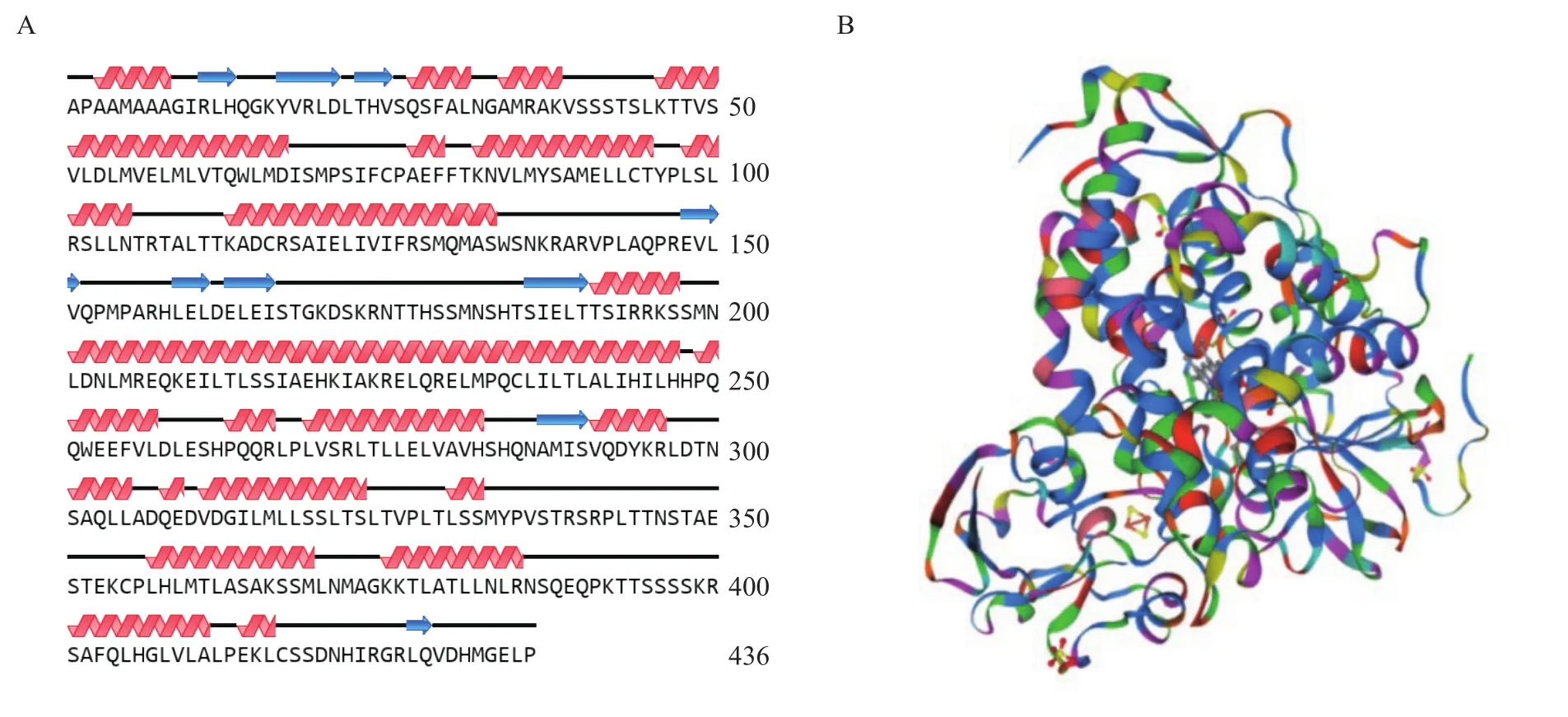
图2 浮萍棘尾虫Adss空间结构预测Fig. 2 Predicted spatial structure prediction of S. lemnae Adss
2.5 Adss表达序列扩增与重组质粒鉴定及亚细胞定位
引物F/R扩增S. lemnaeAdss表达序列片段大小为1408 bp左右, 包括完全编码区1396 bp和两端添加的EcoRI和PstⅠ各6 bp的酶切保护位点。pEGFP-N1-Adss质粒电泳条带大小为6129 bp左右, 结果符合预期。
将构建的重组质粒pEGFP-N1-Adss转染到浮萍棘尾虫中, 观察24h和48h Adss蛋白在虫体内的分布情况(图 3)。结果表明, 转染重组质粒pEGFP-N1-Adss的虫体细胞质中始终有Adss表达, 且48h的荧光表达量(图 3J、3K和3L)强于24h的荧光表达量(图 3G、3H和3I), 但是细胞核上始终没有表达。转入空载质粒pEGFP-N1的虫体中, 细胞核和细胞质中均有明显荧光反应, 但是强度没有随时间发生明显变化, 在24h的荧光表达量(图 3A、3B和3C)高于重组质粒组(图 3G、3H和3I), 48h的荧光表达量(图3D、3E和3F)低于重组质粒组(图 3J、3K和3L)。这说明转入虫体的重组质粒中Adss基因启动子序列使Adss蛋白大量表达在细胞质中。
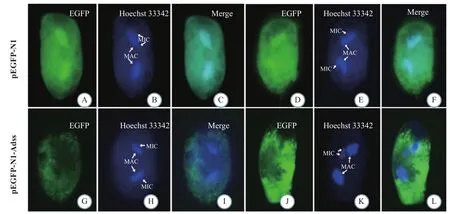
图3 Adss在S. lemnae细胞中的定位(40×)Fig. 3 Intracellular localization of Adss in S. lemnae cells
3 讨论
本研究获得的浮萍棘尾虫Adss蛋白由458个氨基酸组成, 属于典型的真核生物Adss。脊椎动物有两种不同的Adss同工酶, 这两种酶的等电点不同,一种是碱性酶Adss1, 等电点约为6.0, 参与嘌呤核苷酸循环的重要过程, 与糖酵解过程密切相关; 另一种是酸性酶Adss2, 等电点约为8.9, 催化AMP的从头合成, 是反应过程中第一个关键的酶[28]。本研究中预测浮萍棘尾虫Adss蛋白氨基酸组成中的碱性氨基酸有62个, 酸性氨基酸有75个, 含有的酸性氨基酸残基个数较多, 且等电点约为9.09。因此, 其应该属于第二类的酸性酶。
本研究采用构建重组质粒的方法进行Adss蛋白定位检验, 选择了一种增强型绿色荧光蛋白EGFP。由于细胞内部没有EGFP基因, 因此可以通过连接EGFP和靶基因的编码区, 从而通过荧光显微镜观察活细胞中目标蛋白质的表达情况。本研究结果表明这一方法在浮萍棘尾虫目标基因表达定位研究中是可行的。同时发现转染后48h荧光强度高于24h, 提示Adss蛋白表达量随时间推移而升高, 其机制和生理意义还有待研究。本研究确定浮萍棘尾虫的Adss蛋白定位于细胞质, 在人体骨髓细胞和猪肾上皮细胞中Adss2蛋白定位于细胞质的线粒体中[29,30], 浮萍棘尾虫Adss蛋白是否也定位于线粒体还有待进一步确认。
浮萍棘尾虫Adss保守结构域中含有P-loop NTPase, P-loop NTPase结构域是细胞质中蛋白组装的重要组成部分[31], 因此推测浮萍棘尾虫体内Adss在蛋白质加工过程中同样发挥重要作用。已有研究表明Adss蛋白在生物的代谢过程中属于必需酶, 作为关键的调节因子之一, Adss蛋白的定位对于理解蛋白质功能和分子机制具有重要作用。而且, 目的基因Adss启动子序列的克隆及相应表达载体的构建, 也是研究Adss基因启动子区功能以及研究其如何进行转录调控的一个重要内容。
因此, 本研究补充了单细胞真核动物Adss基因序列信息, 并对其基因序列特征、氨基酸序列、蛋白质的理化性质、结构组成和空间结构等进行了描述, 丰富了该基因遗传多样性数据库, 也为进一步揭示纤毛虫Adss基因的功能及作用机制奠定了基础。

