葛仙米血红素氧合酶基因Ns-HO1异源表达及其蛋白结构模拟
黄 卉 陈 莉 汪海洋 方 庆 程 超
(1. 湖北民族大学,恩施 445000; 2. 生物资源保护与利用湖北省重点实验室,恩施 445000)
在生物细胞中, 氧、有机碳环和金属离子三者共同作用能够形成一些特殊的化合物, 并在生命活动中发挥重要的功能。血红素(Heme)是一类含铁原卟啉[Ferro-protoporphyrin (Fe2+)]化合物,在生物组织细胞中广泛分布。据紧邻其四吡咯环外围的基团, 血红素可分为a、 b和c三种不同类型[1]。其中, 在动物细胞中c型血红素以卟啉外围基团共价结合血红蛋白, 对于氧的转运和贮存、细胞能量产生和解毒等具有重要功能; 另一方面, 细胞内游离的血红素却可诱发活性氧进而造成细胞氧化应激损伤[2—4]。因此, 细胞内血红素须受酶促作用调节以维持相对稳定; 而研究血红素及其酶促调节与人体健康和疾病间的关系具有重要意义[4—6]。
血红素氧合酶(Heme oxygenase, HO, 也称血红素氧化酶)能够结合并氧化血红素, 使之转变为胆绿素(Biliverdin, BV), 并释放亚铁离子(Fe2+)和一氧化碳(CO); 该酶是细胞中目前发现的血红素氧化分解的限速酶[7,8]。最初, 人们发现动物体肝脏微粒体中一种介导血红素氧化分解的酶活性较高;2002年, 日本研究人员报道了首个因人类血红素氧合酶基因功能缺失、危害儿童生长发育乃至生命的病理案例, 证实血红素氧合酶HO是抵抗炎症、预防内部组织进一步氧化损伤刺激的重要防御性因子; 随后, 关于生物体中血红素氧合酶HO的结构与功能方面的研究等取得了较多进展[9—11]。目前,在植物等其他生物类群中也发现HO酶的同源基因,这些基因参与植物抵抗外部环境胁迫、种子萌发、气孔开闭及根形态发生等多方面的调节[7,12,13]。
原核生物中一些厌氧菌利用血红素氧合酶来清除多余的氧分[14]。葛仙米(Nostoc sphaeroides),学名拟球状念珠藻, 作为蓝藻纲特殊的原核藻类在湖北恩施地区分布较多, 具有重要的食药性价值;新近研究发现葛仙米是促进水稻作物生产的重要资源藻类[15—18]。伴随经济社会发展, 亟需深入研究和开发葛仙米的生物资源。本研究借助分子生物学等研究方法, 克隆葛仙米血红素氧合酶基因并进行大肠杆菌细胞诱导表达, 对其蛋白进化地位和高级结构进行比较分析。本研究有利于深入了解葛仙米血红素氧合酶基因生物学功能, 并为进一步加强葛仙米资源运用奠定基础。
1 材料与方法
1.1 实验材料和试剂
葛仙米采自湖北恩施鹤峰走马镇(东经118.4°,北纬29.8°)。分子克隆用工具酶、表达载体等分别购于大连宝生物公司(TaKaRa)等公司; PCR用引物由南京金斯瑞公司合成; 克隆与表达大肠杆菌菌株等材料为实验室保存。
1.2 DNA的提取
采用CTAB法提取葛仙米总DNA。取少量样品(2—3团, 约1 mg)置于预冷的研钵中, 加入CTAB抽提缓冲液, 浸润后迅速研磨成糊状, 然后转入EP管中, 于65℃保温; 30min后取出, 冷却后离心,将上清移入新的EP管中, 再加氯仿-异戊醇(24∶1),颠倒混匀, 10000 r/min离心10min, 轻轻吸取上清,加入600 μL异丙醇, 轻轻混匀(可见絮状物), 4℃静置10min后, 12000 r/min 离心10min; 75%乙醇洗涤沉淀并晾干, 溶解并低温贮存样品。
1.3 PCR扩增
据GenBank 中HO1基 因(AP018326)采用BLAST检索葛仙米对应基因组 (Locus, NZ_CP031941) 中同源序列, 分析目的基因序列(区段为53825525383229),设计上、下游引物分别为: 5′-GGCATATGAGTAGTAA TCTAGCCAT-3′; 5′-GAATTCCTAATGAGTTAG GCTATTA-3′; 上下游引物分别设计限制性核酸内切酶位点为NdeⅠ和EcoRⅠ(碱基序列下划线所示).扩增目的基因的PCR反应程序为 95℃ 3min, 95℃30s, 50℃ 30s, 72℃ 45s, 72℃ 5min, 16℃ 10min, 反应循环数设为30。
1.4 克隆目的基因
上述扩增产物进行乙醇沉淀回收。连接反应体系为DNA 1.0 μL, ddH2O 3.5 μL, pMD18-T 0.5 μL,Solution 5.0 μL。16℃连接10h, 取连接产物2 μL进行热激转化法转化大肠杆菌感受态细胞, 挑选中间克隆子并提取质粒和测序鉴定。
1.5 表达载体连接与转化
pCold Ⅰ 载体及中间载体进行酶切反应体系为: 载体 3.0 μL,NdeⅠ 1.0 μL,EcoRⅠ 1.0 μL, 10×H buffer 5.0 μL, ddH2O (含RNase) 40 μL。将上述成分轻轻混匀后, 37℃保温4h, 回收酶切表达载体及目的基因片段, 进行连接反应后转化感受态细胞,再挑选克隆子进行测序等进一步鉴定。
1.6 序列与蛋白结构分析
对目的基因HO1编码蛋白氨基酸序列, 限定Nostoc种属进行序列比对, 包括NCBI (National Center for Biotechnology Information) BLAST和Clustal (https://www.genome.jp/tools-bin/clustalw);采用MEGA分子进化软件构建目的蛋白基于Neighbor-Joining 方法的系统进化树, Bootstrap参数设为1000; 葛仙米Ns-HO1蛋白结构分析采用Swiss-model(https://www.swissmodel.expasy.org/), 基于氨基酸序列相似性确定参比模板, 而后进行分子模拟。
1.7 目的蛋白大肠杆菌诱导表达与检测
将正确的重组质粒导入表达菌株 BL21感受态细胞中, 0.1 mmol/L IPTG 诱导表达 4h, 超声破碎细胞(破碎功率为 66 W, 时间 10s, 重复 3次, 间隔10s),制备表达样品后进行 SDS-PAGE凝胶电泳分析。
2 结果
2.1 目的基因Ns-HO1扩增
提取葛仙米基因组DNA, 并以其为模板进行PCR。 1%浓度的琼脂糖凝胶电泳检测PCR产物。结果如图 1A所示, 目的基因泳道(泳道1)出现扩增单一DNA条带; 参照DNA标准分子量 (泳道M), 扩增DNA大小在500—750 bp, 与预期较符合。将目的基因片段回收并成功与pMD18-T克隆载体连接送出测序。结果显示目的基因密码区全长为678 bp。以上表明, 葛仙米血红素氧合酶基因Ns-HO1克隆成功。
2.2 Ns-HO1基因在大肠杆菌中表达
为进一步研究目的基因Ns-HO1, 我们成功构建了原核细胞表达载体pCold-Ns-HO1. 对转入重组表达载体的大肠杆菌经约4h, 0.1 mmol/L IPTG诱导。而后进行超声细胞破碎处理, SDS-PAGE检测目的蛋白表达情况。结果显示, 表达样品在上清和沉淀(电泳泳道3和4; 图 1B)中均有近26.0 kD的蛋白分子聚集, 而对照样品中均未见明显蛋白聚集(电泳泳道1和2), 表明试验条件下葛仙米血红素氧合酶基因Ns-HO1能够在大肠杆菌细胞中顺利表达。
2.3 目的基因HO1分子进化
葛仙米属蓝藻门念珠藻科, 其生态型与生境具有特殊性[18,19,21]。葛仙米Ns-HO1预编码含225个氨基酸的多肽链。在人类血红素氧合酶与一种脑膜炎病菌HO1分子中, 最近的螺旋(近N端α螺旋)中一个氨基酸位点(His-25/23)突变能够导致酶失活,被认为是底物血红素与HO1的最直接接合位点[9]。序列分析显示, 在念珠藻HO1分子中, His17(H17)与该His-25/23位点对应, 可能是血红素金属铁离子的关键接合位点(图 1C, 黑色倒三角所示); 其他关键位点如底物血红素的预结合位点(如Arg10, Tyr125)在该蛋白氨基酸序列中保持稳定(图 1C, 黑色菱形所示氨基酸位点)。
选取念珠藻科里的典型种质, 如点状念珠藻(Nostoc punctiforme), 发状念珠藻(Nostoc flagelliforme)和普通念珠藻(Nostoc commune)等, 对其血红素氧合酶基因编码蛋白的氨基酸序列进行综合比对分析, 并构建分子进化树(图 1C和图 2)。结果显示, 血红素氧合酶同源蛋白氨基酸序列总相似性可达90.3%。血红素氧合酶特异性分割血红素分子α-碳键, 产生胆绿素IXα, 酶与底物首先接合是反应顺利进行的前提条件。这些氨基酸位点替换, 可能在一定程度上影响同源蛋白的活性, 预示不同种源念珠藻的血红素氧合酶功能可能存在变异。分子进化树显示, 葛仙米Ns-HO1与点状念珠藻 (Nostoc punctiforme)等几个分支藻种中的血红素氧合酶亲缘关系较近 (图 2)。该结果也为葛仙米区分与其生态型相近的念珠藻种提供了证据[18,21]。
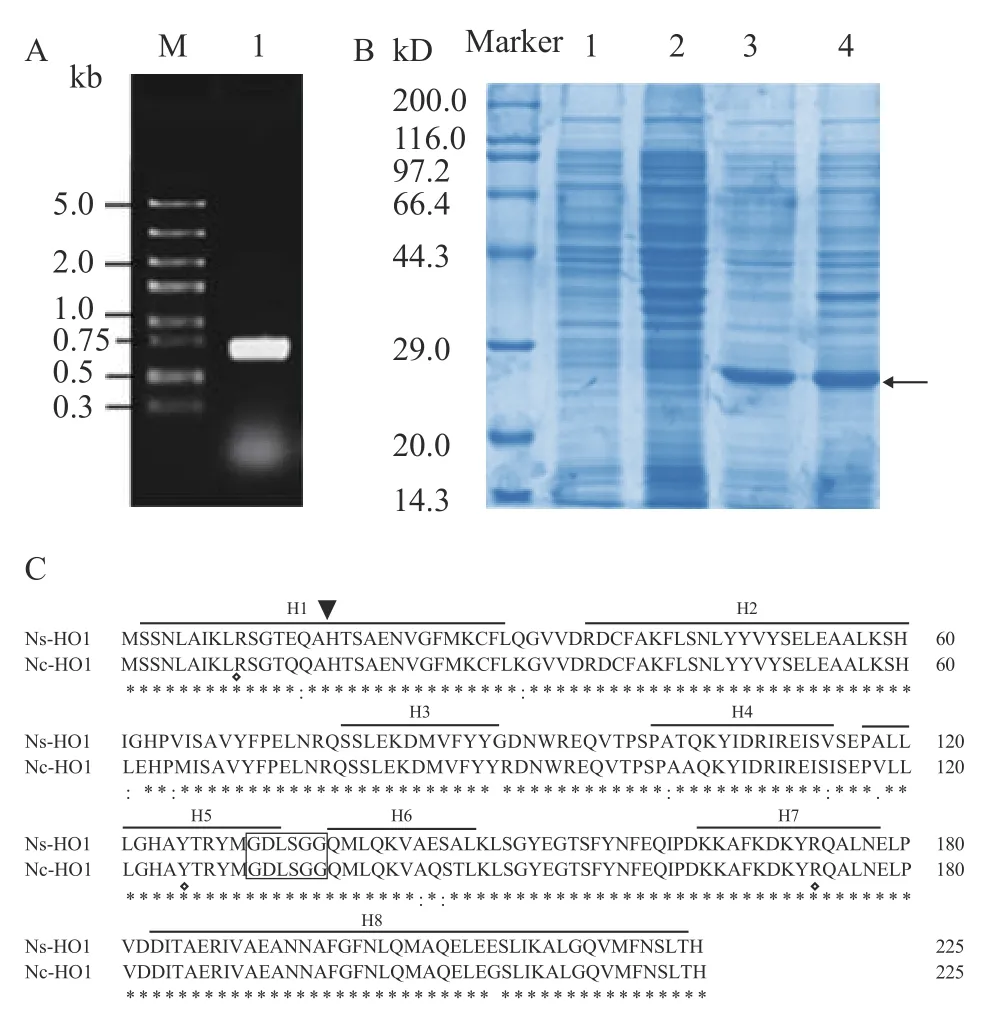
图1 目的基因Ns-HO1PCR扩增(A)及其表达蛋白(B)与氨基酸序列分析(C)Fig. 1 The gene Ns-HO1 amplication by PCR (A), and its protein(B) and the amino acid sequence analysis (C)

图2 念珠藻中HO1系统进化树Fig. 2 The phylogenic tree of HO1 from Nostoc sp.
2.4 Ns-HO1蛋白高级结构模拟
在葛仙米Ns-HO1形成的二级结构中, 以8个α-螺旋为主要类型。其中位于N和C末端的两个螺旋(α-螺旋H1和H8) 较大, 并与第四螺旋共同形成Ns-HO1分子的支撑底面; 并且C末端的螺旋, 其突出部分可视为HO1单分子结构的一个特殊支撑; 而另外几个α-螺旋进一步延展并填充其中。含有血红素预结合位点氨基酸残基(图 1C, 黑色菱形所示)的几个肽段形成的螺旋(包括第一、五和七螺旋结构)分布于Ns-HO1分子的外围(图 3A), 为底物捕获提供了便利; 另外, 我们发现在念珠藻血红素氧合酶HO1中, 一段非常保守的甘氨酸序列(-G-D-L-S-GG-) (图 1C, 方框所示), 构成为第五和第六α螺旋向上延展的连接点, 从而为形成Ns-HO1分子高级结构提供了条件[9,20]。当细胞内游离的血红素分子与HO1靠近后, HO1分子以第一、三和五等主要螺旋维持的疏水内核空间, 利于血红素进一步在HO1分子内深入进而发生反应(图 3B)。
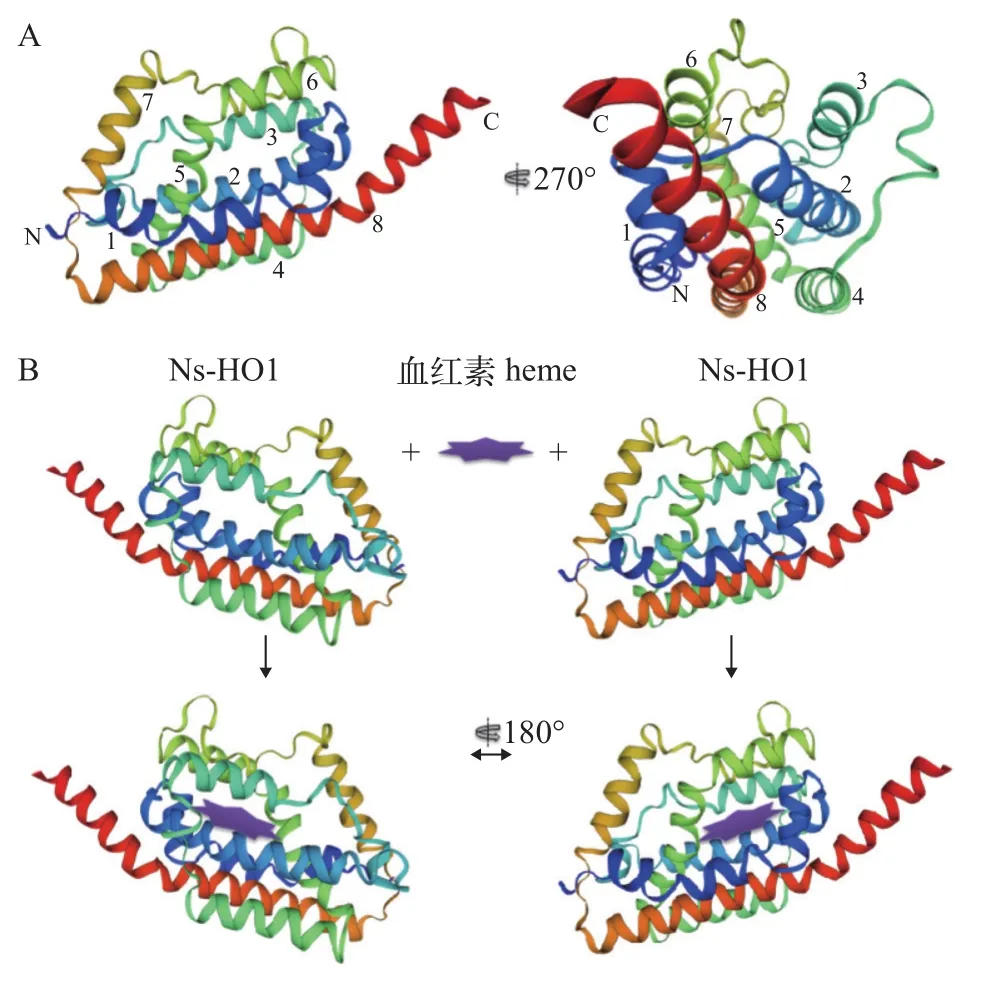
图3 Ns-HO1 分子结构模型与血红素进入HO1 分子模式Fig. 3 Ns-HO1 molecular modeling
3 讨论
细胞内活性氧等自由基能够损害脂质、蛋白质、DNA等生物大分子并抑制其正常功能, 自由基理论强化了营养与健康和疾病之间联系[22—24]。适当补充天然抗氧化物, 对于保持健康、预防疾病产生具有重要作用[24]。葛仙米在我国食用历史悠久,含有丰富的蛋白质、多糖、脂类与维生素等活性物质; 另外, 葛仙米可能还具有抑制感染、抵抗氧化、减缓衰老和预防肿瘤等重要活性[15—17]。在蓝藻中, 血红素氧合酶参与藻胆素的合成; 而藻胆素是蓝藻构建藻胆体光合器的必需色素, 可能在医用生物素方面具有重要的开发价值[17,19,25]。本研究首次克隆了葛仙米的血红素氧合酶基因Ns-HO1,进行IPTG诱导表达, 经SDS-PAGE鉴定成功表达目的蛋白, 并对Ns-HO1分子进化和高级结构进行分析。实验为进一步研究血红素氧合酶基因Ns-HO1的生物学功能、探讨其作用机制, 及进一步运用奠定了基础。
在有氧细胞中, 血红素合成与分解代谢处于动态平衡。HO作为血红素降解的起始酶和限速酶,能氧化分解血红素产生胆绿素(Biliverdin, BV)、亚铁离子和一氧化碳。目前, 念珠藻科来源的HO1同源基因编码血红素氧合酶的活性研究较少。比较而言, 该酶蛋白分子中关键位点尤为保守, 如His17位点和保守的甘氨酸模体等(图 1C), 这为底物血红素中金属亚铁离子与该酶分子接合提供了位点基础。而葛仙米血红素氧合酶分子形成以8个α-螺旋二级结构为主要支撑的类夹心式结构(图 3A),为氧化分解血红素并成功释放产物提供了重要空间条件[9]。葛仙米血红素氧合酶其保守的C末端螺旋一部分突出于夹心结构表面, 可能为该酶分子活性提供支撑; 亦或有可能作用于其他分子。另外,血红素氧合酶HO1的分子进化亦可为葛仙米区别于其他近源念珠藻种提供证据[18,21]。
胆红素是一种内源性很强的抗氧化剂, 具有抗氧化、抗脂质过氧化作用; 亚铁离子是一种在体内具有多种生物活性的金属, 它可以被机体产生的细胞内储存铁蛋白迅速结合, 从而失去催化自由基产生和防止其介导的氧化应激损伤的功能; 一氧化碳作为一种气体信号分子, 可以通过cGMP途径发挥其生理功能[7,26,27]。这表明血红素氧合酶的防御或应激活性很可能与其酶促产物紧密关联。我们借助模式动物饲喂等实验, 发现该蛋白很可能具有增强机体应激的功能(本文未显示结果), 但其具体作用机制还有待深入研究。已有研究发现, 真核来源的血红素氧合酶HO1能够保护细胞免受血红素介导的氧化和亚硝基应激和损伤, 并能够在多种病理条件下参与髓系细胞的募集和T细胞的反应[28,29]。在HIV-1感染时, 多个免疫细胞亚群中HO1基因表达上调;HO1过表达调控抗HIV免疫; 在恶性肿瘤胰腺管癌(Pancreatic ductal adenocarcinoma, PADA)细胞中, 低氧条件下抑制HO1表达, 则能够抑制PADA细胞增殖, 并强化药物治疗效果[30,31]。可见,若主动调节血红素氧合酶在人体的活性, 有利于保障健康、预防和治疗疾病。总之, 本研究为深入了解葛仙米血红素氧合酶基因Ns-HO1功能并为其进一步运用提供了分子基础。

