加味温胆汤对抑郁大鼠HMGB1/TLR4/NF-κB通路及小胶质细胞极化的影响❋
戴建业, 张 齐, 张 曼, 武 丽△, 覃 倩
(1.广西中医药大学, 南宁 530001;2.广西中医药大学第一附属医院, 南宁 530012;3.广西国际壮医医院,南宁,530000)
抑郁症属于常见心理障碍疾病,通常表现为持久的情绪低落,部分表现为焦虑和运动性激越,严重者出现幻觉、妄想症等,更有甚者出现自杀等念头,危害严重[1]。临床上抗抑郁药物普遍副作用大、起效慢、疗效差,中医药具有疗效好、副作用小等优点,为治疗抑郁症提供可能[2]。本课题组前期研究表明,加味温胆汤能改善抑郁症患者的情绪、认知功能及躯体症状且无毒副作用[3],但其具体机制尚不清楚。小胶质细胞是中枢神经系统的主要免疫细胞,小胶质细胞极化在各类精神疾病中的作用越来越受到关注,抑郁症致病原因与M1型小胶质细胞分泌促炎因子有关[4],且高迁移率族蛋白B1/Toll样受体4/核因子κB(high mobility group box chromosomal protein 1/toll-like receptor 4/nuclear factor-κB,HMGB1/TLR4/NF-κB)通路与小胶质细胞极化关系密切[5]。本研究通过孤养结合慢性不可预见性应激制备大鼠抑郁模型,探究加味温胆汤对小胶质细胞极化的作用,为临床加味温胆汤治疗抑郁症提供实验依据。本研究通过广西中医药大学伦理协会审核批准(批号20200012)。
1 材料与方法
1.1 动物及分组
SPF级雄性SD大鼠,体质量180~200 g,购于广东省医学实验动物中心,实验动物许可证号SCXK(粤)2018-0002。采用孤养方式单笼喂养,在温度(22±2)℃、湿度(60±10)%、12 h光照/12 h黑暗环境中饲养。造模前进行旷场实验,筛选出行为学评分相近的大鼠。48只大鼠随机分为正常组、模型组、加味温胆汤组、氟西汀组各12只。除正常组外,其余各组采用目前国际公认的孤养结合慢性不可预见性应激方法制备大鼠抑郁模型。
1.2 药物
加味温胆汤组成:枳实、橘红、党参、甘草各10 g,半夏15 g,茯苓、竹茹、香附、桔梗各20 g,麦冬、柴胡各30 g,均购自张仲景大药房且经中药植化室鉴定,委托广西中医学院附属瑞康医院药剂科,水煎浓缩为1.5 g/mL,将煎煮液制成浸膏,置4 ℃冰箱内备用。盐酸氟西汀片(国药准字H19980139)常州四药制药有限公司。
1.3 试剂与仪器
苏木精-伊红染色试剂盒(货号G1120),北京索莱宝科技有限公司;小胶质细胞骨架蛋白-离子钙结合适配器分子1(Ionized calcium-binding adapter mo35,Iba1)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、精氨酸酶1(arginase 1,Arg1)、HMGB1、TLR4、NF-κB一抗、大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、干扰素-γ(interferon-γ,IFN-γ)、白细胞介素(interleukin,IL)-1β、IL-10、IL-4、IL-13 ELISA试剂盒(abcam,货号分别为ab5076、ab178945、ab203490、ab18256、ab22048、ab32360、ab236712、ab239425、ab197742、ab214566、ab100770、ab269547)、蛋白凝胶成像系统(型号Gel Doc EZ),BIO-RAD公司。
1.4 方法
1.4.1 模型制备及给药 参考文献方法造模[6],大鼠分组后,除正常组外其余各组接受21 d各种未预知刺激,包括禁食24 h、禁水24 h、通宵照明、4 ℃冷水游泳5 min、45 ℃烘箱热烘5 min、夹尾2 min、高速水平振荡3 min、100伏电击足底1 min、悬尾1 min。每天随机安排1种刺激方法,每种刺激在整个实验过程中使用2次或3次,且同一刺激不连续出现,动物不可预知给予的刺激。旷场实验及糖水消耗实验验证造模是否成功。
造模成功后开始给药,加味温胆汤组以12 g/(kg·d)剂量灌胃加味温胆汤[7];氟西汀组以10 mg/(kg·d)剂量腹腔注射氟西汀[8];正常组、模型组灌胃等容量0.9%氯化钠溶液,连续21 d。
1.4.2 旷场实验 分别于实验前后进行旷场实验。自制边长为80 cm底面、高为40 cm的周边不透明敞箱,底面正方形箱底用白线分为面积相等的25块,周围环境安静,将大鼠置于敞箱底部的中心方格中,记录大鼠3 min内活动情况。以穿越底面块数为水平穿越格数、前肢离开地面直立次数为竖立活动次数。
1.4.3 糖水消耗实验 实验前大鼠先进行糖水适应,给予2瓶1%蔗糖水,24 h后更换为1瓶1%蔗糖水、1瓶纯净水24 h,12 h时交换2瓶水的位置。实验结束后,大鼠禁水禁食24 h,给予1瓶1%蔗糖水、1瓶纯净水,2瓶水位置随机,观察1 h内糖水和纯水的消耗量。糖水偏爱率=糖水消耗量/总液体消耗量×100%。
1.4.4 苏木精-伊红染色观察 海马区形态行为学实验结束后,每组随机取6只大鼠处死,取全脑经4%多聚甲醛和30%蔗糖脱水后,冰冻切片机上连续切片(厚度10 μm),切出完整海马区,切片置于经多聚赖氨酸处理的载玻片上,60 ℃烤片30 min,二甲苯脱蜡、梯度酒精水化、苏木精浸染、盐酸酒精分化、伊红复染、梯度酒精脱水、二甲苯透明,中性树胶封片,显微镜下拍照。
1.4.5 免疫荧光染色观察海马区小胶质细胞极化 冰冻切片60 ℃烤箱烤片30 min,PBS清洗3次,3%过氧化氢溶液室温孵育10 min,5%胎牛血清孵育30 min,滴加Iba1、iNOS、Arg1一抗,4 ℃孵育过夜,避光滴加二抗室温孵育2 h,DAPI核染5 min,防荧光猝灭剂封片,荧光显微镜下拍照。
1.4.6 ELISA检测血清中TNF-α、IFN-γ、IL-1β、IL-10、IL-4、IL-13水平 各组大鼠处死前抽取股静脉血5 mL,参考ELISA试剂盒说明书,检测血清中TNF-α、IFN-γ、IL-1β、IL-10、IL-4、IL-13水平。
1.4.7 Western blot检测海马区HMGB1、TLR4、NF-κB蛋白表达处死每组剩余的6只大鼠,摘除全脑,取完整海马区,提取总蛋白,每孔上样20 μg,凝胶电泳分离蛋白,PVDF转膜,5%脱脂奶粉室温封闭,分别添加HMGB1(1∶1000)、TLR4(1∶500)、NF-κB(1∶1500)、GAPDH(1∶5000)一抗,4 ℃孵育过夜,添加对应二抗,DAB显色,蛋白凝胶成像仪拍照和定量分析。
1.5 统计学方法
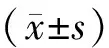
2 结果
2.1 加味温胆汤对大鼠行为学的影响
实验前,各组大鼠旷场实验水平穿越格数、竖立活动次数比较差异无统计学意义(P>0.05)。给药结束后,与正常组比较,模型组大鼠旷场实验水平穿越格数、竖立活动次数、糖水偏爱率降低(P<0.05);与模型组比较,加味温胆汤组大鼠旷场实验水平穿越格数、竖立活动次数、糖水偏爱率均升高(P<0.05),氟西汀组旷场实验水平穿越格数与糖水偏爱率升高(P<0.05);与氟西汀组比较,加味温胆汤组旷场实验水平穿越格数升高(P<0.05)(见表1)。

表1 各组大鼠旷场实验、糖水消耗实验结果比较
2.2 加味温胆汤对大鼠海马神经元的影响
正常组海马区神经元排列整齐,形态正常,细胞核在细胞膜内;模型组海马区神经元排列紊乱,神经元形态异常,核深染甚至消失;加味温胆汤组和氟西汀组部分神经元排列较整齐,部分形态恢复(见图1)。

图1 各组大鼠海马区HE染色(400×)
2.3 加味温胆汤对海马区小胶质细胞极化的影响
与正常组比较,模型组大鼠海马区M1型小胶质细胞比例升高(P<0.05),M2型小胶质细胞比例降低(P<0.05);与模型组比较,加味温胆汤组、氟西汀组M1型小胶质细胞比例降低(P<0.05),M2型小胶质细胞比例升高(P<0.05);与氟西汀组比较,加味温胆汤组M1型小胶质细胞比例降低(P<0.05),M2型小胶质细胞比例升高(P<0.05)(见图2表2)。

注:小胶质细胞骨架蛋白-离子钙结合适配器分子1(Ionized calcium-binding adapter mo35,Iba1),诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS),精氨酸酶1(arginase 1,Arg1)图2 各组大鼠海马区小胶质细胞极化情况比较
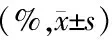
表2 各组大鼠海马区M1型、M2型小胶质细胞比例比较
2.4 加味温胆汤对血清中TNF-α、IFN-γ、IL-1β、IL-10、IL-4、IL-13水平的影响
与正常组比较,模型组大鼠血清中TNF-α、IFN-γ、IL-1β水平升高(P<0.05),IL-10、IL-4、IL-13水平降低(P<0.05);与模型组比较,加味温胆汤组、氟西汀组血清中TNF-α、IFN-γ、IL-1β水平降低(P<0.05),IL-10、IL-4、IL-13水平升高(P<0.05);与氟西汀组比较,加味温胆汤组大鼠血清中IL-1β水平降低(P<0.05),IL-13水平升高(P<0.05)(见表3)。

表3 各组大鼠血清中TNF-α、IFN-γ、IL-1β、IL-10、IL-4、IL-13水平比较
2.5 加味温胆汤对大鼠海马区HMGB1、TLR4、NF-κB蛋白的影响
与正常组比较,模型组大鼠海马区HMGB1、TLR4、NF-κB蛋白表达升高(P<0.05);与模型组比较,加味温胆汤组、氟西汀组HMGB1、TLR4、NF-κB蛋白表达降低(P<0.05);加味温胆汤组较氟西汀组TLR4蛋白表达更低(P<0.05)(见图3表4)。

注:高迁移率族蛋白B1(high mobility group box chromosomal protein 1,HMGB1),Toll样受体4(Toll-like receptor 4,TLR4),核因子κB(nuclear factor-κB,NF-κB)图3 各组大鼠海马区HMGB1、TLR4、NF-κB蛋白表达
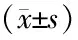
表4 各组大鼠海马区HMGB1、TLR4、NF-κB蛋白水平比较
3 讨论
抑郁症属于西医病名,相关最早记载见《左传》:“君子魏子重于是役也,所获不如所亡,楚人以是咎子重,子重病之,遂遇心病而卒”,此处“心病”与抑郁症症状类似[9],抑郁症属于中医学“郁证”“脏躁”“百合病”等范畴。中医病因有气机郁滞、痰浊郁阻、气血亏虚等[10],多认为病位在心脾、肝脾相兼为病,治疗常采用健脾、补脾配合清心解郁之法。加味温胆汤中橘红、茯苓健脾化瘀、顺气开窍,竹茹、柴胡、香附解郁清热、疏肝理气,麦冬清心除烦,枳实行气除痞,党参补中益气,半夏化痰燥湿、散结除痞,桔梗祛痰止咳、消肿排脓,甘草调和诸药。本研究中通过一系列不可预知的刺激,并采用孤养方式制备抑郁症大鼠模型,模拟临床郁闷、寂寞、悲伤等情感状态。加味温胆汤治疗可改善大鼠由于抑郁症造成的活动能力下降、对食物欲望不强烈等表现,与前期实验中加味温胆汤可对抑郁症行为有调节作用[11]结果类似,但具体机制尚需进一步研究。
小胶质细胞可介导多种免疫效应因子和炎症因子,正常情况下对感染、应激等病理状态做出免疫应答;小胶质细胞活化时能够分泌具有细胞毒性的炎症因子和保护神经的抑炎因子,从而发挥作用,且小胶质细胞活化与小胶质细胞极化关系密切[12]。小胶质细胞极化分M1型和M2型,M1型分泌TNF-α、IFN-γ、IL-1β等促炎因子,M2型分泌IL-10、IL-4、IL-13等抑炎因子和血管生成因子[13-15]。病理状态下,IFN-γ或脂多糖可使静息状态下小胶质细胞转化为M1型小胶质细胞,通过Toll样受体等释放大量炎症因子,促进炎症反应,导致神经元死亡[16];而抑炎因子IL-4、IL-13等可促使小胶质细胞从M1型向M2型转化,释放大量抑炎因子、血管生成因子等,抑制炎症反应、促进血管生成、参与神经元修复等过程[17]。HMGB1/TLR4/NF-κB通路是小胶质细胞极化及神经炎症的重要通路,正常情况下,HMGB1位于真核细胞核中,与细胞核中DNA紧密连接,从而稳定染色体结构功能;但受致炎因子、小胶质细胞等炎症刺激时,HMGB1与核内DNA结合域结构发生改变,导致结合力下降,HMGB1由核进入细胞浆中,此时的HMGB1具有致炎性,可与Toll样受体结合,直接或间接参与NF-κB通路调控的炎症反应过程[18,19]。抑制HMGB1/TLR4/NF-κB通路能抑制小胶质细胞活化和神经炎症反应,改善神经功能[20]。本研究结果发现,与正常组比较,模型组M1型小胶质细胞比例及血清中TNF-α、IFN-γ、IL-1β水平升高;此时海马区HMGB1、TLR4、NF-κB蛋白水平亦升高,提示抑郁状态时HMGB1由核进入细胞浆中,与Toll样受体结合,参与NF-κB通路过程,激活IFN-γ等水平,促进小胶质细胞向M1型转化,通过级联放大效应促进炎症反应;而经过加味温胆汤治疗后,M2型小胶质细胞比例及血清中IL-4、IL-10、IL-13水平升高,海马区HMGB1、TLR4、NF-κB蛋白水平降低,提示加味温胆汤可抑制HMGB1/TLR4/NF-κB通路,促进抑炎因子的分泌,使小胶质细胞由M1型向M2型转化,进而抑制炎症,促进神经元修复。
综上所述,加味温胆汤可能通过抑制HMGB1/TLR4/NF-κB通路和促进小胶质细胞由M1型向M2型转化,进而改善神经功能和抑郁。加味温胆汤成分复杂,其具体机制尚待进一步深入研究。

