急性痛风性关节炎小鼠模型制备方法的改良❋
刘建鑫, 揭珊珊, 赵雨坤, 张立石, 曾 辉, 马雅銮△
(1.中国中医科学院中医基础理论研究所, 北京 100700;2.首都医科大学附属北京世纪坛医院, 北京 100038)
痛风属于中医学“痹证”范畴,具有“走痛攻刺,如风之善动”的特点[1]。痛风是一种古老的疾病,严重影响人类健康。近年来,我国高尿酸血症呈上升和年轻化趋势,患病率为13.3%,痛风患病率为1.1%,患病人数约1466万[2]。
痛风的病因及病理机制十分复杂,随着研究的深入,对其的认识与治疗也在不断更新[3,4]。因此建立稳定的动物模型,有助于痛风发病机制、临床特点、药物治疗等研究。临床上,痛风好发于第一跖趾关节,也可累及足背、足跟、踝关节、膝关节甚至指和腕等关节。目前,踝关节内注射单钠尿酸盐(monosodium urate,MSU)晶体是制备急性痛风性关节炎(acute gouty arthritis,AGA)模型最常用的方法[5,6]。AGA小鼠模型由Reber在Coderre发明的大鼠AGA模型基础上加以改进,即使用27号针头的1 mL注射器从小鼠右踝关节外侧后方,垂直穿刺进入踝关节腔,注入MSU晶体混悬液,诱导小鼠产生AGA症状[7,8]。然而笔者在实践中发现,采用传统方法造模时研磨不匀的MSU晶体颗粒易堵塞注射器针头,影响进入关节腔内的MSU剂量、1 mL注射器针头较粗导致操作中易损伤关节骨质及针孔处MSU晶体外溢,这些因素均影响模型制备的稳定性。为解决这些问题笔者对传统造模方法进行了改良,以提供更稳定、可靠的AGA小鼠模型。本研究通过中国中医科学院中医基础理论研究所实验动物福利伦理审查委员会批准(批准号2020-023)。
1 材料
1.1 动物
SPF级8周龄C57BL/6雄性小鼠30只,体质量(20±2)g,购于中国食品药品检定研究院,实验动物使用许可证号SCXK(京)2017-0005。饲养于中国中医科学院中医基础理论研究所清洁级动物房,采用标准饲料分笼饲养,自由饮水,室温保持(22±2)℃,室内湿度(45±5)%,光照时间为12 h/12 h明暗交替。
1.2 主要试剂及仪器
尿酸钠(ucid acid sodium salt,货号U2875-25G),美国Sigma公司;40 μm 细胞过滤器(货号352340),美国Falcon公司;0.3 mL和1 mL注射器(货号0197和300841),美国BD公司;离心机(型号TDZ5-WS/TD5A-WS),长沙湘仪离心机仪器有限公司;游标卡尺(型号PD-151),上海宝工工具有限公司;正置显微镜(型号Scope.A1),德国ZEISS公司;显微图像系统(型号DM600B),德国Leica公司。
2 方法
2.1 MSU晶体制备
根据Coderre[8]记载方法,称取800 mg尿酸钠盐溶于5 mL l mol/L NaOH中,加入155 mL 无菌的0.9%氯化钠溶液,加热煮沸不断搅拌至完全溶解,自然冷却后用l mol/L HCL调pH值至7.2,转移上清至容量瓶中,室温下过夜。次日离心后收集沉淀即MSU晶体,70 ℃干燥后放入4 ℃冰箱中保存备用。
2.2 动物分组
30只C57BL/6小鼠采用配对比较法随机分为传统方法AGA模型组(1 mL注射器造模)、改良方法AGA模型组(0.3 mL注射器造模)及对照组各10只,适应性饲养1周后进行小鼠AGA模型制备。
2.3 模型制备方法
参考Reber[7]的造模方法,制备传统方法AGA模型,研磨MSU晶体,用无菌的0.9%氯化钠溶液配成MSU晶体混悬液(50 mg·mL-1),采用传统27号针头的1 mL注射器沿小鼠右踝关节外侧后方垂直进针穿刺,注射30 μL MSU混悬液至踝关节内。
制备改良方法AGA模型,研磨MSU晶体,用无菌的0.9%氯化钠溶液配成MSU晶体混悬液(50 mg·mL-1),40 μm细胞过滤器过筛后,采用30号针头的0.3 mL注射器造模,注射部位及注射剂量同传统方法。对照组采用0.3 mL注射器,按上述方法注射等体积无菌的0.9%氯化钠溶液。
2.4 踝关节肿胀程度观察
于造模前和造模后6、12、18、24、48、72、96、120、144、168 h分别用游标卡尺测量各组小鼠右侧踝关节直径计算肿胀度。计算公式为:踝关节肿胀度(mm)=测定点踝关节直径(mm)-造模前踝关节直径(mm)。
2.5 病理检测
造模7 d后,戊巴比妥钠腹腔注射麻醉处死小鼠。取右侧足踝关节,4%多聚甲醛溶液中固定,脱钙后常规方法石蜡包埋、切片和HE染色,显微镜下观察踝关节组织病理变化。
2.6 统计学方法
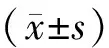
3 结果
3.1 MSU晶体制备
研磨后的尿酸钠盐(图1A)制备成MSU晶体,镜下可见针尖状MSU晶体聚集成核(图1B)。
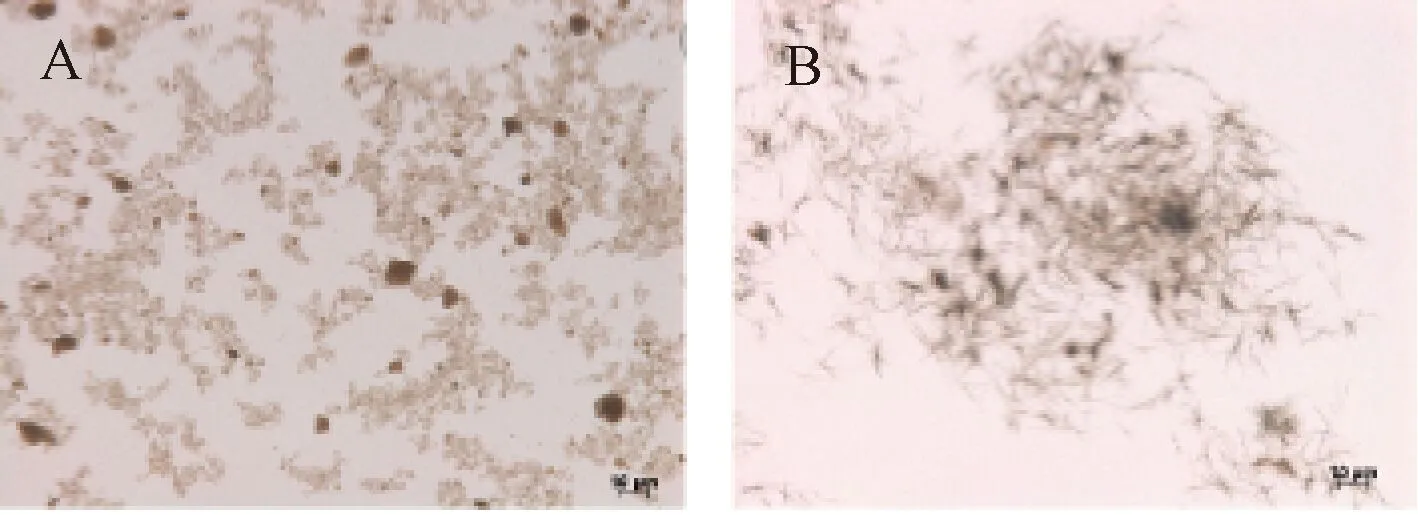
注:A. 研磨后的尿酸钠盐;B. 制备的MSU晶体图1 单钠尿酸盐(Monosodium urate,MSU)晶体制备(×50)
3.2 制备小鼠AGA模型
表1图2示,MSU晶体干燥研磨后呈粉末状,显微镜下可见颗粒大小不均匀。经过40 μm细胞过滤器过筛改良后,MSU晶体颗粒较均匀,小于40 μm,能够通过0.3 mL注射器针头(内径0.15 mm),不造成堵塞。
3.2.1 传统方法制备AGA模型 采用27号针头(内径0.25 mm)的1 mL无菌注射器,沿小鼠右踝关节外侧后方垂直进针穿刺,注射30 μL研磨但未过40 μm细胞过滤器的MSU混悬液(50 mg·mL-1)至踝关节内。使用1 mL注射器吸取MSU混悬液有时会堵塞针孔,穿刺时而发生卡针,在注射完成退针时会有部分MSU悬浮液漏出(表1图2)。

表1 2种方法制备小鼠急性痛风性关节炎模型比较
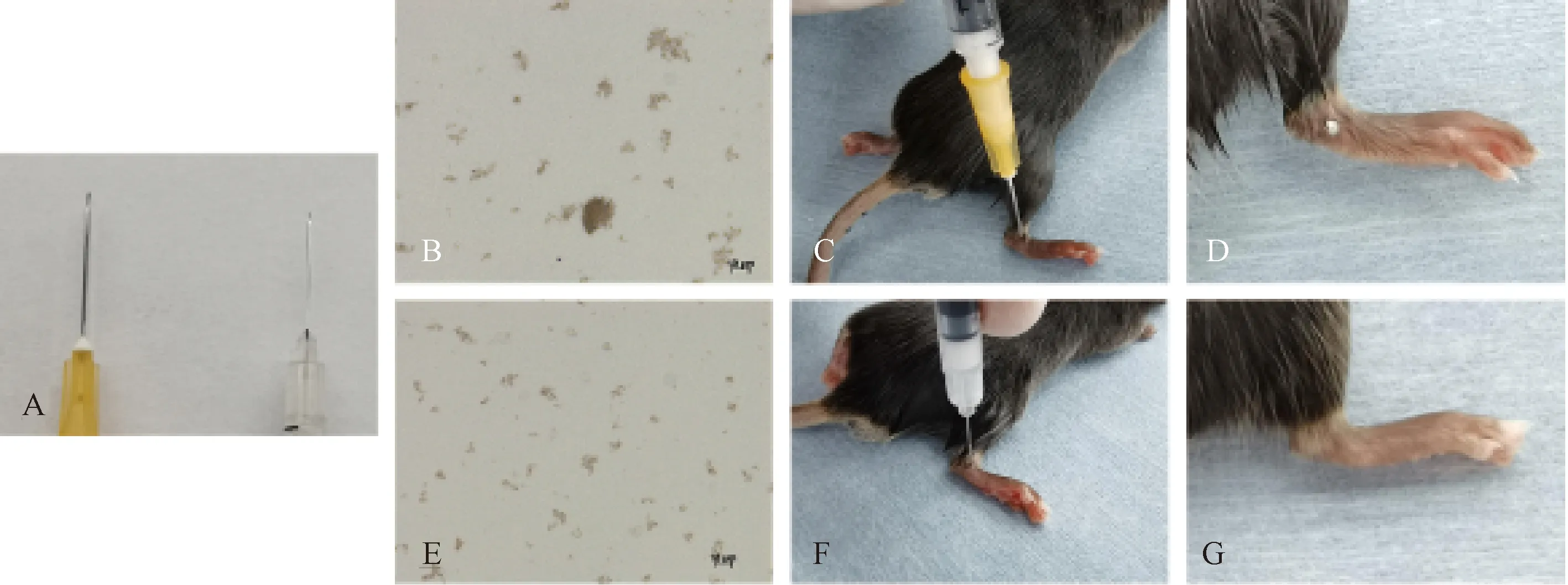
注:A. 1 mL注射器(左)和0.3 mL注射器(右)针头对比;B. 干燥研磨的MSU晶体(×50);C、D. 传统方法使用1 mL注射器制备小鼠急性痛风性关节炎模型;E.干燥研磨过细胞过滤器的MSU晶体(×50);F、G. 改良方法使用0.3 mL注射器制备小鼠急性痛风性关节炎模型图2 传统和改良方法制备小鼠急性痛风性关节炎模型比较
3.2.2 改良方法制备AGA模型 采用30号针头的0.3 mL注射器注入30 μL研磨,经过40 μm细胞过滤器过筛的相同浓度MSU晶体混悬液。使用0.3 mL注射器吸取研磨过筛后MSU混悬液未堵塞过针孔,穿刺时进针顺畅,退针时未发生渗漏(表1图2 )。
3.3 2种造模方法对小鼠踝关节肿胀程度影响
图3、4示,对照组小鼠右踝关节轻度肿胀,48 h后肿胀消退并恢复正常。
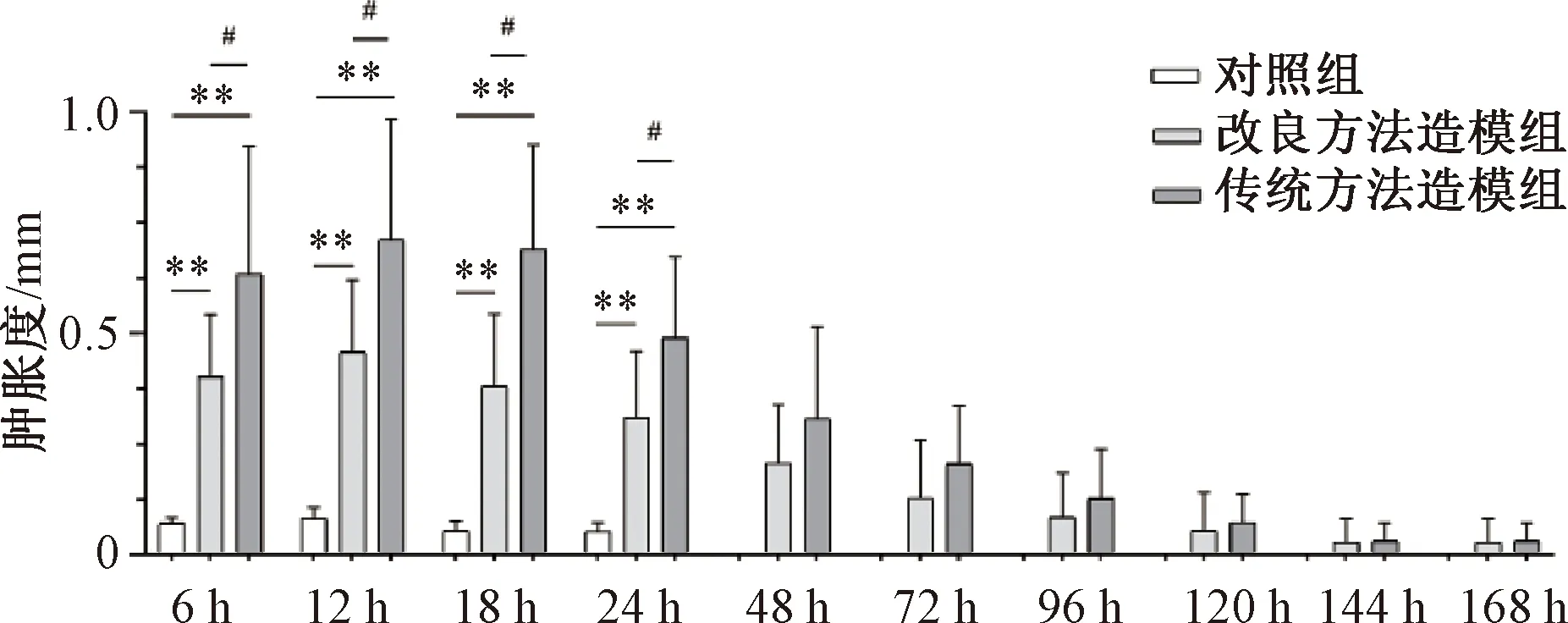
注:与对照组比较:**P<0.01;与传统方法造模组比较:#P<0.05图3 急性痛风性关节炎模型小鼠右踝关节肿胀度变化
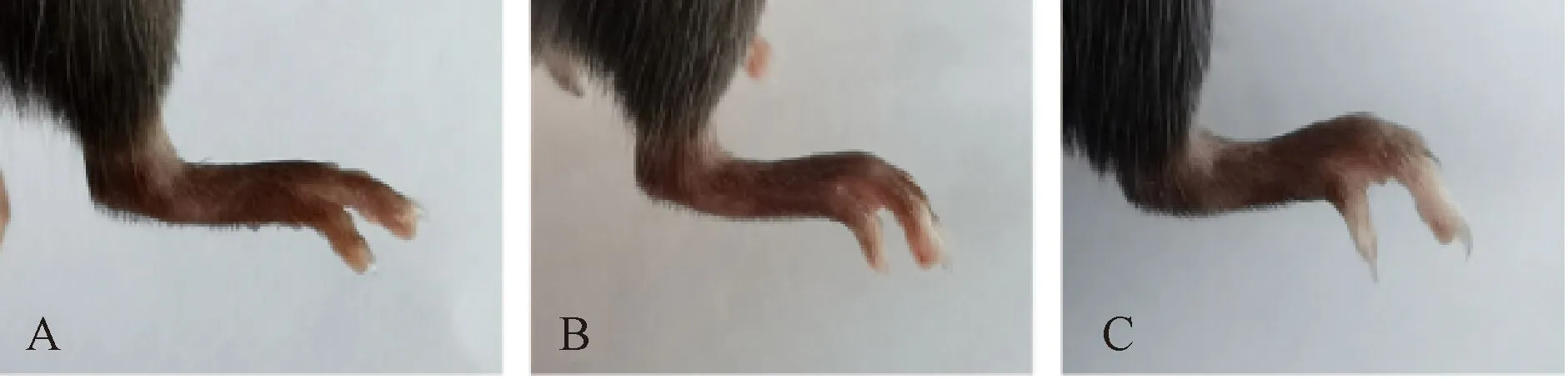
注:A. 对照组;B. 改良方法造模组;C. 传统方法造模组图4 急性痛风性关节炎模型小鼠造模12 h右踝关节大体肿胀比较
传统和改良2种方法造模组小鼠右踝关节注射MSU晶体后6 h均明显肿胀,造模后12 h肿胀达到峰值,然后开始逐渐减退,在观察的6、12、18和24 h,与对照组比较差异均有统计学意义(P<0.01)。48 h后肿胀减退明显,造模后6 d右踝关节恢复接近造模前状态。
2种造模方法制备的模型小鼠踝关节肿胀程度有明显不同。与改良方法造模组比较,传统方法造模组小鼠在6、12、18和24 h右踝关节肿胀程度更为显著(P<0.05)且组内差异较大。造模48 h后,2种造模方法引发的关节肿胀程度均逐渐减轻,6 d后右踝关节恢复并接近造模前状态。
3.4 2种造模方法对小鼠踝关节组织形态的影响
造模7 d后HE染色可见,对照组小鼠踝关节软骨光滑完整,未见滑膜组织增生(图5A);改良方法造模组小鼠滑膜组织明显增生,关节软骨平滑完整无损伤(图5B);传统方法造模组小鼠右踝关节滑膜组织显著增生并侵犯骨质,造成骨破坏(图5C)。
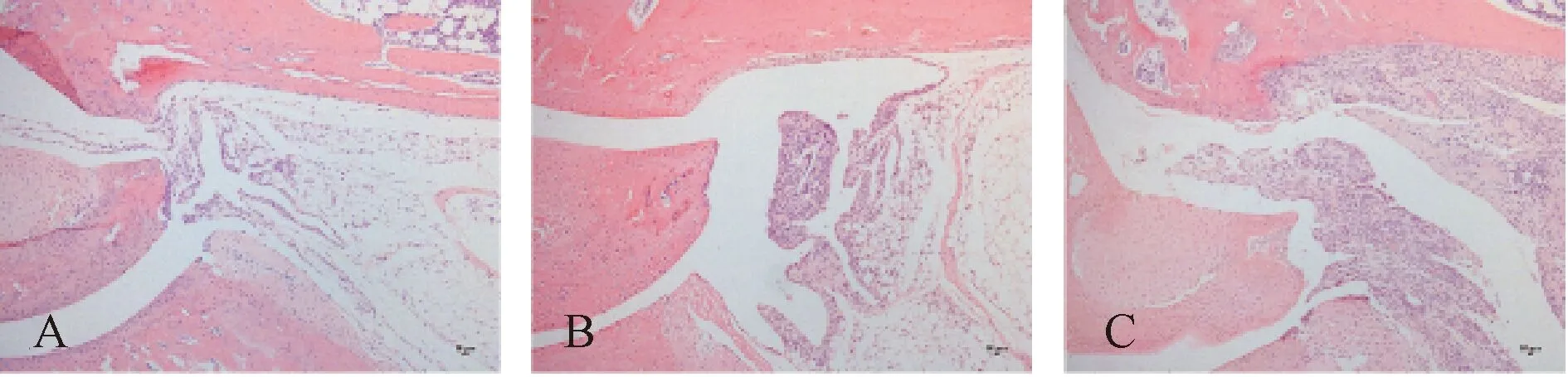
注:A. 对照组;B. 改良方法造模组;C. 传统方法造模组图5 HE染色检测急性痛风性关节炎小鼠造模7 d后踝关节组织病理变化比较(×100)
4 讨论
痛风属于中医学“痹证”范畴,其主要病因为脾肾功能失调,气血运行失畅;加之感受风寒湿邪,湿浊瘀滞内阻凝滞关节,主要辨证属寒湿痹阻之证[9]。AGA指痛风急性发作时MSU晶体沉积关节腔导致急性炎症反应,表现为关节的红、肿、热、痛。AGA与尿酸生成或/和代谢过程异常导致的高尿酸血症直接相关,伴随大量炎症细胞浸润和多种炎症因子的表达[10,11]。痛风是目前最常见的炎症关节病之一,其致病机制尚不清楚且临床疗效不显著[2]。因此,制备出符合临床特征、可靠的动物模型,有助于痛风病机研究、中医药治疗痛风疗效筛选及药物作用机制研究。
目前常用的AGA模型制备方法为在大鼠和小鼠关节腔注射外源性MSU晶体模仿人类急性痛风发作[5,6]。研究认为,AGA的关节腔内存在多种免疫细胞,可引发一系列的炎症级联反应[10,11]。由于小鼠的免疫细胞发育阶段表面标志物资料比大鼠的相应资料更加齐全,因此越来越多的研究选择采用小鼠建立AGA模型,更有利于AGA发病机制研究以及抗痛风药物开发。
MSU晶体是尿酸在人体关节腔存在的主要形式。体内尿酸沉积形成针尖状的MSU晶体,大量产生的MSU晶体聚集成核,加重AGA疾病关节损伤[12]。因此,直接注射MSU晶体更能模拟AGA的病理过程。实验研究模拟临床发病部位和症状体征有多种造模方法,其中由Reber改进踝关节穿刺注射MSU晶体制作的AGA小鼠模型,易操作且贴近临床痛风的发病特点,被相关研究者广泛采用,成为小鼠AGA模型的经典方法[13,14]。课题组采用该造模方法时遇到一些问题,如MSU晶体研磨后颗粒虽然变小但不均匀,采用注射器抽取混悬液有时会发生MSU晶体颗粒堵塞针头;1 mL注射器27号针头(外径0.41 mm,内径0.20 mm)穿刺入踝关节的狭小缝隙内易发生卡针,人为造成踝关节破坏;小鼠踝关节背侧缘皮肤和皮下脂肪层较薄,穿刺时针尖(27号针尖长度为2.35 mm)可能未完全进入踝关节腔,可能将部分MSU晶体混悬液注入踝前皮下或体外;27号针头外径较粗(0.41 mm),注射拔针后可能有部分MSU晶体混悬液从注射孔外溢。这些问题提示,造模中进入踝关节腔的MSU晶体剂量可能不够准确,针头的机械性损伤可能导致踝关节创伤性炎症,影响模型稳定性。针对上述问题加以改进,MSU晶体研磨并过细胞过滤器过筛,晶体小于40 μm,能够顺利进出注射器针头;采用30号针头的0.3 mL注射器(外径0.31 mm,内径0.15 mm)针头直径更为细小,可充分进入小鼠踝关节腔隙,避免人为损伤;30号针尖更短(1.55 mm<2.35 mm)、针头直径更小(0.31 mm),针尖能够完全进入踝关节腔内,注射后针孔小,避免造模针孔漏液。结果证实,传统方法造模小鼠踝关节肿胀程度组内差异很大,提示进入关节腔的MSU晶体剂量有所不同;踝关节肿胀程度比改良方法更严重,病理可见骨损伤,提示传统方法造模存在机械损伤。因此,传统方法制备的AGA模型存在不稳定性和非单因素致病,而改良的造模方法制备的模型较均一稳定,避免了机械损伤等传统方法中存在的问题,更符合临床AGA发病过程,有利于单一因素疾病机制的研究。
外源的MSU晶体进入关节后首先激活天然免疫。单核-巨噬细胞和粒细胞是参与AGA的主要免疫细胞,吞噬清除异物同时引发急性炎症反应,诱导更多免疫细胞浸润和炎性因子表达[15]。研究发现,MSU晶体与单核-巨噬细胞和滑膜细胞发生相互作用,导致炎症细胞因子的大量合成和分泌,进而诱导中性粒细胞迁移至关节腔,使原有的炎症进一步加重[7]。改良方法制备AGA模型时也观察到,造模后小鼠踝关节快速肿胀,12 h达到高峰,持续6~12 h肿胀开始逐渐消退,在造模后6 d踝关节肿胀基本恢复,7 d后的病理检测观察到关节滑膜细胞增生严重,但未见明显的炎性细胞浸润,提示造模7 d后炎症反应消失。AGA临床属于自限性疾病,发作时所引起的关节红肿和剧烈疼痛等症状通常在7~10 d后患者自行恢复缓解。因此,改良方法制备的模型与AGA临床发病过程相符合。
本文在传统方法基础上改良并优化小鼠AGA模型制备,避免了传统造模方法的不稳定因素,有利于单一因素疾病机制的研究和抗痛风药物的筛选,期待未来可以进行更深入的研究,为痛风治疗做出贡献。

