抗菌肽RISE-AP12®对钛种植体周围炎主要致病菌和生物膜生长的抑制作用研究
吕金莹,胡欣,邓嘉胤
(天津医科大学口腔医学院牙周科,天津 300070)
种植体周围炎是指发生在口腔种植体周围软组织的可逆炎症,是以种植体上的细菌微生物感染为特征的炎性疾病[1]。目前种植体周围炎的治疗手段都是基于牙周炎治疗的一般原则,包括消除细菌微生物群,防止细菌定植和创造一个能够抑制龈下细菌的生态环境[2-3]。种植体周围炎的常规治疗手段包括机械治疗和化学药物治疗,因为机械治疗无法彻底清除粗糙表面的细菌,再加上抗生素具有较广的抗菌谱,容易诱发菌群失衡,所以治疗效果都不理想[4]。抗菌肽是生物细胞特定基因编码,是机体抵抗病原微生物时诱导产生的一类带正电荷的防御性小分子多肽,具有稳定性高、抗菌谱广等优点[5-6]。RISE-AP12®是一种人工合成的新型抗菌肽,具有较好的生物学活性与较强的抗菌作用,且不易产生耐药性,安全性更高,在种植体周围炎的应用中具有较大的优势[7-8]。本研究旨在探讨分析不同浓度的抗菌肽RISE-AP12®对钛种植体周围炎主要致病菌和生物膜生长的抑制作用。
1 材料与方法
1.1 材料 实验菌株包括血链球菌(ATCC10556),牙龈卟啉单胞菌(ATCC33277),具核梭杆菌(ATCC10953)。
主要试剂与仪器包括钛种植体(Ti6Al4V,规格:Φ3 mm×7 mm);抗菌肽RISE-AP12®(由北京锐瑟生物医药科技发展有限公司合成提供);电热恒温培养箱(上海跃进HDPN-II-256 型)、低温离心机(Grows Instrument TGL27A 型)、酶标仪(美国ThermoFisherScientific)、厌氧培养箱(上海跃进YQX-Ⅱ型)、CO2细胞培养箱(上海龙跃WJ-3-160T 型)。
1.2 方法
1.2.1 抗菌肽RISE-AP12®药液的制备 用脑心浸液琼脂(BHI)培养基将抗菌肽培养成浓度为0.1 g/L的母液,经针孔滤器过滤消毒后储存于-20℃备用。
1.2.2 实验菌种的复苏与培养 将具核梭杆菌、牙龈卟啉单胞菌复苏后接种于BHI 培养基,37℃下专性厌氧环境培养48 h,血链球菌复苏后于37℃下微需氧环境培养24 h。抽取菌落革兰染色后进行生化鉴定,确认为纯菌无污染后进行传代培养,配制成2.0×106CFU/mL 菌悬液保存备用。
1.2.3 检测最小抑菌浓度(MIC)与最小杀菌浓度(MBC) 对数生长期的菌液,调整抗菌肽RISE-AP12®浓度为40、35、30、25、20、15、10、5、2.5 mg/L。各取100 μL 菌悬液与药液接种于96 孔板,置于培养箱中过夜培养观察。置于黑色背景中,若肉眼观察无细菌生长孔清亮且对应的最小用药浓度时即为MIC 值;当菌落数少于5~6 个时对应的最低浓度即为MBC 值[9]。进行3 次平行实验。
1.2.4 kill-time 曲线测定与绘制 菌液与药液1∶1混合后,取50 μL 用三蒸水稀释10 倍,取稀释后的25 μL 进行涂布,置于专性厌氧环境中继续培养24~48 h。分别检测1、2 MIC 浓度时的抑菌效果。选取BHI 培养基+菌悬液为阴性对照,选取BHI 培养基+复方氯己定漱口液作为阳性对照。以log CFU/mL 为纵坐标,时间为横坐标,进行kill-time 曲线的绘制。进行3 次平行实验。
1.2.5 生物膜制备及分组 将钛片切割研磨后,用无水乙醇与去离子水超声20 min,超声微弧氧化后,经3 mol/L 的NaOH 处理,于60℃浸泡1 h,晾干。调节pH 至7 时,使用KH-550 硅烷联剂超声,再浸入硅烷溶液中浸泡30 s,干燥后待用。收集口腔状况良好、无吸烟史且近期未服用药物的10 名志愿者唾液,男性5 名,女性5 名,平均年龄(40.6±1.6)岁,以4 500 r/min 离心30 min 后取上清液,过滤除菌后备用。将钛片消毒后置于唾液中24 h,形成膜后,转至24 孔板培养,加入500 μL 菌液、1 500 μL 培养基,于相应培养环境培养24~48 h。PBS 冲洗3 次后于戊二醛固定24 h,采用梯度酒精洗脱。取出制备的生物膜置于24 孔板中,分别加入40、20、10、5、2.5 mg/L 的抗菌肽RISE-AP12®、无菌生理盐水与0.6 g/L 复方氯己定漱口液的培养基1 000 μL,制备生物膜。应用酶标仪测定630 nm 处的OD 值。生物膜清除率=(药物处理后OD 值-无菌生理盐水OD 值)/无菌生理盐水OD 值×100%。进行3 次平行实验。
1.3 统计学处理 采用SPSS 19.0 统计软件对本次研究的数据结果进行分析,正态分布的计量资料用±s 表示,采用单因素方差分析,两两比较应用LSD-t 检验方法,以P<0.05 为差异有统计学意义。
2 结果
2.1 抗菌肽RISE-AP12®对主要致病菌的影响 根据MIC 和MBC 定义,判定各致病菌的MIC 和MBC,具体数据见表1。
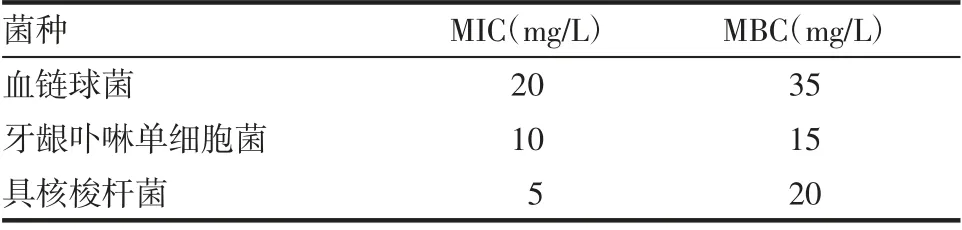
表1 抗菌肽RISE-AP12®对主要致病菌的影响Tab 1 Effect of antimicrobial peptide RISE-AP12 ® on main pathogenic bacteria
2.2 抗菌肽RISE-AP12®作用种植体周围炎主要致病菌的kill-time 曲线 kill-time 曲线发现,在1 MIC 和2 MIC 时均具有较好的杀菌作用,2 MIC的抑菌作用显著强于1 MIC 与阳性对照组(具核梭杆菌:t=1.653、1.763,P=0.013、0.008;牙龈卟啉单细胞菌:t=0.984、1.271,P=0.005、0.007;血链球菌:t=1.548、2.187,P=0.023、0.002),见图1~3。
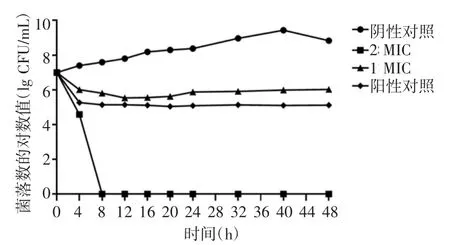
图1 抗菌肽RISE-AP12®作用具核梭杆菌的kill-time 曲线Fig 1 Kill-time curve of antimicrobial peptide RISE-AP12® on Fusobacterium nucleatum
2.3 抗菌肽RISE-AP12®对钛种植体周围炎主要致病菌生物膜的影响 随着抗菌肽RISE-AP12®的浓度增加,其对具核梭杆菌、牙龈卟啉单细胞菌、血链球菌生物膜的清除率也随之增强。当抗菌肽RISE-AP12®浓度为40 mg/L 时,对生物膜的抑制作用最强,清除率显著高于0.6 g/L 复方氯己定漱口液组(具核梭杆菌:t=2.768,P=0.032;牙龈卟啉单细胞菌:t=0.676,P=0.014;血链球菌:t=0.794,P=0.025),见图4~6。
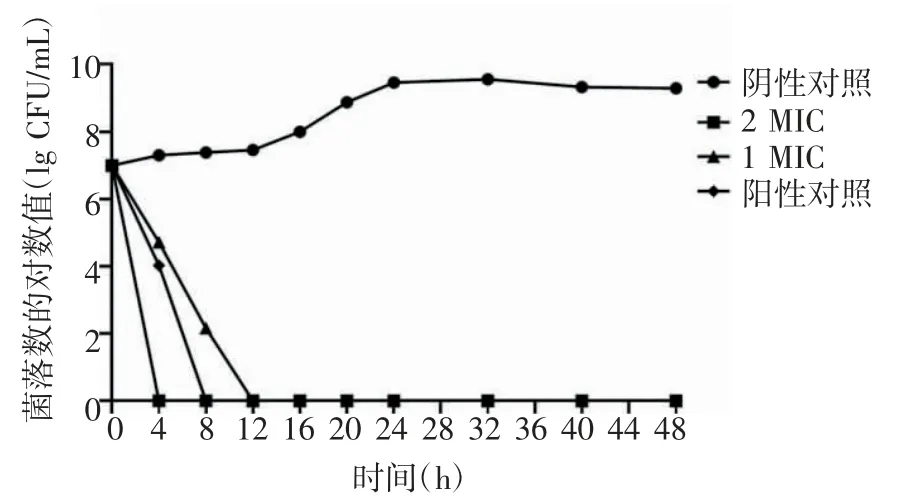
图2 抗菌肽RISE-AP12®作用牙龈卟啉单细胞菌的kill-time 曲线Fig 2 Kill-time curve of antimicrobial peptide RISE-AP12®on Porphyromonasgingivalis
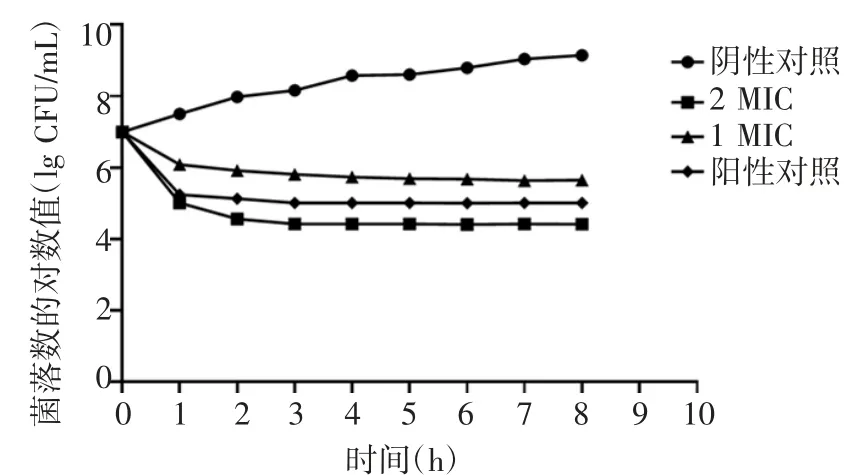
图3 抗菌肽RISE-AP12®作用血链球菌的kill-time 曲线Fig 3 Kill-time curve of antimicrobial peptide RISE-AP12®on Streptococcus sanguis
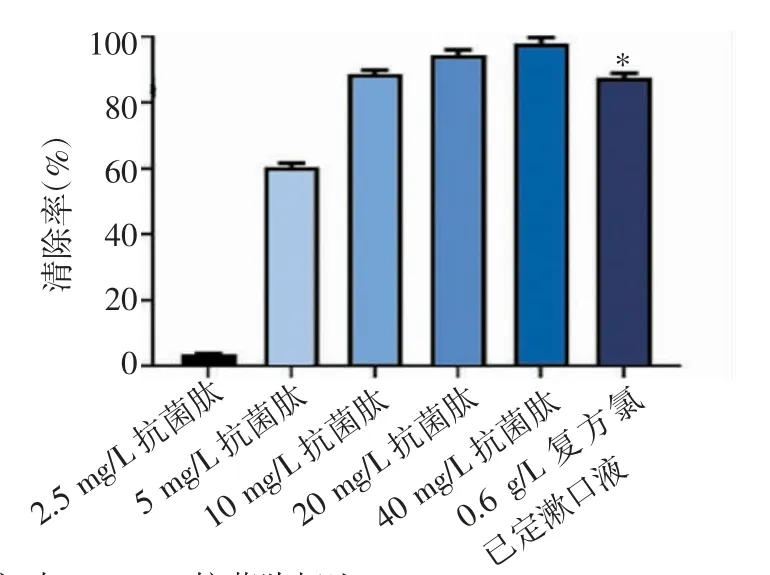
图4 抗菌肽RISE-AP12®对具核梭杆菌生物膜的影响Fig 4 Effect of antimicrobial peptide RISE-AP12®on Fusobacterium nucleatum biofilm
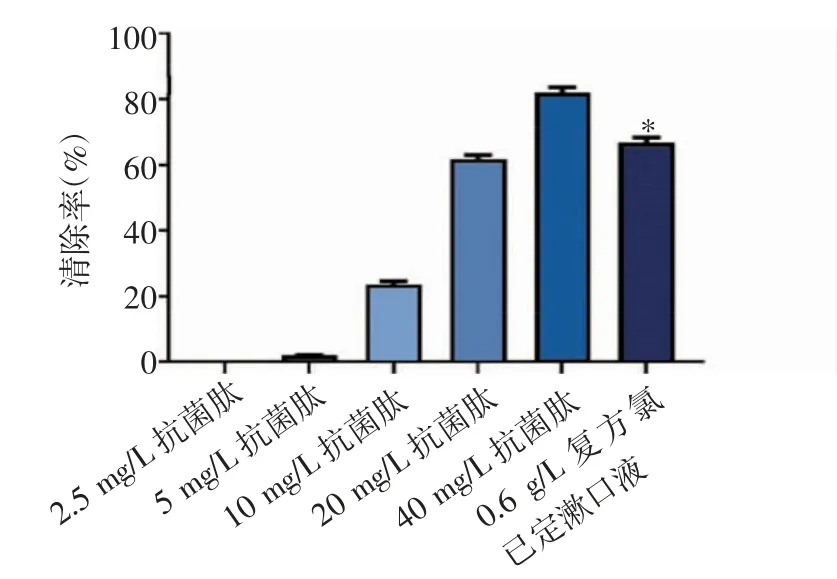
图5 抗菌肽RISE-AP12®对牙龈卟啉单细胞菌生物膜的影响Fig 5 Effect of antimicrobial peptide RISE-AP12®on Porphyromonasgingivalis biofilm
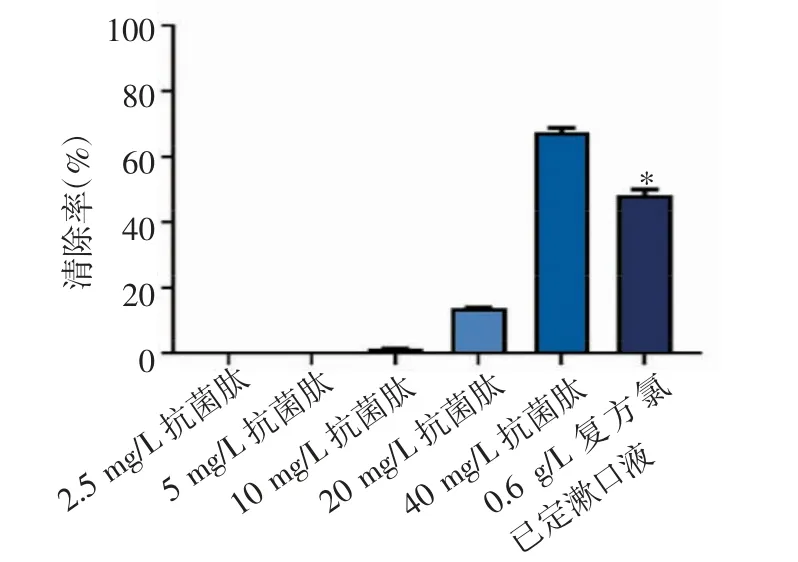
图6 抗菌肽RISE-AP12®对血链球菌生物膜的影响Fig 6 Effect of antimicrobial peptide RISE-AP12®on Streptococcus sanguis biofilm
3 讨论
随着种植体的使用量不断增加,种植体周围炎也变得越来越普遍,关于种植体周围炎的病因学研究越来越受到专家学者的关注[10]。最先认为种植体周围炎发生的原因在于从力学角度出发,认为植入体不能很好负荷咀嚼带来的外力。但是随着研究不断深入,人们发现减少力学因素的影响后并不能减少种植体周围炎的发生。种植体周围炎是慢性发展的过程,骨质进行性破坏,在其发展过程中,菌斑的聚集以及生物膜内部复杂的相互关系与宿主炎性反应的发生、发展密不可分,因此细菌菌落的研究变得越来越热门[11]。其中,具核梭杆菌、牙龈卟啉单胞菌、厌氧菌及螺旋体、福赛坦菌、齿垢密螺旋体等被认为是与种植体周围炎发生最为密切的菌落[12]。在上述众多的细菌库中,血链球菌是最早定植于牙面的一种细菌,在龈上和龈下菌斑中都可检出,可以与多种细菌发生聚集反应[13]。具核梭杆菌是口腔中常见共生细菌,在生物膜中具有共聚反应,可通过黏附素对各个时期细菌的定植进行整合[14]。牙龈卟啉单胞菌是导致种植体周围炎的主要致病菌之一,其龈下的定植需要早期定植菌的存在,如链球菌等。其侵入宿主后可以改变自身基因,抑制中性粒细胞活性,参与生物膜的形成和宿主防御的调节,被认为是重点研究的细菌病原体[15]。因此,选择上述3 种菌种作为本实验的研究对象。
本研究发现,抗菌肽RISE-AP12®对具核梭杆菌的MIC 值最低;对牙龈卟啉单细胞菌的MBC 值最低;而对血链球菌的抑制、杀菌作用相对较弱,这可能是由于血链球菌具有双重特性,其代谢产物对厌氧菌可产生拮抗作用,其MIC、MBC 值最高,分别为20、35 mg/L。一般抗菌药物可呈时间依赖性或浓度依赖性具有杀菌或抑菌作用,本研究进一步绘制抗菌肽RISE-AP12®作用的时间杀菌曲线。根据抗菌肽RISE-AP12®作用于具核梭杆菌、牙龈卟啉单细胞菌与血链球菌的kill-time 曲线发现,在1 MIC和2 MIC 时均具有较好的杀菌作用,2 MIC 的抑菌作用显著强于1 MIC 与阳性对照组,且差异具有统计学意义。较高浓度的抗菌肽RISE-AP12®抑菌作用更强。值得注意的是,随着作用时间延长,抗菌效果并没有持续增长,表明抗菌肽的抗菌作用可能为剂量依赖性,而非时间依赖性。
细菌生物被膜是指细菌相互黏附于接触表面,通过分泌的因子将其自身包绕其中而形成的大量细菌聚集膜样物[16]。细菌生物被膜中的细菌可以采用多种生存策略来逃避宿主的防御,并且拥有着维系共生制衡关系的各种因子,抗菌素想摧毁这样的微生态是相当有难度的[17-18]。研究发现,随着抗菌肽RISE-AP12®的浓度增加,其对具核梭杆菌、牙龈卟啉单细胞菌、血链球菌生物膜的清除率也随之增强,显示出较好的抗菌作用。当抗菌肽RISEAP12®浓度为40 mg/L 时,对生物膜的抑制作用最强,清除率显著高于0.6 g/L 复方氯己定漱口液组,且差异具有统计学意义。目前抗菌肽对细菌细胞膜的作用机制仍不完全清楚。目前提出有孔洞学说(the barrel-stave model)、可变“毯”学说(the carpet model)、离子通道学说(the aggregate channel model)。此外,还有很多研究认为,抗菌肽对细菌细胞膜的作用仅是开始,很多抗菌肽对细菌的杀伤作用都伴随着细胞内的一系列反应。很多抗菌肽都能穿过细菌生物膜,分别与细胞内不同组织结合,产生破坏作用,进而实现对于细菌的抑制作用。目前对于抗菌肽RISE-AP12®来说,虽得知其有一定抗菌作用,但是其具体机制还需要进一步研究。
综上所述,抗菌肽RISE-AP12®可以抑制钛种植体周围炎主要致病菌具梭核杆菌、血链球菌以及牙龈卟啉单胞菌生长,同时可以抑制生物膜生长,从而控制钛种植体周围炎的发生。

