孕期慢性应激通过胎盘GC 屏障致子代情绪损伤的机制
刘红娅, 马淑琴, 陈小惠, 戚发秋, 赵 枫, 付有娟, 关素珍
(1.宁夏医科大学公共卫生与管理学院,银川 750004; 2.宁夏环境因素与慢性病控制重点实验室,银川 750004;3.宁夏医科大学总医院,银川 750004)
随着社会经济的发展,儿童神经精神性疾病,如焦虑症、孤独症等受到社会的广泛关注。越来越多的研究[1]表明,子代神经精神类疾病的发病与母亲孕期应激刺激有极大的联系。孕期长期处于应激状态会引起胎儿暴露于过量糖皮质激素(glucocorticoid,GC)[2],主要为皮质醇,通过胎盘进入宫内,引起胎儿下丘脑-垂体-肾上腺(The hypothalamic pituitary adrenal,HPA)轴改变,导致子代情绪和认知发育异常[3]。在正常妊娠中,胎儿的GC 暴露是由胎盘GC 屏障决定的,胎盘GC 屏障需要11β-羟基类固醇脱氢酶Ⅱ(11β-hydroxysteroid dehydrogenase type 2,11β-HSD2)和P-糖蛋白(P-glycoprotein,P-gp)共同调节,以保证适量却不超量的GC。11β-HSD2 可将GC 从有活性状态转化为无活性状态[4],P-gp 能逆浓度将GC转运到母体面[5],且GC 受体亚家族3C 组成员1(Nuclear Receptor Subfamily 3,Group C,Member 1,NR3C1)在HPA 轴功能紊乱过程中发挥着重要作用[6-7]。目前,孕期慢性应激对胎盘GC 屏障的具体调节机制尚不清楚。本研究拟建立孕期慢性应激大鼠模型,观察子鼠情绪变化,通过检测胎盘GC 屏障相关基因的表达,探讨GC 屏障与子代情绪之间的相关性。
1 资料与方法
1.1 实验动物
选择成年SPF 级未曾受孕的80~90 日龄SD雌性大鼠32 只,体质量(200±20)g,随机分为模型组和对照组,每组16 只。模型组为单笼饲养,对照组4 只/笼饲养。90 日龄以上雄鼠24 只,体质量(220±20)g,分为模型交配组16 只和对照交配组8 只,4 只/笼饲养,雄鼠只为交配所用。均购自宁夏医科大学实验动物中心,许可证号:SYXK(宁)2020-0001。本研究经宁夏医科大学实验动物伦理委员会批准,编号为IACUC-NYLAC-2020068。
1.2 主要试剂和仪器
131I 皮质醇放射免疫试剂盒(北京北方生物技术研究所,中国),蔗糖(北京化学试剂,中国),β-actin 抗体(Santa,美国),11β-HSD2 一抗(Novus,美国),P-gp 一抗(abcam,美国),NR3C1 一抗(abcam,美国),山羊抗兔IgG 二抗(affnity,中国)等;电泳仪(北京市六一仪器厂),Smart 3.0 小动物行为学视频记录与分析系统(深圳市瑞沃德生命科技有限公司,中国)。
1.3 孕期慢性应激模型建立
1.3.1 模型建立方法 适应性饲养7 d 后,选择慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)建立孕期CUMS 动物模型[8]。根据实验室条件选择应激方式:(1)24 h 拥挤环境;(2)24 h 潮湿环境(湿度60%~70%);(3)5 min热水游泳(45 ℃);(4)30 min 摇晃鼠笼;(5)行为束缚2 h;(6)5 min 冰水浴;(7)夹尾2 min(距尾根部1 cm 处)。利用随机数字表法将7 种刺激方式随机安排到28 d 内,每天1 种,应激完成后放回原饲养笼中。
在应激周期第7 天,模型组雌鼠与模型交配组雄鼠(1∶1)进行合笼交配,次日早晨检查雌鼠阴栓(或阴道涂片),明确妊娠后,将雌雄鼠分离,模型组孕鼠继续单笼饲养,在合笼过程中,应激照常进行。对照组雌鼠与对照交配组雄鼠(2∶1)进行合笼交配,确定妊娠后,雌雄分离,对照组孕鼠4 只/笼,在孕18 d 开始单笼饲养。
1.3.2 确认模型成功与否 利用行为学变化及血浆皮质酮来确认孕期CUMS 大鼠模型的成功建立[9-10]。在应激前1 d 和应激第1、7、14、21、28天内眦静脉采血收集血浆,-80 ℃冰箱冷冻待测。同时期进行旷场实验(open field test,OFT)、蔗糖偏好实验(sucrose preference test,SPT)测定母鼠的行为学。
1.4 子鼠分组及样品收集
确认怀孕的第18 天,每组各取8 只孕鼠进行剖宫收集胎盘,-80 ℃冰箱冷冻保存。其余8只孕鼠分娩后获得子鼠,所有子鼠于一周内全部娩出,子鼠出生的当天记为PND0(postnatal day 0,PND0),PND21 断乳,每组按每笼的分娩只数及性别比例从不同窝别中随机抽取16 只子鼠(雌雄各半),记为对照子鼠组和模型子鼠组,雌雄分笼,4 只/笼饲养。PND28 与PND42,记录子鼠体质量并内眦静脉采血收集血浆,-80 ℃冰箱冷冻待测。
1.5 指标测定和方法
1.5.1 血浆皮质酮测定 利用131I 皮质醇放射免疫试剂盒测定血浆皮质醇浓度,根据公式:C 皮质酮=50 × C 皮质醇,得到皮质酮浓度。
1.5.2 母鼠行为学测定 (1)OFT[11]:选择OFT反映箱进行实验,呈立方体(100 cm×100 cm×50 cm),周壁为黑色,底部由25 等分的方块组成。每只大鼠测定时间为5 min,水平运动得分以动物经过的底面块数计数,动物3 爪以上跨入方格内记为1 分;垂直运动得分以直立次数计数,1 次记为1 分。并记录清洁运动次数(大鼠做洗脸样动作)和粪便粒数,每只大鼠开始前彻底清洁敞箱。(2)SPT[12]:分为适应训练部分和测试部分。首先训练大鼠适应含糖饮水,每笼放置2 个装有1%蔗糖水的水瓶自由饮水24 h,第2 天将其中的一瓶换成纯水,适应结束后,禁食禁水24 h,次日给予1 瓶1%蔗糖水,1 瓶纯水,自由饮水1 h后称重。其余时间给予正常饮食。1%蔗糖偏爱百分比=蔗糖水消耗/总液体消耗×100%。
1.5.3 子鼠行为学测定 在PND42 开始,进行子鼠行为学的测定,OFT 和SPT 具体方法同母鼠行为学测定,连续测量3 d,取平均值。在PND45时,开始悬尾实验(tail suspension test,TST)[13],具体操作:将大鼠呈倒悬状态固定在TST 箱上(距子鼠尾尖约5 cm),确保子鼠头部距台面约为20 cm。主要指标为6 min 内的“静止”时间,表现出“失望”状态,并追踪子鼠的挣扎轨迹。连续测定3 d,取平均值。
1.5.4 胎盘GC 屏障相关蛋白11β-HSD2、NR3C1、P-gp 表达的测定 Western blot 测定胎盘GC 屏障相关蛋白11β-HSD2、NR3C1、P-gp 的含量,每100 mg 待测胎盘组织中加入0.8 mL RIPA Lysis Buffer 制备成匀浆后,离心,取上清,采用BCA 法进行蛋白定量。上样缓冲液与样品按5∶1 体积比例进行混合,上样蛋白50 μg,进行凝胶蛋白电泳,采用湿转法将凝胶转移至0.45 μm 的PVDF膜,封闭1 h,加入一抗,4 ℃过夜,回收一抗,加入二抗,显色后以目的蛋白11β-HSD2、P-gp、NR3C1 与β-actin 蛋白的光密度(OD)的比值表示目的蛋白的相对表达量。
1.6 统计学方法
采用SPSS 26.0 统计学软件进行数据分析。计量资料以均数±标准差(±s)表示,组间比较采用t 检验;母鼠相关数据的比较采用重复测量的方差分析;相关性分析采用Pearson 相关分析。检验水准α=0.05,双侧检验。
2 结果
2.1 孕期慢性应激致母鼠血浆皮质酮水平增高
经重复测量方差分析,慢性应激对母鼠皮质酮水平有影响(F=41.399,P<0.05),模型组皮质酮水平随应激时间的变化而变化(F=4.440,P<0.001),分组与时间点的交互作用差异无统计学意义(F=1.134,P>0.05)。同一时间点两组比较发现,模型组血浆皮质酮浓度在应激第14、21、28天均高于对照组(t14=2.412,P <0.05;t21=2.822,P<0.05;t28=2.956,P<0.05)。表明模型组母鼠在孕期处于应激状态,见表1。
表1 应激对母鼠血浆皮质酮浓度的影响(±s,ng·mL-1)

表1 应激对母鼠血浆皮质酮浓度的影响(±s,ng·mL-1)
*P<0.05。
组别n应激前1 d应激第1 天应激第7 天应激第14 天应激第21 天应激第28 天对照组8325.74±12.57368.31±59.20227.45±127.60285.63±81.64341.78±48.40320.43±84.76模型组8367.99±52.66388.09±77.40320.86±86.86394.02±97.41* 444.12±90.43* 463.71±107.76*?
2.2 孕期慢性应激致母鼠行为学改变
SPT 结果经重复测量方差分析,组间比较发现,模型组1%蔗糖偏爱百分比与对照组之间差异有统计学意义(F组间=15.053,P<0.05;F组内=1.547,P>0.05;F交叉=2.224,P>0.05),同一时间点两两比较发现,模型组1%蔗糖偏爱百分比在应激第 14、21 天均低于对照组(t14=-3.922,P<0.05;t21=-2.870;P<0.05),见图1。模型组蔗糖消耗量与对照组之间差异有统计学意义(F组间=2.345,P<0.05;F组内=72.802,P<0.05;F交叉=3.669,P<0.05),进一步两两比较发现:在应激14 d 模型组蔗糖水消耗量、液体总消耗量均低于对照子鼠组(t14蔗糖消耗量=-4.025,P<0.05;t14液体总消耗量=-2.484,P<0.05)。
OFT 结果经重复测量方差分析,组间比较发现,模型组水平运动得分与对照组差异有统计学意义(F组间=4.368,P<0.05;F组内=4.384,P<0.05;F交叉=4.824,P>0.05),模型组垂直运动得分与对照组存在差异(F组间=4.215,P<0.05;F组内=5.649,P<0.05;F交叉=1.638,P>0.05),进一步两两比较发现,在应激第7、21、28 天模型组水平得分均低于对照组(t7=-4.018,P<0.05;t21=-0,664,P<0.05;t28=-2.444,P<0.05),在应激第21 天模型组垂直运动得分低于对照组(t21=-2.447,P<0.05),见图1。
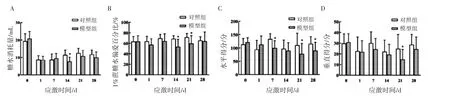
图1 孕期慢性应激致母鼠行为学改变
2.3 孕期慢性应激对子代的影响
2.3.1 孕期慢性应激致子代体质量降低 与对照子鼠组相比,模型子鼠组PND28、PND42 体质量均低于对照子鼠组(P 均<0.05),见表2。
2.3.2 孕期慢性应激致子代血浆皮质酮浓度升高 模型子鼠组的血浆皮质酮浓度与对照子鼠组差异有统计学意义(P<0.05),在PND28 和PND42时,模型子鼠组的血浆皮质酮水平均高于对照子鼠组(P 均<0.05),见表2。
表2 孕期慢性应激对子代体质量和血浆皮质酮的影响(±s)
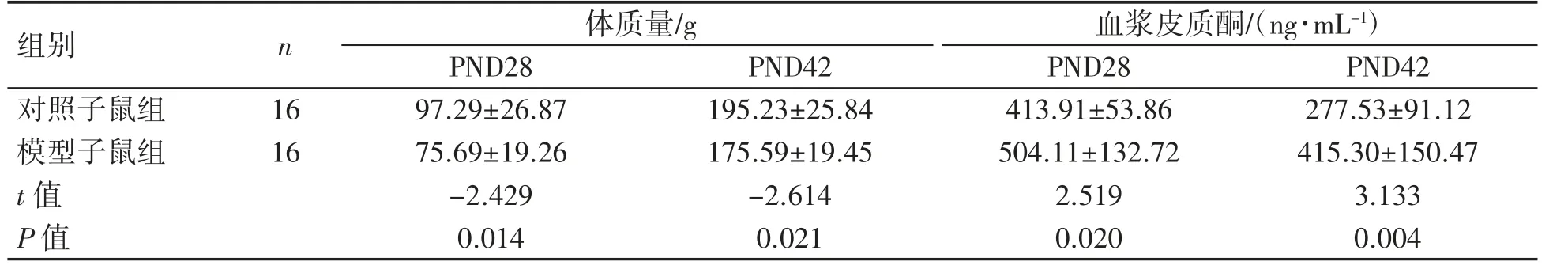
表2 孕期慢性应激对子代体质量和血浆皮质酮的影响(±s)
组别n体质量/g血浆皮质酮/(ng·mL-1)PND28PND42PND28PND42对照子鼠组1697.29±26.87195.23±25.84413.91±53.86277.53±91.12模型子鼠组1675.69±19.26175.59±19.45504.11±132.72415.30±150.47 t 值-2.429-2.6142.5193.133 P 值0.0140.0210.0200.004
2.3.3 孕期慢性应激致子代焦虑、抑郁样行为 模型子鼠组的水平运动得分低于对照子鼠组(P<0.05),表明模型子鼠组较对照子鼠组的探究行为减少,处于紧张状态。模型子鼠组的糖水消耗量、液体总消耗量和1%蔗糖偏爱百分比均低于对照子鼠组(P 均<0.05)。模型子鼠组与对照子鼠组的静止时间差异有统计学意义(P<0.05),模型子鼠组静止时间长于对照子鼠组,表明模型子鼠组处于失望、抑郁状态,见表3。
表3 孕期慢性应激致子鼠行为学改变(±s)
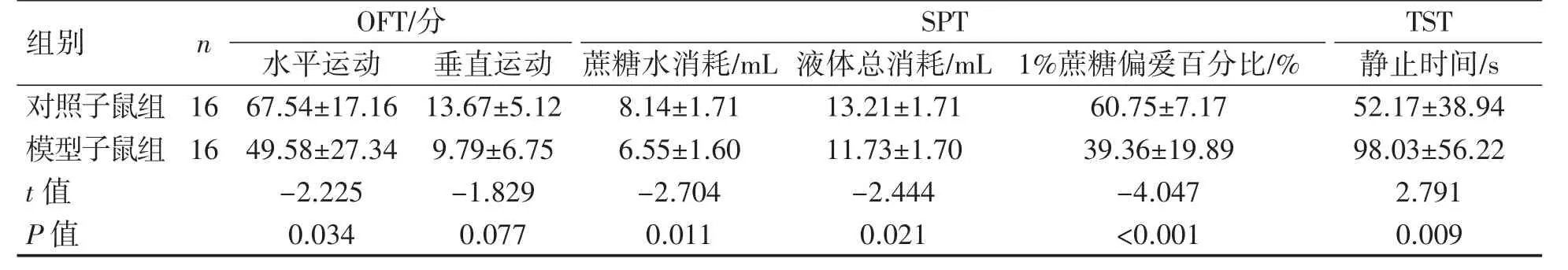
表3 孕期慢性应激致子鼠行为学改变(±s)
组别nOFT/分SPTTST水平运动垂直运动 蔗糖水消耗/mL 液体总消耗/mL 1%蔗糖偏爱百分比/%静止时间/s对照子鼠组 16 67.54±17.16 13.67±5.128.14±1.7113.21±1.7160.75±7.1752.17±38.94模型子鼠组 16 49.58±27.34 9.79±6.756.55±1.6011.73±1.7039.36±19.8998.03±56.22 t 值-2.225-1.829-2.704-2.444-4.0472.791 P 值0.0340.0770.0110.021<0.0010.009
2.4 孕期慢性应激对子代胎盘GC 屏障相关蛋白表达的影响
子鼠胎盘组织Western blot 条带图结果显示:模型子鼠组胎盘组织GC 相关蛋白11β-HSD2、P-gp 的相对表达均低于对照子鼠组(t=2.485,P <0.05;t=2.420,P <0.05),NR3C1 的相对表达高于对照子鼠组(t=2.240,P<0.05),见图2。

图2 胎盘GC 屏障相关蛋白变化
2.5 子鼠情绪损伤与GC 屏障相关蛋白的相对表达的相关性分析
相关性分析显示,子鼠胎盘GC 屏障相关蛋白11β-HSD2、P-gp 的相对表达与OFT 的水平运动得分均呈正相关(P 均<0.05),与SPT 的蔗糖水消耗、1%蔗糖偏爱百分比均呈正相关(P 均<0.05),与TST 的静止时间呈负相关(P<0.05);子鼠胎盘GC 屏障相关蛋白NR3C1 的相对表达与OFT 水平运动、垂直运动得分均呈负相关(P 均<0.05),与TST 的静止时间呈正相关(P<0.05),与SPT 蔗糖水消耗、1%蔗糖偏爱百分比均呈负相关(P 均<0.05),见表4。
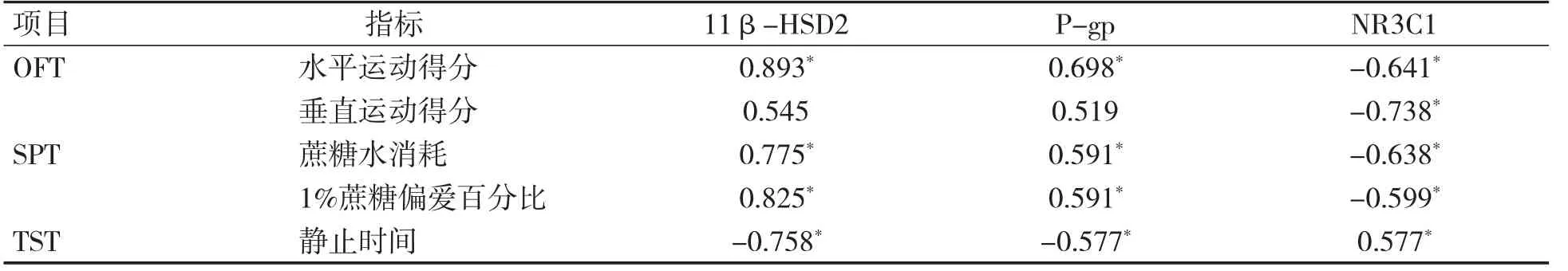
表4 子鼠情绪损伤与胎盘GC 屏障相关蛋白的相对表达相关性分析(r 值)
3 讨论
本研究通过建立孕期慢性应激动物模型发现,模型组的血浆皮质酮水平在应激第14、21、28 天均较高于对照组,与文献[14]的研究结果相似,模型组母鼠的糖水偏爱度降低,旷场试验的活动度和探索能力均降低,与以往的研究[15]结果相似,结果提示:模型组处于应激状态。此次造模周期为28 d,在应激第7 天合笼,母鼠在孕期以及怀孕期间都接受应激刺激,在造模过程中发现,模型组和对照组在应激第7、14 天的血浆皮质酮水平较应激前1 d 和应激第1 天均有降低趋势,引起这一结果的原因可能是第7 天为雌雄合笼的第1 天,第14 天合笼结束,大鼠当时所处的状态为怀孕初期和交配期,这一时期的激素水平不稳,这一现象可作为后期研究的切入点进行深入研究。
研究[16]表明,孕期长期焦虑会增加低体质量儿等不良妊娠结局的发生。本研究结果显示,在PND28、PND42 模型子鼠组的体质量均低于同期对照子鼠组,与相关研究[17]结果一致,说明孕期慢性应激致子代体质量偏低。本研究结果表明,在PND28、PND42 模型子鼠组血浆皮质酮水平均高于对照子鼠组,有研究[18]提到,孕期受到应激刺激,会激活母亲自身HPA 轴改变,产生大量的皮质醇,致使子代的皮质酮升高,影响子代的情绪、认知能力,表明孕期应激会使子代的血浆皮质酮升高。
目前多采用OFT 来反映动物对新环境的恐惧、焦虑状态[19]。本研究结果显示,相对于对照子鼠组,模型子鼠组对于新鲜事物的探索行为和适应能力降低,与赵枫等[20]研究结果一致。SPT 是一种反映快感是否缺失的指标[12],结果显示,模型子鼠组的蔗糖水消耗和1%蔗糖偏好百分比均低于对照子鼠组,表明孕期慢性应激导致子代对幸福事件的反应能力下降,与Lu 等[21]研究结果一致。STT 是反映失望情绪较经典的试验方法[22],结果显示,孕期慢性应激会致使子代对被迫体位的反抗能力降低,表现出失望、抑郁状态,与甄凤亚等[23]研究结果类似。以上结果均表明孕期慢性应激可导致子鼠出现焦虑、抑郁情绪。
母体GC 进入胎盘和胎儿是通过胎盘GC 屏障调控的,胎盘组织中11β-HSD2、P-gp 和NR3C1 含量丰富,且与胎盘GC 屏障的开放有密切关系[24-25]。本研究发现,模型子鼠组胎盘GC 屏障关键基因11β-HSD2 相对表达下调,表明被代谢灭活的GC 含量减少,与相关研究[26]结果相似;P-gp 的相对表达下调,表明从胎儿面外将GC 排至母体面的量减少,与以往的研究[27]一致。蛋白NR3C1 的相对表达上调,表明与GC 受体NR3C1结合的GC 含量增加,与相关研究[28]结果相似。以上结果均表明,模型子鼠组暴露于高皮质酮水平。结合相关性分析结果,孕期慢性应激子鼠情绪损伤与胎盘GC 屏障相关蛋白11β-HSD2、Pgp 的相对表达下降,NR3C1 的相对表达升高有关。正如孕期慢性应激引起机体HPA 轴持续激活,致使母体产生大量的GC,引起胎盘GC 屏障改变,影响胎儿的HPA 轴,进而影响胎儿情绪、认知等方面[29-30]。
综上所述,孕期慢性应激导致子鼠出现焦虑、抑郁情绪,其机制可能与胎盘GC 屏障关键调节基因11β-HSD2、P-gp 和NR3C1 的异常表达有关。近些年,孕期母体的焦虑引起胎盘GC屏障相关基因DNA 甲基化程度异常,并在出生后长期存在,最终造成胎儿HPA 轴功能失调及出生后神经行为异常的研究逐渐增多,因此,接下来我们将进一步确定胎盘GC 屏障相关基因的异常甲基化,以及甲基化终生GC 反应和HPA 轴失调致认知发育损伤的机制,这对于探究成年疾病的胎儿起源和寻找阻断胎盘GC 屏障改变的分子靶标,具有重要的理论和实践意义。

