不同水平硒对oxLDL 诱导人脐静脉内皮细胞氧化损伤的保护作用
郎艳芝, 王 雷, 李 娜, 杨 文, 冉林武,
(1.宁夏医科大学公共卫生与管理学院,银川 750004; 2.宁夏环境因素与慢性病控制重点实验室,银川 750004;3.宁夏医科大学实验动物中心,银川 750004)
血管内皮细胞是构成动脉、静脉和毛细血管的一层单层内皮细胞,是血液和组织之间的天然屏障[1]。血管内皮细胞损伤与高血压、糖尿病、冠心病、心肌病、动脉粥样硬化等多种疾病的病理过程密切相关[2]。氧化型低密度脂蛋白(oxidized low density lipoprotein,oxLDL)能够诱导血管内皮细胞氧化应激,降低细胞抗氧化能力,引起血管内皮细胞氧化损伤[3]。目前,通过降低氧化应激改善血管内皮细胞功能,已成为预防和治疗心血管疾病的一种策略[4]。硒是人体必需的微量元素之一,流行病学发现硒具有预防心血管疾病的功效[5-6]。硒主要通过硒蛋白发挥抗氧化作用,进而起到保护血管内皮细胞的功能。但硒浓度变化如何影响硒蛋白的生物学功能,特别是对心血管系统的影响,仍有待进一步研究。本文以人脐静脉内皮细胞(EA.hy926 细胞)为研究对象,观察不同硒浓度对oxLDL 诱导EA.hy926 细胞氧化损伤的保护作用,探讨血管内皮细胞中谷胱甘肽过氧化物酶(GPx)1 和GPx4 的作用。
1 材料与方法
1.1 主要试剂
EA.hy926 细胞购自上海科学院细胞库;亚硒酸钠(Na2SeO3)购自西亚试剂;oxLDL 购自广州奕源生物科技有限公司;高糖型DMEM 培养基、胎牛血清购自美国Gibco 公司;青霉素链霉素双抗、0.25%胰蛋白酶消化液购自北京Solarbio 公司;磷酸盐缓冲液购自美国Hyclone 公司;MTT细胞增殖检测试剂盒、全蛋白提取试剂盒、BCA蛋白定量检测试剂盒、SDS-PAGE 凝胶试剂盒均购自南京凯基生物科技发展有限公司;活性氧(ROS)检测试剂盒、超氧化物歧化酶(SOD)测定试剂盒、丙二醛(MDA)测定试剂盒购自南京建成生物工程公司;总GPx 检测试剂盒购自碧云天生物技术有限公司;β-Actin 抗体购自北京中杉金桥公司;GPx1 抗体购自美国Santa Cruz 公司;GPx4 抗体购自美国Abcam 公司;JC-1 检测试剂盒、HRP 标记山羊抗兔IgG 抗体、HRP 标记山羊抗鼠IgG 抗体购自美国Abbkine 公司;ECL 发光液购自美国Thermo 公司。
1.2 实验方法
1.2.1 细胞培养 EA.hy926 细胞培养于DMEM高糖完全培养基(含10%胎牛血清和1%青霉素链霉素双抗)中,置于37 ℃,含5% CO2恒温培养箱中培养。当EA.hy926 细胞铺满T25 培养瓶底部70%时,开始进行后续实验。
1.2.2 MTT 法测定细胞存活率 将EA.hy926 细胞培养在T25 培养瓶中,待细胞生长融合至70%时,PBS 液清洗1 次,加入含0.5%胎牛血清的高糖DMEM 培养基培养24 h。PBS 液清洗细胞1次,加入用含0.5%胎牛血清的高糖DMEM 配制的不同浓度的0、0.05 和0.5 μmol·L-1Na2SeO3培养基。培养24 h 后,将不同硒浓度的细胞用PBS 液清洗1 次,分别加入1 mL 含乙二胺四乙酸(EDTA)的胰蛋白酶消化液消化,重悬计数,细胞按1.5×104个/mL 的浓度接种于96 孔板,每孔200 μL,培养8 h 后,分为6 组:缺硒组(0 μmol·L-1Se),正常硒组(0.05 μmol·L-1Se),补充硒组(0.5 μmol·L-1Se),缺硒(0 μmol·L-1Se)+oxLDL组,正常硒(0.05 μmol·L-1Na2SeO3)+oxLDL 组,补充硒(0.5 μmol·L-1Na2SeO3)+oxLDL 组,oxLDL浓度为100 μg·ml-1,每组6 个重复孔,继续培养16 h。培养结束后,弃旧培养基,每孔加入50 μL的1 mg·mL-1MTT 溶液,在培养箱内避光孵育4 h,弃去MTT 溶液,每孔加入150 μL 的二甲基亚砜(DMSO),室温避光摇床振荡15 min,充分溶解甲瓒晶状体。同时设置空白调零孔。使用酶标仪在490 nm 处检测各孔吸光度(A)值,计算细胞存活率。细胞存活率=(实验组吸光度值-空白孔吸光度值)/(对照组吸光度值-空白组吸光度值)×100%。
1.2.3 EA.hy926 细胞内GPx、SOD 和MDA 的测定 待细胞在培养瓶中生长融合至70%时,加入含0.5%胎牛血清的高糖DMEM 培养基培养24 h。更换培养基为含不同硒浓度的培养液继续培养细胞24 h。然后,将细胞分为6 组继续培养16 h。培养结束后,吸去上清,PBS 液清洗1 次,用0.25%的胰酶室温消化1 min,加培养基终止消化。1 000 r·min-1,离心3 min 弃去培养基。加入1 mL的PBS 液轻轻吹打细胞沉淀,再次1 000 r·min-1,离心3 min 弃去PBS 液,收集细胞。根据试剂盒说明,检测细胞内GPx、SOD 和MDA 的含量。
1.2.4 DCFH-DA 探针检测EA.hy926 细胞内的ROS 按照1.2.2 中所述,将培养在不同浓度Na2SeO3(0、0.05、0.5 μmol·L-1)中的细胞调整为1×105个/L 接种于24 孔板,培养8 h 后,将细胞分为缺硒组、正常硒组、补充硒组、缺硒+oxLDL组、正常硒+oxLDL 组、补充硒+oxLDL 组,继续培养16 h,每组设3 个重复。培养结束后,ROS 阳性组细胞用12 μmol·L-1的供氢体处理30 min;DMSO 对照组使用含DMSO 的培养基处理30 min。处理结束后,弃去旧培养液,每孔细胞用PBS 液洗涤2 次,再加入10 μmol·L-1的DCFH-DA 染料500 μL,培养箱内避光孵育30 min,弃去染液,每孔加入500 μL 的PBS,用倒置荧光显微镜观察细胞内ROS 并拍照。
1.2.5 JC-1 染色检测EA.hy926 细胞内线粒体损伤情况 按1.2.4 培养细胞24 h 后,弃去旧培养基,每孔细胞加入500 μL 的JC-1 工作液,避光孵育30 min,弃去染色液,PBS 液洗涤细胞2 次,每孔加入500 μL 的PBS 液,使用倒置荧光显微镜观察细胞内线粒体损伤情况并拍照。
1.2.6 Western blot 检测EA.hy926 细胞内GPx1、GPx4 蛋白表达 收集各组细胞,使用全蛋白提取试剂盒提取蛋白,再用BCA 法检测蛋白浓度。等量蛋白质上样,10%SDS-PAGE 凝胶分离蛋白,250 V 电泳25 min,湿转法(300 mA,60 min)将蛋白转至PVDF 膜,5%脱脂奶粉室温摇床封闭2 h,4 ℃一抗(GPx1 抗体以1∶100 比例稀释,GPx4 抗体以1∶1 000 比例稀释,β-Actin 抗体以1∶1 500 比例稀释)孵育过夜,TBST 液洗膜3 次后二抗室温孵育1 h,接着TBST 液洗膜3 次,加适量ECL 发光液用BIO-RAD 凝胶成像仪进行显影曝光。以β-Actin 为内参,采用Image J 软件对目的条带进行灰度值分析。目标蛋白相对表达量=目标蛋白灰度值/内参灰度值。GPx1 和GPx4蛋白下降比例=(未添加oxLDL 时目标蛋白相对表达量-添加oxLDL 后目标蛋白相对表达量)/未添加oxLDL 时目标蛋白相对表达量。
1.3 统计学方法
采用SPSS 26.0 统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,多组均数间比较采用方差分析,两两比较采用LSD-t 法。P≤0.05 为差异有统计学意义。
2 结果
2.1 不同水平硒对EA.hy926 细胞存活率的影响
显微镜下显示,未添加oxLDL 时细胞贴壁生长,边界清晰,均匀分布,数量较多;经oxLDL处理后,细胞收缩,贴壁能力下降,边界不清楚,悬浮细胞增多,细胞间隙增大,数量减少,而0.5 μmol·L-1Na2SeO3处理之后,细胞状态有所恢复。MTT 实验结果显示,在相同硒水平下,oxLDL 能降低细胞的存活率(P<0.05);oxLDL 氧化诱导EA.hy926 细胞后,与正常硒水平(0.05 μmol·L-1Se)相比,缺硒(0 μmol·L-1Se)不能提高oxLDL 诱导的细胞存活率(P<0.05),而补充硒(0.5 μmol·L-1Se)能够使细胞存活率升高(P<0.05);未经oxLDL诱导时,与正常硒水平相比较,缺硒使细胞存活率下降(P<0.05),见图1。
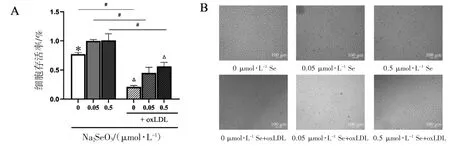
图1 不同水平硒对EA.hy926 细胞存活率的影响
2.2 不同水平硒对EA.hy926 细胞内GPx、SOD和MDA 水平的影响
相同硒水平下,oxLDL 能够诱导细胞GPx、SOD 活力降低(P 均<0.05),MDA 含量上升;细胞经oxLDL 处理后,与正常硒水平相比,缺硒使细胞的GPx 活力下降,MDA 含量上升(P 均<0.05),补充硒使细胞GPx 活力上升,MDA 含量下降(P 均<0.05);此外,细胞未经oxLDL 处理时,与正常硒水平相比,缺硒使细胞GPx、SOD 活力下降,MDA 含量升高(P 均<0.05),补充硒使细胞GPx 活性上升(P<0.05),见表1。
表1 不同水平硒对EA.hy926 细胞内抗氧化指标的影响(±s)
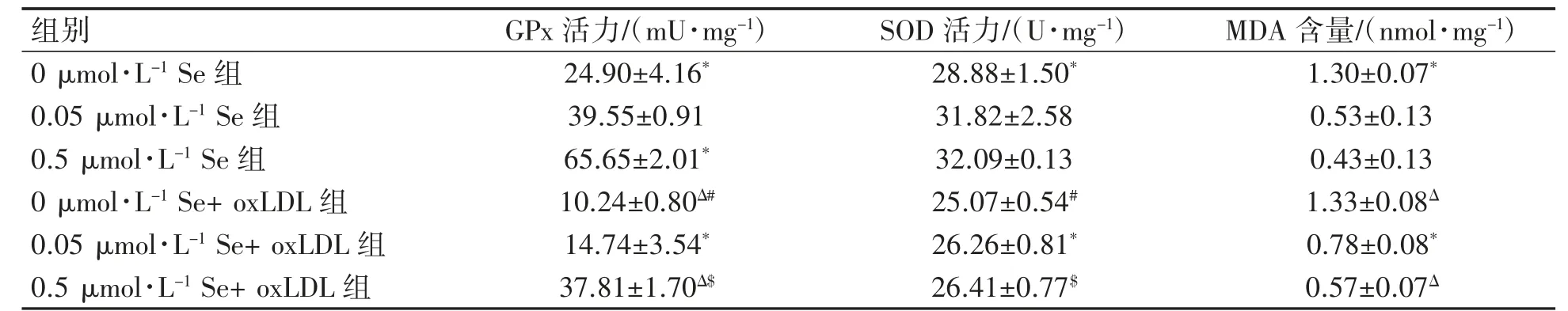
表1 不同水平硒对EA.hy926 细胞内抗氧化指标的影响(±s)
与0.05 μmol·L-1 Se 组比较*P<0.05;与0.05 μmol·L-1 Se+ oxLDL 组比较ΔP<0.05;与0 μmol·L-1 Se 组比较#P<0.05;与0.5 μmol·L-1 Se 组比较$P<0.05。
组别GPx 活力/(mU·mg-1)SOD 活力/(U·mg-1)MDA 含量/(nmol·mg-1)0 μmol·L-1 Se 组24.90±4.16*28.88±1.50*1.30±0.07*0.05 μmol·L-1 Se 组39.55±0.9131.82±2.580.53±0.13 0.5 μmol·L-1 Se 组65.65±2.01*32.09±0.130.43±0.13 0 μmol·L-1 Se+ oxLDL 组10.24±0.80Δ#25.07±0.54#1.33±0.08Δ 0.05 μmol·L-1 Se+ oxLDL 组14.74±3.54*26.26±0.81*0.78±0.08*0.5 μmol·L-1 Se+ oxLDL 组37.81±1.70Δ$26.41±0.77$0.57±0.07Δ
2.3 不同水平硒对EA.hy926 细胞内ROS 水平的影响
相同硒水平下,添加oxLDL 增加了各组细胞内ROS 水平(P<0.05);oxLDL 诱导细胞后,与正常硒水平相比较,缺硒使细胞内ROS 水平增加(P<0.05),补充硒能够降低oxLDL 诱导的细胞内ROS 的产生(P<0.05);细胞未经oxLDL 诱导时,与正常硒水平相比较,缺硒使细胞内ROS 水平增加(P<0.05),见图2。
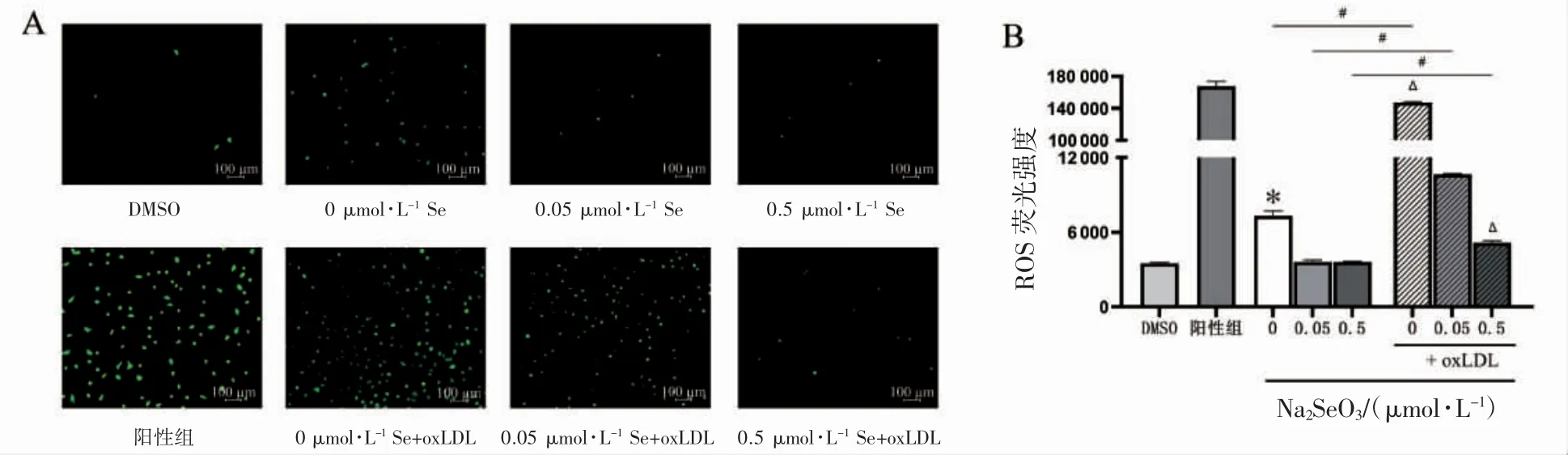
图2 不同水平硒对EA.hy926 细胞内ROS 水平的影响
2.4 不同水平硒对EA.hy926 细胞线粒体损伤的影响
JC-1 从红色荧光到绿色荧光的转变表示线粒体膜电位下降。线粒体未受到损伤时,JC-1 染料在线粒体中聚集形成红色荧光团块;线粒体受到损伤时,JC-1 染料以单体形式在EA.hy926 细胞质中保留转变为绿色荧光。相比未添加oxLDL的EA.hy926 细胞,oxLDL 诱导的EA.hy926 细胞绿色荧光增多,红色荧光减弱,线粒体膜电位下降;且添加oxLDL 诱导细胞后,随着硒水平的增加,线粒体膜电位有上升趋势,见图3。

图3 不同水平硒对EA.hy926 细胞线粒体损伤的影响
2.5 不同水平硒对EA.hy926 细胞GPx1、GPx4蛋白表达水平的影响
Western blot 结果显示,相同硒水平下,oxLDL能够诱导细胞GPx1 和GPx4 蛋白表达水平均降低(P 均<0.05);细胞经oxLDL 处理后,与正常硒水平比较,缺硒使细胞GPx1 和GPx4 表达均降低(P<均0.05),补充硒能够促进细胞GPx1 和GPx4表达(P 均<0.05);另外,细胞未添加oxLDL 时,随着硒浓度增加,GPx1 和GPx4 表达增加(P<0.05)。细胞经oxLDL 诱导后,GPx1 和GPx4 蛋白表达水平均下降,且正常硒水平处理下,细胞GPx1 和GPx4蛋白的下降比例差异均有统计学意义(P 均<0.05),见图4。
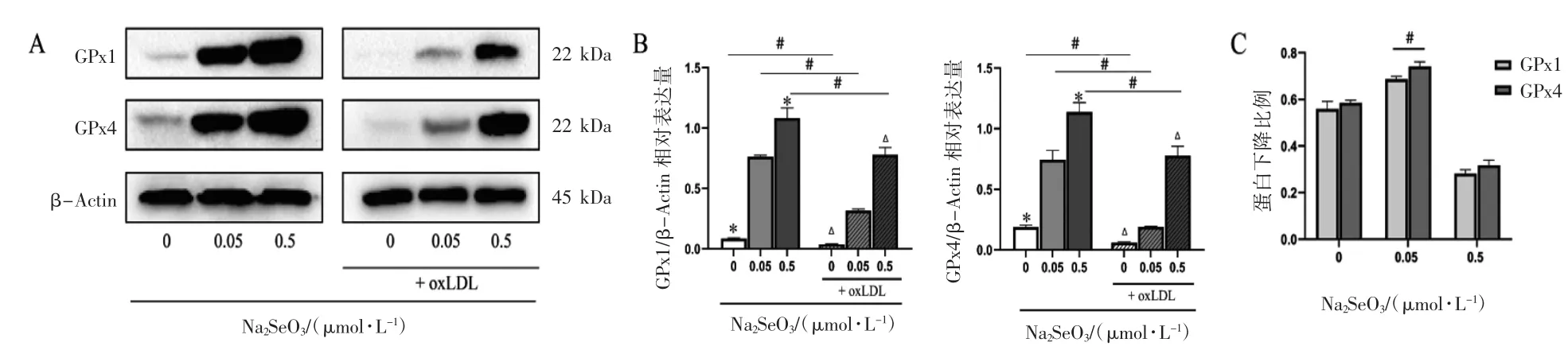
图4 不同水平硒对EA.hy926 细胞GPx1、GPx4 蛋白表达水平的影响
3 讨论
正常生理状态下,体内氧化与抗氧化水平处于动态平衡状态,当机体受到有害刺激时,体内氧化与抗氧化作用平衡紊乱,产生过多ROS,引发氧化应激,损伤血管内皮细胞[7]。低密度脂蛋白在体内被氧化修饰为oxLDL 是血管内皮细胞氧化应激的早期标志[8]。oxLDL 可诱导血管内皮细胞ROS 的产生[9],过多的ROS 引发细胞脂质过氧化反应,产生大量MDA,加剧细胞氧化损伤的程度。此外,ROS 能够使线粒体通透性增加,膜电位下降,影响线粒体功能,导致细胞损伤[10]。GPx 和SOD 作为机体内重要的抗氧化酶,能够清除过多的ROS,抑制脂质过氧化反应,保护细胞免于氧化损伤[11]。本研究结果显示,oxLDL 诱导EA.hy926细胞后,细胞内GPx、SOD 活力下降,ROS、MDA含量升高,同时线粒体膜电位下降,与相关研究结果一致[12-13],说明oxLDL 诱导EA.hy926 细胞发生氧化应激造成细胞损伤。
硒是人体必需的一种微量元素[14-15],具有抗氧化、抗炎、抗病毒、抗菌等多种功能[16]。硒还能促进细胞增殖,增强细胞抗氧化能力[16],通过激活和升高GPx、SOD 水平,降低ROS 和MDA的释放来降低氧化应激,缓解氧化损伤[17]。本研究结果显示,添加0.05 μmol·L-1Se 以及补充0.5 μmol·L-1Se 均可以促进EA.hy926 细胞增殖,提高EA.hy926 细胞中GPx、SOD 活力,同时抑制ROS 和MDA 的产生,使线粒体膜电位下降,且oxLDL 诱导EA.hy926 细胞产生氧化应激后,采用0.05 μmol·L-1Se 以及0.5 μmol·L-1Se 干预,GPx和SOD 均有一定程度的恢复,同时ROS 和MDA水平有所下降,线粒体膜电位上升,说明细胞抗氧化能力依然随着硒浓度增加而增强,这与相关报道[17]结果一致。
硒在体内主要通过硒蛋白来发挥作用,已发现的硒蛋白有25 种。其中,GPx1 和GPx4 是血管内皮细胞内重要的抗氧化蛋白。GPx1 可以降解ROS,抑制细胞内过氧化氢的积累。GPx4 主要作用是清除细胞内产生的脂质过氧化物,从而发挥抗氧化作用,抵抗细胞氧化损伤[18]。Adeniran 等[19]研究表明,硒预处理使脂多糖(LPS)诱导的BEND细胞中GPx1 和GPx4 在mRNA 和蛋白水平均升高,说明硒可能通过调节BEND 细胞中GPx1 和GPx4 蛋白的表达而发挥保护作用。同样,EA.hy926细胞经oxLDL 诱导氧化应激后,GPx1 和GPx4 蛋白表达均下降,补充硒能够升高GPx1 和GPx4蛋白表达。而且,相比未发生氧化应激时,正常硒组GPx1 蛋白表达的下降程度小于GPx4 蛋白的下降程度。由此推测,GPx4 在正常硒浓度下抵抗oxLDL 诱导的氧化损伤中起重要作用。
综上所述,不同硒水平对oxLDL 诱导EA.hy926细胞的保护作用可能是不同的。补充0.5 μmol·L-1硒可同时上调硒蛋白GPx1 和GPx4 的表达,降低细胞氧化应激水平,增加EA.hy926 细胞增殖活性,使细胞免受氧化应激损伤。但是在此过程中,不同硒水平调节硒蛋白GPx1 和GPx4 表达的具体机制尚未得知,还需进行下一步深入研究。

