LSEC、Raw264.7、Hepa1-6三种鼠源细胞系cGAS-STING信号通路的本底表达及激活研究①
周钰婷,张 勇,杨 建,李 飞
(1新疆医科大学药学院,乌鲁木齐 830011,2桂林医学院附属医院广西肝脏损伤与修复分子医学重点实验室,3桂林医学院附属医院广西神经鞘脂代谢相关疾病基础研究重点实验室,广西 桂林 541001)
cGAS-STING 信号通路是一个可以识别细胞内异常DNA 的天然免疫信号通路[1]。此信号通路在机体对抗病原微生物感染及抗肿瘤免疫反应中起到了重要作用,同时该信号通路的异常激活也可导致多种自身免疫性疾病的发生[2]。研究表明,cGASSTING 信号通路普遍表达于肝脏等各组织细胞,且在固有免疫细胞中呈高表达[3]。肝脏分为肝实质细胞和非实质细胞,肝实质细胞的比例约为60%~80%,其余20%~40%为肝脏非实质细胞包括肝窦内皮细胞(Liver sinusoidal endothelial cells,LSECs)、巨噬细胞(又称库普弗细胞,Kupffer Cell,KCs)、树突状细胞、星状细胞等[4]。LSECs是肝脏内数目最多的肝脏非实质细胞,约占肝脏非实质细胞总数的50%[5]。肝巨噬细胞对于维持肝脏本身以及整个身体的体内平衡具有不可或缺的作用[6]。本研究采用LSEC、Raw264.7、Hepa1-63 种细胞分别模拟肝窦内皮细胞、巨噬细胞、肝实质细胞,探讨经典cGAS-STING 激活剂poly(dA:dT)、DMXAA 以及乙型肝炎病毒对3 种细胞cGAS-STING信号通路相关基因表达的影响。
1 材料与方法
1.1 细胞小鼠肝窦内皮细胞(LSEC)、小鼠肝癌细胞系(Hepa1-6)、人肝癌细胞(HepG2.2.15)均由广西肝脏损伤与修复分子医学重点实验室赠送并保存,小鼠巨噬细胞(Raw264.7)购自中科院细胞库。
1.2 试药胎牛血清(美国Gibco 公司);DMEM 高糖培养基(美国Gibco 公司);0.25%胰酶、青链霉素(中国Solarbio 公司);Lipofectamine3000(中国Invitrogen公司);EZ-press RNA Purification Kit(美国EZBioscience 公司,批号:B0004D)、2×SYBR Green qPCR Master Mix (ROX2 plus)(美国EZBioscience 公司,批号:A0001-R2);逆转录试剂盒(中国诺唯赞公司);RIPA细胞/组织蛋白裂解液(中国碧云天公司);兔源二抗、鼠源二抗(美国Thermo 公司);重组Anti-IRF3 抗体(美国Abcam 公司,批号:ab68481);cGAS Rabbit pAb,p-IRF3 抗体(中国ABclonal 公司);TMEM173/STING Polyclonal Antibody(中国Proteintech 公司,批号:19851-1-AP);β-Actin 抗体(C4):sc-47778(美国Santa Cruz 公司);磷酸化IRF3 抗体(中国生工生物工程公司);小鼠STING 激活剂2,5-己酮可可碱(DMXAA)(中国阿拉丁公司);poly(dA:dT)(中国Invivogen公司);聚乙二醇8000(中国阿拉丁公司)。
1.3 方法
1.3.1 细胞培养LSEC、Raw264.7、Hepa1-6、人肝癌细胞(HepG2.2.15)细胞用含10% 胎牛血清的DMEM 培养基培养,置于37℃,5%CO2恒温培养箱中,前3 种细胞每2~3 天更换培养基,待贴壁生长良好后使用0.25%胰酶消化传代。取对数生长期细胞进行后续实验。HepG2.2.15 细胞每2 天收集上清液,细胞经PBS洗涤后继续培养,收集的上清液进行后续实验。
1.3.2 本底蛋白质的提取与检测 取处于对数生长期的LSEC、Raw264.7、Hepa1-6 细胞,经消化离心后取相同细胞数(1×105个/管)至1.5 mL EP 管中提取蛋白,提取方法如下:每管细胞中加入100 µL 的RIPA裂解液,充分裂解后冰上放置20 min;4℃,12000 r/min,离心15 min;吸取上清至另一1.5 mL EP 管;加入5×SDS-PAGE 蛋白上样缓冲液,充分混匀后100℃加热5 min,室温冷却后置于-20℃冰箱储存待用。采用蛋白质免疫印迹法(Western blot),进行蛋白电泳、转膜、显影。分别加入一抗cGAS(1∶500)、STING(1∶1000)、p-IRF3(1∶500)、IRF3(1∶1000),内参选择β-Actin(1∶4000),二抗为HRP 标记的山羊抗兔、鼠(1∶10000),采用ECL 发光显影,经Image J 软件进行蛋白灰度值测定。
1.3.3 Poly(dA:dT)刺激的影响 取处于对数生长期的LSEC、Raw264.7、Hepa1-6 细 胞,经 消 化 离 心 后,LSEC、Raw264.7、Hepa1-6 细胞分别按4×105、6×105、6×105个/孔接种于6 孔板,每种细胞分为,药物刺激组、未刺激组(每组3 孔)。培养过夜后,药物刺激组使用Lipofectamine3000 转染试剂将PRR 激动剂poly(dA:dT)(0.4 µg/mL)转染至细胞中,未刺激组加入等量的DMEM 培养基,12 h 后收集细胞,采用EZB 快速RNA 提取试剂盒提取RNA,经诺唯赞逆转录试剂将RNA 逆转录成cDNA,根据EZB 2×SYBR Green qPCR Master Mix 在Bio-Rad PCR 仪中进行实时荧光定量PCR(Q-PCR)扩增,引物序列如下:cGAS:5'- CAGGAAGGAACCGGACAAGC-3'(F),5'-CCGACTCCCGTTTCTGCATT-3'(R);STING:5'-TCGCACGAACTTGGACTACTG-3'(F),5'-CCA ACTGAGGTATATGTCAGCAG-3'(R);IFN-β:5'- GGATCCTCCACGCTGCGTTCC-3'(F),5'-CCGCCCTGTAGGTGAGGTTGA-3'(R);β-actin:5'-TGTCCACCTTCCAGCAGATGT-3'(F),5'-AGCTCAGTAACAGTCCGCCTAGA-3'(R)。反应条件为:95℃预变性5 min;95℃变性10 s,60℃退火/延伸30 s,共40 个循环,以β-actin 为内参,依据目的基因相对表达量RQ=2-△△Ct算法分析基因mRNA相对表达量。
1.3.4 DMXAA 刺激的影响 细胞培养、接种及分组同上,过夜培养后药物刺激组将小鼠STING蛋白激活剂DMXAA(20 µg/mL)直接加入培养基中,未刺激组加入等量的DMSO,12 h 后收集细胞提取蛋白和RNA,采用Western blot 和Q-PCR 实验方法对相关基因进行检测,提取检测过程同上。
1.3.5 HBV 感染的影响 将收集过滤的HepG2.2.15 细胞上清液每34 mL 加入6 mL 40%聚乙二醇8000 进行浓缩,上下颠倒混匀后4℃过夜;4℃,10000 r/min离心1 h,弃去上清后,用含10%胎牛血清的PBS重悬沉淀,4℃摇床过夜;4℃,3000 r/min离心10 min,吸取上清至另一1.5 mL EP 管放至-80℃冰箱待用。细胞培养、接种及分组同上,过夜培养后HBV 感染组将浓缩后的HBV(MOI=10)加入到培养基中感染细胞,未感染组加入等量的PBS,12 h 后收集细胞提取蛋白和RNA,采用Western blot 和Q-PCR 实验方法对相关基因进行检测,提取检测过程同上。
1.4 统计学处理采用GraphPad Prism8 软件进行统计学分析,数据符合正态分布,两组间比较采用独立样本t检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 LSEC、Raw264.7、Hepa1-63 种细胞中cGASSTING 信号通路关键基因的本底表达情况比较3种细胞的本底表达量,LSEC 细胞cGAS、STING 的蛋白本底表达量最高,见图1。

图1 LSEC、Raw264.7、Hepa1-6细胞cGAS、STING的蛋白表达情况
2.2 Poly(dA:dT)对3种细胞的cGAS-STING信号通路的影响与未刺激组相比,poly(dA:dT)刺激显著提高LSEC、Hepa1-6 细胞cGAS、STING,IFN-β mRNA的水平(P<0.05);显著提高Raw264.7 细胞IFN-β mRNA 的水平(P<0.01);对Raw264.7细胞中的cGAS、STING的表达量无影响,见表1。
表1 poly(dA:dT)对3种细胞在cGAS-STING信号通路中mRNA表达量影响的比较(±s,n=3)

表1 poly(dA:dT)对3种细胞在cGAS-STING信号通路中mRNA表达量影响的比较(±s,n=3)
注:与未刺激组相比,*P<0.05,**P<0.01。
细胞LSEC Raw264.7 Hepa1-6组别未刺激组poly(dA:dT)刺激组未刺激组poly(dA:dT)刺激组未刺激组poly(dA:dT)刺激组cGAS 1.05±0.112.51±0.22**0.89±0.080.80±0.060.53±0.121.99±0.07**STING 0.93±0.091.35±0.18*0.90±0.030.83±0.140.70±0.180.91±0.01*IFN-β 0.99±0.0365.75±4.26**0.94±0.0746.76±4.77**0.88±0.1238.51±4.48**
2.3 DMXAA 对3 种细胞cGAS-STING 信号通路的影响与未刺激组相比,DMXAA 可显著提高LSEC、Raw264.7、Hepa1-6 细胞cGAS、STING mRNA 的表达(P<0.05);可显著提高Raw264.7、Hepa1-6 细胞IFNβ mRNA的表达(P<0.01);对LSEC细胞IFN-β mRNA的表达无影响,见表2。Western Blot 结果显示,与未刺激组相比,DMXAA 可显著提高LSEC、Hepa1-6 细胞cGAS 的蛋白表达水平(P<0.01);显著降低三种细胞STING 蛋白的表达水平(P<0.01),但显著提高STING 的磷酸化水平(P<0.01);显著提高p-IRF3 的蛋白表达水平(P<0.01),见图2、表3。
表2 DMXAA对3种细胞在cGAS-STING信号通路中mRNA表达量影响的比较(±s,n=3)

表2 DMXAA对3种细胞在cGAS-STING信号通路中mRNA表达量影响的比较(±s,n=3)
注:与未刺激组相比,*P<0.05,**P<0.01。
细胞LSEC Raw264.7 Hepa1-6组别未刺激组DMXAA刺激组未刺激组DMXAA刺激组未刺激组DMXAA刺激组cGAS 1.14±0.312.15±0.08**0.99±0.011.21±0.07*0.99±0.085.61±0.43**STING 0.96±0.202.04±0.33**0.92±0.071.23±0.05*0.94±0.091.97±0.05**IFN-β 1.09±0.181.04±0.020.92±0.0916.41±2.78**0.89±0.1416.97±2.67**

图2 DMXAA对3种细胞在cGAS-STING信号通路中蛋白水平上的影响
表3 DMXAA对3种细胞在cGAS-STING信号通路中蛋白表达量影响的比较(±s,n=3)

表3 DMXAA对3种细胞在cGAS-STING信号通路中蛋白表达量影响的比较(±s,n=3)
注:与未刺激组相比,*P<0.05,**P<0.01。
细胞LSEC Raw264.7 Hepa1-6组别未刺激组DMXAA刺激组未刺激组DMXAA刺激组未刺激组DMXAA刺激组cGAS 0.26±0.010.56±0.01**0.81±0.010.78±0.030.61±0.020.73±0.02**STING 2.34±0.040.87±0.02**1.30±0.021.11±0.05**1.13±0.040.45±0.01**p-STING/STING 0.00±0.001.28±0.12**0.00±0.000.87±0.07**0.00±0.000.94±0.01**IRF31.26±0.022.17±0.07**0.61±0.020.60±0.040.14±0.010.34±0.01**p-IRF3/IRF30.00±0.000.14±0.02**0.00±0.000.33±0.01**0.00±0.001.33±0.01**
2.4 HBV感染对3种细胞cGAS-STING 信号通路的影响与未感染组相比,Q-PCR 结果显示,HBV 感染对Raw264.7、Hepa1-6 细胞cGAS、STING mRNA 的表达无明显差异;对LSEC 细胞的cGAS、IFN-β mRNA明显激活作用(P<0.05);明显抑制Raw264.7、Hepa1-6 细胞的IFN-β mRNA 表达(P<0.01),见表4。与未感染组相比,Western Blot结果显示,HBV处理可显著促进3 种细胞IRF3 蛋白及磷酸化水平(P<0.01);对LSEC 细胞的STING 蛋白水平显著提高(P<0.01),显著降低Raw264.7、Hepa1-6细胞的STING蛋白水平(P<0.05);对LSEC 细胞的cGAS 蛋白无影响,明显抑制Raw264.7 细胞cGAS 蛋白的表达(P<0.05),明显促进Hepa1-6 细 胞cGAS 蛋 白 的 表 达(P<0.01),见 图3、表5。
表4 HBV感染对3种细胞在cGAS-STING信号通路中mRNA表达量影响的比较(±s,n=3)

表4 HBV感染对3种细胞在cGAS-STING信号通路中mRNA表达量影响的比较(±s,n=3)
注:与未感染组相比,*P<0.05,**P<0.01。
细胞LSEC Raw264.7 Hepa1-6组别未感染组HBV感染组未感染组HBV感染组未感染组HBV感染组cGAS 0.92±0.061.23±0.08*1.00±0.070.97±0.181.09±0.131.06±0.07 STING 1.00±0.061.03±0.141.00±0.060.89±0.101.09±0.091.02±0.09 IFN-β 0.95±0.091.33±0.04**1.03±0.090.61±0.09**0.99±0.010.71±0.01**
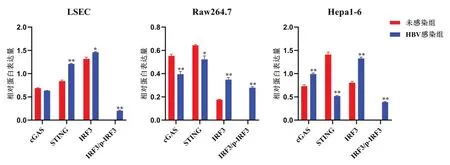
图3 HBV感染对3种细胞在cGAS-STING信号通路中蛋白水平上的影响
表5 HBV感染对3种细胞在cGAS-STING信号通路中蛋白表达量影响的比较(±s,n=3)

表5 HBV感染对3种细胞在cGAS-STING信号通路中蛋白表达量影响的比较(±s,n=3)
注:与未感染组相比,*P<0.05,**P<0.01。
细胞LSEC Raw264.7 Hepa1-6组别未感染组HBV感染组未感染组HBV感染组未感染组HBV感染组cGAS 0.68±0.010.62±0.010.55±0.010.39±0.02**0.73±0.030.99±0.02**STING 0.83±0.021.21±0.01**0.64±0.010.52±0.03*1.40±0.050.51±0.01**IRF31.31±0.031.45±0.02*0.17±0.010.34±0.02**0.80±0.031.32±0.03**p-IRF3/IRF30.00±0.000.20±0.01**0.01±0.010.27±0.01**0.01±0.010.38±0.01**
3 讨论
cGAS-STING 信号通路是病毒病原体检测和免疫宿主防御机制之间的重要桥梁[7]。Poly(dA:dT)是一种人工合成的双链DNA模拟物,可激活cGAS、AIM2、RIGI 等多种模式识别受体[8]。DMXAA 是一种小鼠STING 蛋白激活剂[9],它可直接与STING 蛋白结合从而激活cGAS-STING 下游信号,导致干扰素的产生[10]。本研究证明两种激活剂均可激活3 种细胞cGAS-STING信号通路,但激活程度存在差异。
HBV 是属于嗜肝DNA 病毒科的一种逆转录病毒,主要感染人类的肝脏[11-12]。Cheng 等[13]发现HBV可激活巨噬细胞cGAS-STING 信号通路,但有研究认为HBV 对巨噬细胞cGAS-STING 通路有一定抑制作用[14]。本研究发现,HBV 对代表肝实质细胞的Hepa1-6细胞无激活作用,对Raw264.7细胞中IFN-β 的表达有显著的抑制作用,而对LSEC 细胞中cGASSTING 信号通路相关关键基因的表达均有促进作用。由于cGAS-STING 信号通路的激活会产生干扰素[15],从而抑制HBV 的复制,LSEC 细胞中这种促进作用的发现为HBV 的治疗提供了新的靶点。鉴于cGASSTING 信号通路异常可导致肝癌、慢性乙肝感染等多种肝脏疾病的发生[16],本研究的发现对于阐明这些疾病的发病机制也具有重要意义。
由于人源LSEC 细胞株不易获得且公认的人源巨噬细胞系相当缺乏,因而本研究选用了3种鼠源细胞作为实验细胞,这不可避免地限制了本研究的临床意义。后续的研究可使用人的原代细胞阐明人类肝实质细胞和非实质细胞中cGAS-STING 的表达及激活情况。此外,本研究仅探讨了3种细胞的本底及激活剂激活后cGAS-STING 信号通路的响应情况,后续研究可使用siRNA 技术等手段阻断关键基因以进一步探讨各个基因在cGAS-STING 通路激活中的角色。

