药物控释体系用于局部麻醉的研究进展
龙 凯,曹 佩,季天骄
1国家纳米科学中心 中国科学院纳米生物效应与安全性重点实验室,北京 1001902湖北大学高分子材料湖北省重点实验室,武汉 430062
局部麻醉(下文简称“局麻”)旨在通过对手术区域神经进行阻滞,达到减少手术期间疼痛感觉的目的。现阶段,临床使用较多的酰胺类局麻药(如布比卡因、利多卡因)工作浓度高且时效有限。对于时间较长的手术,术中需补充麻醉药物,而高剂量的局麻药不仅会造成局部组织毒性及神经毒性,还有引发系统毒性的风险[1- 3]。近年来,一些生物来源的毒素,如河豚毒素(tetrodotoxin,TTX)、石房蛤毒素及其衍生物受到广泛关注[4- 6],这些神经毒素与钠离子通道有极高的亲合力,可以起到神经阻滞的作用,具有成为新型局麻药的潜力[7]。此类新型局麻药效力极高,例如,在大鼠坐骨神经局麻动物模型中,3 μg剂量的TTX便可起效,且几乎不产生局部组织毒性和神经毒性[8];然而,其剂量窗口较窄,易产生系统毒性,例如剂量从3 μg提高至4 μg时,未给药侧的大鼠坐骨神经也会被阻滞,且可造成20%的大鼠死亡[9]。更重要的是,这类效力极高的新型局麻药同样会受到工作时效的限制,其麻醉时长与酰胺类局麻药相比,并无显著提高。
根据临床对长效、安全局麻制剂的需求,研究人员开始开发局麻药缓释制剂,已有多款制剂上市,如布比卡因脂质体(EXPARELTM)、多种利多卡因贴剂等[10- 11]。虽然这些局麻药制剂相较原药物剂型具有长效、使用便捷等优点,但优化局麻药缓/控释制剂仍然面临巨大挑战:对于传统酰胺类局麻药,因其工作浓度高,非常高的药物载带剂量才可能使缓释的药物维持在有效工作浓度;而对于神经毒素类局麻药,药物分子本身亲水性极强,大部分药物载体很难实现对其高效装载,且部分药物载体存在初期突释的现象,若释放剂量过高,还会造成系统毒性。因此,要实现局麻药的有效控释,载体设计至关重要。
药物载体技术(控释体系)的发展日新月异,除传统的口服、贴剂外,微米、纳米尺度的药物制剂已进入临床,并应用于恶性肿瘤治疗、病毒感染预防等领域[12- 13]。对于长效局麻药制剂,载体设计的基本要求是生物相容性高且具有较长的局部滞留时间[14]。本文将介绍常用的局麻药控释递送载体,着重介绍代表性控释药物载体设计思路及载体可实现的功能,并结合科研进展对未来发展作出展望。
1 常用的局麻药递送载体
1.1 脂质体
脂质体是最为常见的药物载体,可用于小分子化疗药物、基因药物的递送及缓释。除缓释作用外,非阳离子脂质体生物相容性好、磷脂类型替换灵活、表面便于修饰[15- 16]。因此,无论在基础还是临床研究中,脂质体剂型均应用广泛。脂质体的制备工艺日益成熟,多种脂质体药物制剂,如脂质体阿霉素、脂质体伊立替康,已获批进入临床[17]。
利用不同的制备工艺,脂质体药物制剂的尺寸可以实现从纳米到微米级别的控制。用于局麻递送的脂质体制剂通常需要具有微米尺寸,利于其在注射部位的长时间滞留。例如,已上市的布比卡因脂质体EXPARELTM的尺寸接近30 μm[18]。此外,脂质体内腔可以装载亲水性药物,磷脂层可通过疏水相互作用载带亲脂性药物,便于多药联合使用以延长局麻时间。例如,相比于仅含石房蛤毒素的固态脂质体(48 h麻醉时效),同时装载石房蛤毒素与地塞米松(0.8 g/L)的固态脂质体可实现长达7.5 d的麻醉时效[19]。
1.2 聚合物载体
多种天然、非天然聚合物具有较好的生物相容性及生物可降解性[20],可用来制备药物载体或药物体系的辅料。例如,聚乙二醇已广泛用于增加纳米/微米药物载体的分散性、延长载体在生物体内的循环时间(半衰期)[21- 22];多款以聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]为载体的化疗药物已经进入临床研究阶段[23- 24]。聚合物药物载体也可被制备成多种形式,如实心颗粒、空心的核壳结构、空间网状的水凝胶、静电纺丝纤维等。例如,Zhang等[25]设计的PLGA水凝胶可有效联合载带布比卡因及右旋米托咪定,并实现药物的可控释放以及长效滞留;He等[26]利用静电纺丝技术制备的PLGA-布比卡因薄膜可缓释布比卡因,动物实验结果显示,其麻醉效果可持续一周以上。除上述物理装载外,还可将药物与聚合物化学键合制备成前药(prodrug)[4, 27- 29],实现对药物的缓释。例如,Zhao等[4]通过酯键将TTX与聚合物[poly(triol dicarboxylic acid)-co-poly(ethylene glycol),TDP]共价连接制备成前药,注射至体内后酯键逐渐水解,起到缓慢释放TTX的效果,从而实现了长效镇痛。同时,根据药物的分子量及亲疏水性,调整聚合物的分子量或(嵌段聚合物)亲疏水比例,可以调控制剂的载药量及药物释放动力学,便于优化药物控释体系。
1.3 无机材料载体
无机材料载体由于其制备过程中尺寸、形貌精细可控,越来越受到药物载体研究领域的青睐。例如,介孔硅颗粒的尺寸在纳米至微米级可调,除规整的球型外,还可被制备成空心结构、纳米棒、纳米线,其孔隙大小也可调控(便于载药及优化药物释放动力学)[30- 31]。一些贵金属体系,例如金纳米颗粒,由于其具有表面等离子共振效应,可对特定波长的光响应产生光热效应,对病灶进行治疗。此外,贵金属载体还可作为载药系统释放药物的“启动装置”[32- 33]。而对于局麻药的控释,通常需排除材料本身对神经细胞/组织的潜在毒性,因此,利用金属离子治疗病症(如杀伤肿瘤)的载体设计思路一般不引入局麻药递送体系的设计[34- 35]。
1.4 其他类型载体
除上述几类材料外,多肽自组装体系也在局麻药(尤其是新型局麻药)的递送方面崭露头角。由于局麻药与离子通道蛋白存在特异性结合,因此,结合位点的多肽序列有可能成为局麻药的载体元件,这种仿生思路也为亲水性强的新型局麻药的特异性装载及缓释提供了新思路[36]。
为实现多药联用、药物可控释放等功能,设计药物载体时可将多种“功能元件”(不同材料)进行杂化。例如,利用脂质体包裹介孔硅材料,载体载药量较脂质体会显著提高,并实现药物释放动力学的优化[37];将金纳米棒与脂质体复合,当金纳米棒响应特定波长激光辐射后,可产生光热效应,载体局部温度达到磷脂相转变温度后,脂质体的膜结构被扰动,便可将药物释放,这类杂化载体可实现对药物起效的时空操控[9]。
2 局麻药控释体系研究进展
药物递送体系用于局麻药控释的主要目的可归纳为利用药物递送系统的缓释、长滞留时间、环境响应、高效渗透等功能,实现安全、长效或时空可控的麻醉效果(图1)[38]。
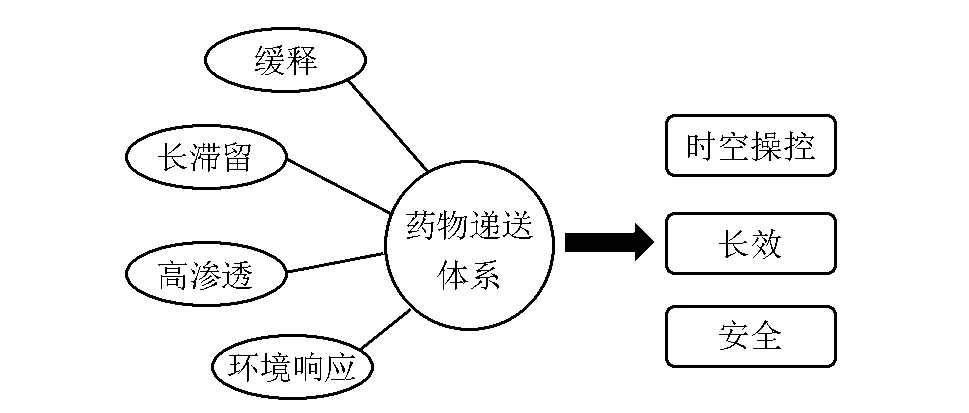
图1 局麻药递送系统功能示意图
2.1 缓释功能
缓释是对药物载体的最基本功能要求之一,但对于局麻药,释放的药物在满足药物工作浓度的同时还需避免初期药物突释造成的系统毒性。尤其对于新型局麻药,由于其亲水性强,分子扩散速度快,有效装载极具难度,同时,其起效剂量极低,剂量窗口极窄,若载体缓释效力不强,很容易造成药物突释引发的系统毒性。
提高载体与药物(质量或摩尔量)的比例可在一定程度上降低药物释放速度,因此,为实现新型局麻药(如TTX)的缓释,通常需要用几十毫克的载体载带微克级别的药物,而载体量过大,同样会对机体(清除载体材料)造成负担。为解决这一问题,本课题组跳出物理包裹的载药方式,利用仿生思路,从TTX结合钠离子通道的区域筛选关键多肽序列(图2A),并进行疏水修饰,使其可以自组装形成纳米纤维结构(图2B、2C)。不同疏水基团修饰的纳米结构对TTX的缓释能力差异较大,其中芳香族氨基酸作为疏水基团的多肽组别对TTX的缓释能力最强(图2D),其原因是由于疏水体积较大,可使亲水端的TTX结合序列距离相对合适(避免结合序列自身相互作用),利于TTX与载体的结合。由于可与TTX产生特异性相互作用,载体材料用量相比于脂质体与聚合物类体系显著减少,载药精确度更加可控。该体系在大鼠坐骨神经局麻动物模型上的工作剂量范围能够实现1~7 μg内可调,是自由形式TTX使用剂量范围(3~4 μg)的3倍,麻醉时长可达16 h,是自由形式TTX最长麻醉时效的5倍以上(图2E)[36]。此类仿生型的纳米结构可精准载药,实现局麻药的可控缓释,并能够有效延长镇痛时间,且其缓释体系也可扩展应用于其他受体介导的药物递送。
2.2 长效局部组织滞留
欲实现局部组织的长效麻醉,药物控释体系需要在注射(用药)部位具有相对较长的滞留时间,在此基础上,控释体系对药物进行缓释,起到长效麻醉的功效[39]。与自由形式的局麻药(小分子)相比,较大尺寸的药物递送体系可在一定程度上延长药物滞留时间;与水相比,纳米组装体、水凝胶等体系具有更高的粘度,从而延长体系的局部滞留时间。
通常用于延长局麻持续时间的经神经注射的药物控释体系尺寸为微米级,因其具有更高的载药量,释药持续时间长,局部滞留时间也较长。与之相比,纳米尺寸的载体通常被清除,但合理设计的纳米尺度的药物控释体系,同样可实现较长时间的局部组织滞留。例如,本课题组设计的仿生型载体具有纳米纤维结构,同时,此结构可增加溶液粘度,从而达到延长局部滞留时间的效果。如图3所示,有纳米结构的组别均具有较长的局部滞留时间,半衰期均在24 h左右,而无纳米结构的组别半衰期不足1 h[36]。

图 2 基于仿生思路设计的新型局麻药缓释体系
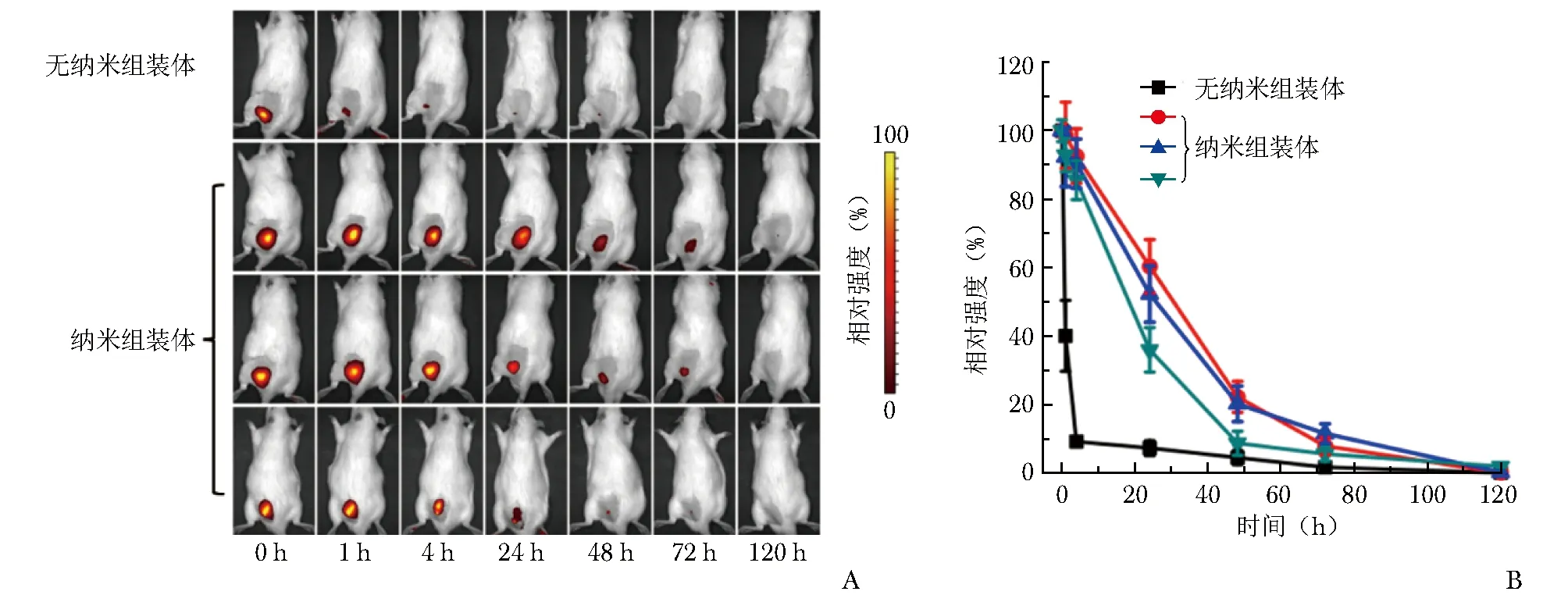
图 3 纳米结构可有效延长局部滞留时间
此外,在静脉局麻(intravenous regional anesthe-sia,IVRA)模型中,微米尺寸的控释体系会阻塞毛细血管,因此,微米尺寸载体并不适用于IVRA。Weldon等[40]利用大鼠的尾巴模拟人的肢端,开发了一种尺寸为15 nm的布比卡因胶束制剂(M-Bup),其与尺寸为100 nm的脂质体剂型(L-Bup,与M-Bup表面性质相同)相比,由于粒子比表面大,更易吸附到细胞膜、血管壁等生物界面。因此,当荧光标记制剂(M-Bup-Rhd、L-Bup-Rhd)被止血带限制在尾部静脉15 min后,拆除止血带,M-Bup-Rhd组中的荧光强度在24 h内衰减速率显著慢于L-Bup-Rhd组,半衰期显著长于L-Bup-Rhd组。基于此长效滞留及缓释作用,含有0.1% 布比卡因剂量的M-Bup制剂提供了约4.5 h的局麻效果,比更大剂量(0.5%)自由形式的布比卡因延长2倍,而与M-Bup相同药物剂量的L-Bup也不能产生麻醉效力。由于M-Bup药物剂量小,具有长效滞留效应,其降低了药物入血速率,因此具有较高的安全性。
从以上两个例子可以看出,纳米尺寸的制剂在特定场合下,通过合理设计,同样可实现延长局部滞留时间的效果。同时提示,对于局麻药控释体系的设计,需针对特定应用(病理)场景,并无固定的法则。
2.3 高组织渗透性
局麻是将药物注射至特定区域神经周围,药物易扩散至外周神经组织中起效,但对于坐骨神经等较粗的神经束,因有结缔组织包被而对药物输运可产生屏障作用。通常小尺寸的颗粒更容易穿越屏障,从而具有更好的药效。例如,本研究团队制备了30 nm的介孔二氧化硅球壳,该纳米粒子可穿透坐骨神经周边的结缔组织,利用此球壳结构载带新型局麻药物TTX,可实现长效麻醉,同时扩大剂量窗口,提高安全性[41],而70 nm的介孔二氧化硅颗粒则无法实现此效果。
2.4 物理信号对释药的时空操控
除上述功能(缓释、高渗透等)外,将光、超声等外界信号转换成药物释放信号的药物控释体系也开始涌现[42- 43]。此类药物控释体系的出现有望实现在首次药物注射后,患者在感受到疼痛时,由患者本人或医生通过施加物理场刺激信号,实现药物释放,达到麻醉效果。此法可避免重复注射,也为远程医疗提供了契机。例如,Rwei等[8]将光敏剂及金纳米棒同时掺杂至载有TTX的脂质体中(Lipo-PdPC-GNR),可实现在较低功率光源照射下的药物(或载带的染料)响应释放。其将装载了TTX的Lipo-PdPC-GNR注射至大鼠坐骨神经,首次光照后,释放的TTX产生了(1.5±0.3)h的有效麻醉,第二次光照触发后,仍能产生1 h有效麻醉,相比于单一光响应成分掺杂的脂质体更有效,提高了光响应释药可操作性。
3 小结与展望
局麻药载体技术的发展,促进了对控释体系的深入研究,除在动物模型中获得验证外,药物递送体系在浅表麻醉领域展现出了极大的应用前景。目前研究最多的是微针技术,其可直接将局麻药递送至作用部位进行缓释而不引起组织损伤或炎症的发生。这一技术可临床用于缓解神经病理性疼痛以及医疗美容手术等[44]。
目前,药物控释体系在局麻中的应用仍处于科学研究阶段,用于临床的制剂相对较少,欲实现更多临床可用制剂的输出,仍需完善以下几个方面:(1)药物控释体系的高通量筛选。例如,不同分子量聚合物对药物的装载效率及释放速率有所不同,如何做到高通量筛选,使药物控释体系可以更好地匹配药物的工作浓度,仍需基础科研工作者在药物研发阶段做好质控。(2)药物控释体系的量产。对于一些前药策略,化学反应复杂,难以实现产品的量产,但在药物制剂方面,微流控、微针技术、静电纺丝、3D打印技术日益成熟,应进一步关注并早日实现药物制剂的量产。(3)载体材料长期安全性的评估。由于传统局麻药工作浓度高、新型局麻药装载效率低,药物载体材料的使用量相对较大,且其材料本身的代谢周期长于药物本身,因此,即便对于生物相容性好的载体材料,同样需要关注其长期体内行为及生物效应。
作者贡献:龙凯负责查阅文献和论文撰写;曹佩负责论文撰写和修订;季天骄负责论文主题确定、论文修订。
利益冲突:所有作者均声明不存在利益冲突

