一种寨卡病毒富集检测方法的性能评价
李阿茜,孔令君,刘 洋,伊 洁,李 川,梁米芳,窦亚玲
1中国疾病预防控制中心病毒病预防控制所病毒性出血热室,北京 1022062中国医学科学院北京协和医院检验科,北京 100730
寨卡病毒(Zika virus)是一种蚊媒病原体,于1947年首次从恒河猴血清中发现并分离,1952年Dick等[1]将其命名为寨卡病毒。2007年,密克罗尼西亚联邦首次报道了寨卡病毒导致的大流行事件,引起约3.2万人感染,影响了当地3/4的人口[2]。2016年,有报道称新生儿大脑发育障碍可能与母体妊娠期间感染寨卡病毒相关,继而寨卡病毒引起了国际广泛关注[3- 6]。
寨卡病毒为黄病毒科黄病毒属单股正链RNA病毒,通过系统发育分析确定了其具有两个谱系,即非洲型和亚洲型[7]。目前临床诊断寨卡病毒感染的常用方法包括针对抗体IgM的血清学检测法和针对病毒RNA的核酸检测法[8]。由于寨卡病毒抗体与其他黄病毒如黄热病毒、日本脑炎病毒、西尼罗河病毒、蜱传脑炎病毒和登革热病毒具有交叉反应,限制了血清学检测法的使用[9]。核酸检测法通过实时荧光定量反转录PCR(real-time reverse-transcriptase-polymerase chain reaction,rRT-PCR)技术可于感染早期(感染后3~5 d)在感染者血液、唾液中检测到寨卡病毒RNA,感染后期(感染后15~20 d)可在其尿液中检测到病毒RNA。此种血清学检测法的检测结果受病毒核酸丰度的影响较大。通过离心可快速有效浓缩病毒、提高其丰度,但目前尚无采用离心法富集寨卡病毒的研究报道。
为提高检测灵敏度,目前常用的传统rRT-PCR技术一般需对寨卡病毒的RNA进行提取纯化,对于体积较大尤其低病毒载量的样本,核酸提取纯化有助于提高检测灵敏度,但核酸提取纯化过程降低了检测速率,从核酸提取至结果报告通常约需4 h,时效性相对较差。本研究评价了一种无需病毒RNA提取纯化、可快速检测寨卡病毒的方法,该方法仅需简单离心富集处理即可,整个检测过程可在1.5 h内完成,检测效率大为提高。本研究从定量检测下限、交叉反应、抗干扰性、精密度以及模拟临床样本方面对该检测方法进行性能评价。
1 材料与方法
1.1 材料
1.1.1 毒株与样本
非洲型寨卡病毒MR766毒株由美国疾病控制与预防中心Amy Lambert博士惠赠,亚洲型寨卡病毒ZKC2/2016毒株分离自中国1例输入型病例。交叉反应评价使用的Ⅰ型登革热病毒、Ⅱ型登革热病毒、Ⅲ型登革热病毒、Ⅳ型登革热病毒、黄热病毒、日本脑炎病毒、基孔肯雅病毒、发热伴血小板减少综合征布尼亚病毒、汉坦病毒、麻疹病毒、风疹病毒、副流感病毒、西尼罗病毒、埃科病毒、黄热病疫苗株、诺如病毒、细小病毒共17种虫媒病毒核酸提取物来自中国疾病预防控制中心病毒病预防控制所病毒性出血热室。寨卡病毒阴性血清、尿液和唾液样本来自北京协和医院检验科受试者。
1.1.2 主要试剂与仪器
寨卡病毒核酸检测试剂盒(PCR-荧光探针法)、Mini8 Plus荧光定量PCR仪[卡尤迪生物科技(北京)有限公司];Biorad CFX96荧光定量PCR仪(美国Bio-Rad公司);Micro 17R台式高速冷冻离心机(美国Thermo公司)。
本研究已通过北京协和医院伦理审查委员会审批(审批号:HS2016042),并豁免受试者知情同意。本研究对受试者个人数据均采用去隐私化处理。
1.2 方法
1.2.1 寨卡病毒核酸检测方法
样本富集方法:取100 μL(血清及唾液标本)或200 μL(尿液样本)待测样本,加入112 μL(血清及唾液标本)或224 μL(尿液样本)样本处理液Ⅰ及5 μL(血清及唾液标本)或10 μL(尿液样本)样本处理液Ⅱ,混匀后进行离心富集;离心半径8.6 cm,12 000 r/min离心5 min后弃上清液;加入20 μL复溶液重悬沉淀,取10 μL重悬液加入50 μL PCR反应液进行上机检测。
1.2.2 方法学评价
1.2.2.1 定量检测下限
将滴度为108半数组织培养感染剂量(50% tissue culture infective dose,TCID50)/mL的寨卡病毒细胞培养物(非洲型:MR766毒株;亚洲型:ZKC2/2016毒株)进行10倍梯度稀释,分别得到8个不同滴度水平的样本(106TCID50/mL~10-1TCID50/mL),以评估该方法的检测下限。使用3个批次的检测试剂进行检测,每个浓度的样本重复检测3次,具体步骤均按照试剂盒说明书进行操作。以9次重复检测结果均为阳性的最低病毒滴度作为定量检测下限。
1.2.2.2 交叉反应评价
使用3个批次试剂对17种潜在交叉病原体(虫媒病毒,滴度为106TCID50/mL)进行检测,每个批次试剂盒重复检测3次,评价有无交叉反应。
1.2.2.3 抗干扰性评价
为了评估样本中存在的潜在干扰物对寨卡病毒检测的影响,将干扰物质分别与寨卡病毒(亚洲型:ZKC2/2016毒株)培养物混合,制备含浓度胆红素(15 mg/L)、血红蛋白(100 mg/L)、甘油三酯(2000 mg/L)、IgG(37.5 g/L)、EDTA-Na2(2.5 g/L)的寨卡病毒样本。其中混合物标本中寨卡病毒滴度为该方法的定量检测下限(干扰物质的浓度均高于健康人群血浆浓度范围)。采用3个批次的试剂盒对其进行检测。
1.2.2.4 精密度评价
将滴度为108TCID50/mL的寨卡病毒细胞培养物(非洲型:MR766毒株;亚洲型:ZKC2/2016毒株)稀释为高浓度(106TCID50/mL)、中浓度(104TCID50/mL)和低浓度(102TCID50/mL)样本。采用3个批次的试剂对每种浓度的样本进行20次重复性检测,并计算Ct值的变异系数(coefficient of variation,CV)。要求批次内和批次间Ct值的CV均<10%。
1.3 模拟临床样本评价
由于国内寨卡病毒阳性临床样本较少、不易获取,本研究进一步使用模拟临床样本对病毒富集法的性能进行评价。收集北京协和医院临床剩余样本(血液、尿液、唾液)。随机选取约1/5样本,加入寨卡病毒培养物(非洲型:MR766毒株;亚洲型:ZKC2/2016毒株,病毒滴度水平涵盖定量检测下限和中、高浓度水平)以模拟不同病毒浓度的阳性样本。检测人员在不知样本阴阳性情况下对所有样本进行检测。
1.4 统计学处理
采用SPSS 23.0软件进行数据处理和统计学分析。计数资料以率(频数/总数)表示。模拟临床样本检测结果评价中,以病毒富集法的准确度表示。准确度=检测结果正确样本数/样本总数×100%。
2 结果
2.1 定量检测下限
病毒富集法对MR766、ZKC2/2016毒株的检测下限均为101TCID50/mL(表1)。ZKC2/2016毒株寨卡病毒扩增曲线和标准曲线见图1。

图1 不同滴度ZKC2/2016毒株寨卡病毒样本的扩增曲线(A)和标准曲线(B)TCID50:同表1
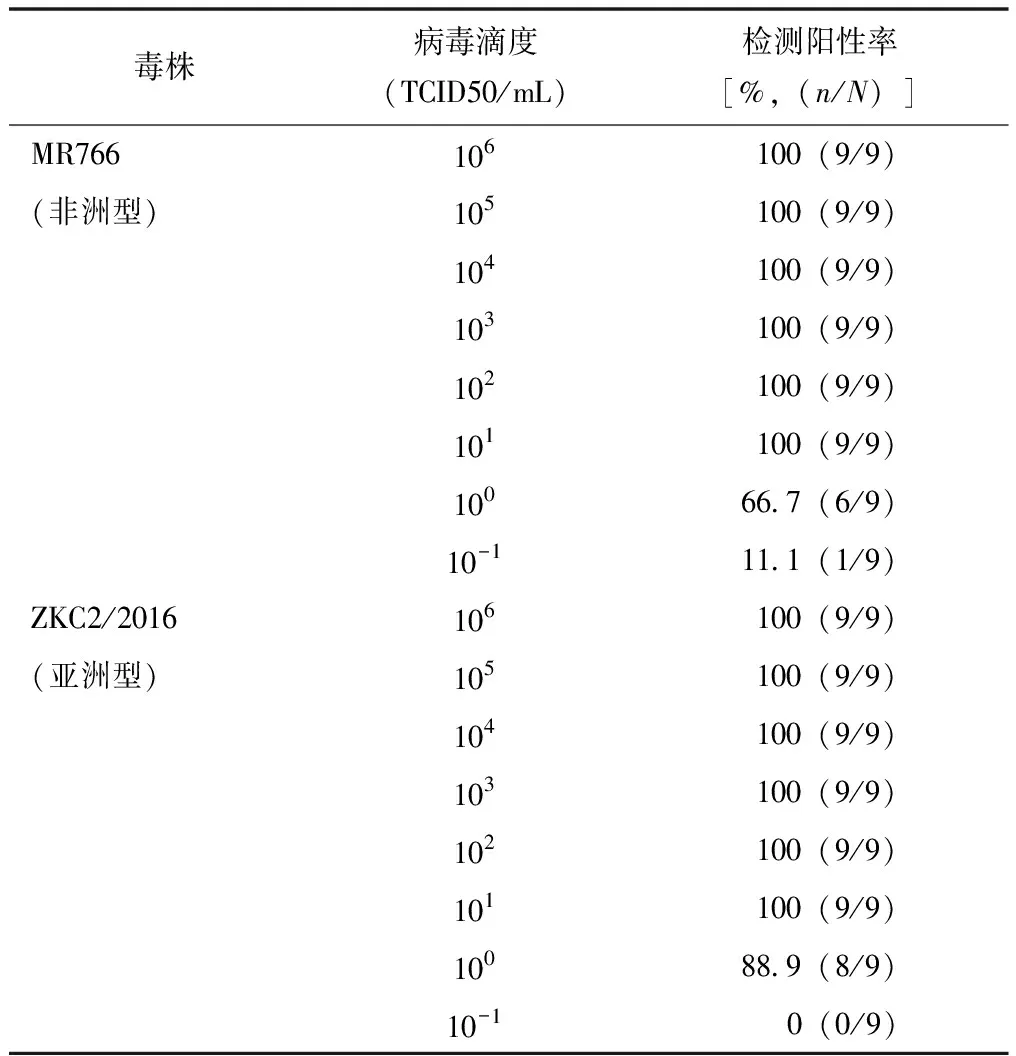
表1 病毒富集法对不同滴度寨卡病毒样本的检测结果
2.2 交叉反应
17种病原体检测结果均为阴性,表明该检测方法与17种病原体均无交叉反应,特异性良好。
2.3 抗干扰性评价
在寨卡病毒定量检测下限滴度下,样本中寨卡病毒的检查结果均为阳性,表明上述干扰物质在所测浓度下对寨卡病毒检测结果无影响(表2)。

表2 病毒富集法检测寨卡病毒的抗干扰性评价结果
2.4 精密度评价
病毒富集法对不同浓度病毒样本的检测结果均为阳性,批次内和批次间Ct值的CV均低于10%,表明此方法的精密度较好(表3)。

表3 病毒富集法精密度评价结果
2.5 模拟临床样本评价
共收集模拟临床样本344份,其中男性样本176份,女性样本168份;血清样本140份,尿液样本130份,唾液样本74份。随机选取73份样本(血清、尿液、唾液样本分别30、32、11份)制备不同浓度的寨卡病毒模拟临床样本(病毒浓度涵盖检测下限及中、高浓度水平)。结果显示病毒富集法对344份样本的检测结果均与实际相符,准确度为100%,无假阳性和假阴性结果(表4)。

表4 病毒富集法对模拟临床样本寨卡病毒的检测结果(n)
3 讨论
rRT-PCR技术可为寨卡病毒的检测提供一个具有检测迅速、假阳性低、灵敏度高、特异度高、可定量检测的诊断平台,具有血清学检测和常规rRT-PCR等传统方法不具有的优势。本研究从定量检测下限、交叉反应、抗干扰性、精密度方面对基于rRT-PCR技术进行寨卡病毒快速检测方法的性能进行评价,结果显示该方法对MR766、ZKC2/2016毒株的定量检测下限均为101TCID50/mL;且具有与常见病原体无交叉反应、干扰物质对检测结果无影响、精密度好(批次内和批次间CV均<10%)的特征。采用模拟临床样本对其性能进一步评定,发现该检测方法对344份模拟临床样本的检测结果的准确度为100%。
传统rRT-PCR方法检测病毒感染需经历核酸提取纯化过程,包括加热、裂解、洗涤、洗脱等步骤,涉及多次的液体转移,耗时较长(约4 h)。本研究采用的一步法rRT-PCR技术诊断寨卡病毒感染,无需核酸提取纯化,仅需一次离心和液体重悬,整个检测过程可在1.5 h内完成,时效性显著提高。此外,该检测方法的样本制备步骤均可在室温下进行,避免了在核酸提取过程中病毒高温裂解产生生物气溶胶的潜在污染。新方法在实际应用前,需对其进行多方面性能评价。本研究首先对其定量检测下限进行了分析,结果显示病毒富集法对MR766、ZKC2/2016毒株的检测下限均为101TCID50/mL。据文献报道,人类感染寨卡病毒后的病毒载量范围为103~106拷贝/mL[9- 11]。寨卡病毒的TCID50/mL与其拷贝数尚无明确对应关系。根据初始加样量的不同,本研究最终反应体系中的模板数约为50~105拷贝,理论上可满足临床检测需求,但仍需真实的临床样本进一步验证。
寨卡病毒与登革热病毒、西尼罗河病毒和黄热病毒等黄病毒科RNA病毒结构类似,可能存在交叉反应。本研究采用17种常见的虫媒病毒作为潜在的交叉反应物质评估病毒富集法检测结果的特异性,结果未观察到交叉反应,提示该方法具有极高的特异性,进一步证实了rRT-PCR技术检测法比血清学检测的特异性更高的结论。
有报道称临床样本中的一些化合物具有PCR抑制性,可能导致错误的PCR检测结果。如免疫球蛋白G被鉴定为人类血浆中的主要PCR抑制剂[12],血红蛋白是红细胞中主要的PCR抑制剂[13]。本研究以高于实际临床样本水平的胆红素、血红蛋白、甘油三酯、IgG、EDTA-Na2为潜在干扰物质,评定了该方法检测寨卡病毒(定量检测下限浓度)的抗干扰性,结果发现所有样本均检出寨卡病毒阳性,表明上述物质在所测浓度下对寨卡病毒感染检测结果无影响。
为研究不同的试剂批次对检测结果的影响,本研究对该检测方法的精密度进行了评价,分别使用3个批次的试剂对于高、中、低浓度样本进行各20次重复检测,结果显示该方法具有良好的精密度和重复性。
样本类型亦可影响病毒检测结果。寨卡病毒在尿液样本中呈阳性的时间比血清样本长,发病10 d后在尿液中仍可检出寨卡病毒阳性[14]。建议急性期同时采集血液和唾液样本联合检测,而疾病晚期多采用尿液样本,以提高寨卡病毒检测的灵敏度[15]。由于真实感染的临床样本不易获得,本研究对唾液、血清、尿液与寨卡病毒培养液构成的344份模拟临床样本进行了检测(寨卡病毒阳性样本73份),发现检测结果与实际结果的符合率为100%,未出现假阴性和假阳性结果,提示该方法的检测灵敏度和特异度均极高。
本研究局限性:由于缺乏真实临床感染者样本,本研究寨卡病毒测定方法的临床应用效果尚需真实临床样本进一步验证。
综上,本研究对一种免核酸提取纯化的寨卡病毒核酸检测方法的性能进行了评价,该方法仅需对样本进行简单富集,操作简便,检测快速,结果可靠,性能满足临床需求,可作为一种备用的寨卡病毒诊断工具。
作者贡献:李阿茜、孔令君负责实验设计,数据分析,论文撰写和修改;刘洋、李川参与实验设计,负责实验执行和实验结果整理; 伊洁负责模拟临床样品评价部分的实验执行和数据分析;梁米芳、窦亚玲参与研究设计,并对论文进行审阅。
利益冲突:所有作者均声明不存在利益冲突
志谢:感谢美国疾病控制与预防中心的Amy Lambert博士提供非洲型寨卡病毒MR766毒株。

