肠易激综合征不同亚型患者免疫及肠道菌群特征观察
李晓芳,刘艳凤
(青岛市市北区人民医院检验科,山东 青岛 266033)
肠易激综合征(irritable bowel syndrome,IBS)是临床常见的慢性功能性肠道疾病,粪便性状异常、腹痛、腹部不适等症状是其常见表现,IBS易反复发作,影响患者的工作和生活[1]。近年研究发现,患者的肠道微生态和肠黏膜免疫激活可能与IBS的发病存在一定联系,IBS患者的肠道菌群具有多样性,主要表现为致病菌数量异常增加,同时伴有益生菌数量异常减少[2-3]。便秘型、腹泻型、混合型是IBS的常见亚型,本研究以80例IBS患者为研究对象,观察不同亚型IBS患者的免疫功能和肠道菌群特征,期望为临床针对性治疗不同亚型IBS提供参考,现报道如下。
1 资料与方法
1.1 一般资料 选取2019年1月至2021年8月青岛市市北区人民医院收治的80例IBS患者,根据不同亚型分为便秘组(30例)、腹泻组(28例)和混合组(22例),另选取同期院内40例成年健康体检者作为对照组进行回顾性分析。便秘组患者中男性13例,女性17例;年龄21~67岁,平均年龄(46.13±9.84)岁;病程2~8年,平均病程(4.18±1.36)年。腹泻组患者中男性16例,女性12例;年龄20~71岁,平均年龄(47.61±10.08)岁;病程1~8年,平均病程(3.95±1.27)年。混合型患者中男性9例,女性13例;年龄18~70岁,平均年龄(46.82±12.73)岁;病程1~9年,平均病程(4.39±1.12)年。对照组研究对象中男性23例,女性17例;年龄26~77岁,平均年龄(45.79±14.06)岁。4组研究对象性别、年龄等一般资料比较,差异无统计学意义(P>0.05),组间具有可比性。本研究经青岛市市北区人民医院伦理委员会批准,所有研究对象均对研究知情并签署知情同意书。纳入标准:①符合《中国肠易激综合征专家共识意见》[4]中IBS的诊断标准,并经CT、X线等检查确诊;②年龄18~80岁;③近4周内未使用抗生素。排除标准:①肠道器质性病变;②既往有胃肠手术史;③合并其他影响胃肠道功能的疾病。
1.2 研究方法 ①采集所有研究对象空腹静脉血4 mL,以3 000 r/min转速离心10 min,静置10 min后取上层清液,置于-70 ℃保存待检。采用速率散射比浊法检测免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)水平。②采集所有研究对象的新鲜粪便样本3~5 g,在30 min内送检,比较4组研究对象菌群密集度:采用显微镜(×1 000倍)(北京荣兴光恒科技有限公司,型号:RBX100)记录每个视野内的平均细菌数并对细菌密集度进行分级,平均细菌数1~9个为Ⅰ级;平均细菌数10~99个为Ⅱ级;平均细菌数≥100个为Ⅲ级;观察到光镜下细菌聚集成团或者将黏膜上皮细胞密集覆盖为Ⅳ级[5]。③采用显微镜观察染色切片,选取100~200个细菌,计算革兰阳性球菌、革兰阴性球菌、革兰阳性杆菌、革兰阴性杆菌所占比例。④比较4组研究对象肠道菌群检测结果:根据连续稀释法,在匀浆瓶中放入0.5 g粪便样本,稀释为10-1、10-2、10-3、10-4、10-5、10-6、10-7共7个稀释度,并按照不同类型细菌的正常菌落数范围选取相应的稀释度进行培养。以选择性培养平板对乳酸杆菌、双歧杆菌、大肠杆菌、肠球菌进行培养,平板需在37 ℃中培养24 h、在厌氧菌培养箱中培养72 h,之后采用平板活菌计数法计数,并鉴定细菌,使用对数值(Log N/g)对优势菌数量进行表示。
1.3 观察指标 ①比较4组研究对象体液免疫指标。②比较4组研究对象肠道菌群密集度。③比较4组研究对象细菌比例。④比较4组研究对象肠道菌群培养结果。
1.4 统计学分析 采用SPSS 22.0软件进行数据处理。计量资料以(x)表示,多组间行比较采用方差分析,两两比较采用LSD-t检验;计数资料以[例(%)]表示,组间比较行χ2检验,等级资料比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 4组研究对象体液免疫指标比较 便秘组、腹泻组、混合组研究对象IgA水平明显高于对照组,腹泻组研究对象IgG水平高于其他3组,差异有统计学意义(P<0.05);4组研究对象IgM水平比较,差异无统计学意义(P>0.05),见表1。

表1 4组研究对象体液免疫指标比较(g/L,x)
2.2 4组研究对象肠道菌群密集度比较 腹泻组研究对象肠道菌群密集度明显低于其他3组,差异有统计学意义(P<0.05);便秘组、混合组、对照组研究对象肠道菌群密集度比较,差异无统计学意义(P>0.05),见表2。
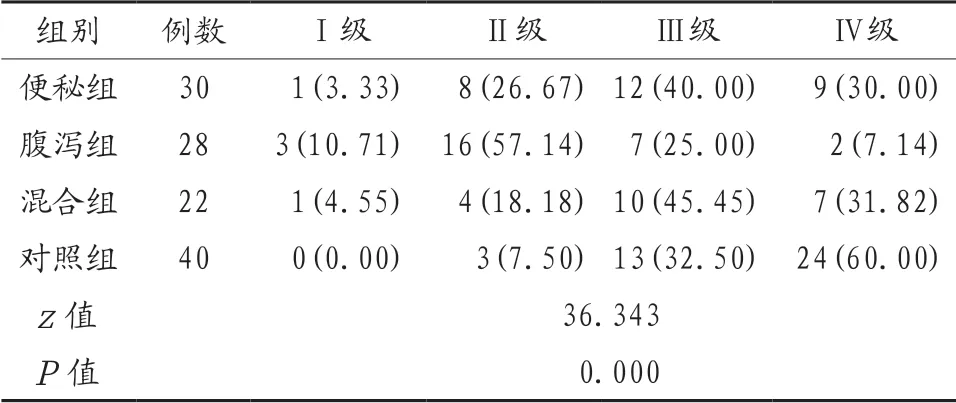
表2 4组研究对象肠道菌群密集度比较[例(%)]
2.3 4组研究对象细菌比例比较 便秘组、腹泻组、混合组研究对象革兰阳性球菌和革兰阴性杆菌的比例明显高于对照组,革兰阳性杆菌明显低于对照组,混合组研究对象革兰阴性球菌比例明显高于其他3组,便秘组、混合组研究对象革兰阳性杆菌比例明显高于腹泻组,便秘组、混合组研究对象革兰阴性杆菌比例明显低于腹泻组,差异有统计学意义(P<0.05),见表3。
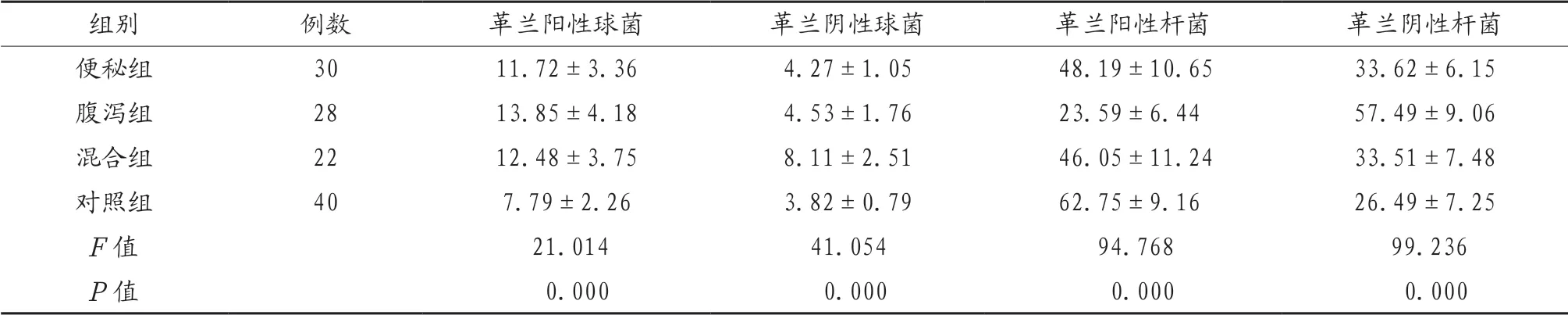
表3 4组研究对象细菌比例比较(%,x)
2.4 4组研究对象肠道菌群培养结果比较 便秘组、腹泻组、混合组研究对象乳酸杆菌、双歧杆菌明显少于对照组,腹泻组研究对象乳酸杆菌、双歧杆菌明显少于便秘组、混合组,差异有统计学意义(P<0.05);便秘组、腹泻组、混合组研究对象大肠杆菌、肠球菌明显多于对照组,腹泻组大肠杆菌明显多于便秘组、混合组,差异有统计学意义(P<0.05),见表4。
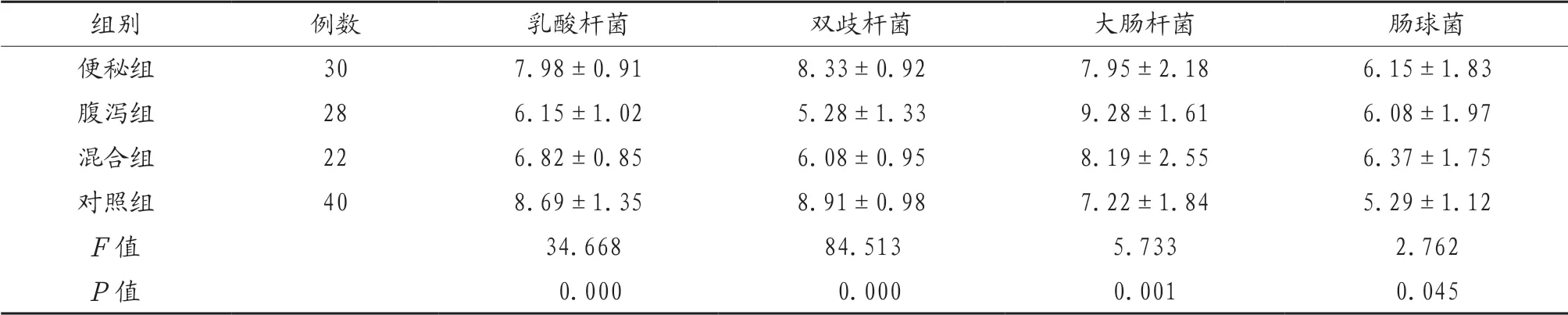
表4 4组研究对象肠道菌群培养结果比较(Log N/g,x)
3 讨论
本研究显示,与对照组比较,便秘组、腹泻组、混合组研究对象的IgA水平明显较高,腹泻组研究对象IgG水平高于其他3组,提示便秘型、腹泻型、混合型IBS存在一定的免疫功能异常。IgG是细胞外液和血液的主要抗体,IgG水平升高多见于萎缩性门静脉性肝硬化、系统性红斑狼疮及部分感染性疾病中,IgA主要产生于肠系膜淋巴浆细胞,能够发挥维持消化道黏膜免疫屏障的作用,对黏膜表面的各类抗原产生免疫排斥、免疫耐受等反应,从而对肠道微生态的组成和功能进行调节[6]。徐泽泉等[7]研究发现便秘型、腹泻型、混合型IBS患者均存在IgA水平异常情况,并且患者的肠道菌群失调与其免疫功能紊乱存在一定联系,该结论与本研究结果互为印证。
IBS的发病机制尚未完全明确,过去一般认为遗传、饮食、精神、肠道菌群失调等因素可能与IBS的发病有关。近些年有研究发现,肠道感染患者IBS的发病率明显提高,并且抗生素干预后相关的肠道症状得到改善,因此部分学者认为,肠道菌群失调也可能与IBS的发生或进展有关[8-9]。本研究显示,混合组研究对象革兰阴性球菌比例明显高于其他3组,便秘组、混合组研究对象革兰阳性杆菌比例明显高于腹泻组,便秘组、混合组研究对象革兰阴性杆菌比例明显低于腹泻组,与相关研究结果一致[10-11]。
本研究显示,与对照组比较,便秘组、腹泻组、混合组研究对象乳酸杆菌、双歧杆菌明显减少,大肠杆菌明显增加,并且腹泻组的变化幅度较大,提示3种亚型IBS均存在一定的肠道菌群失调,并且腹泻组较为严重。乳酸杆菌和双歧杆菌具有营养、免疫和生物拮抗等重要作用,通常会终身携带,是机体中重要的益生菌,而大肠杆菌和肠球菌是机体中常见致病菌,可引起IBS患者肠黏膜受损。乳酸杆菌、双歧杆菌比例的降低以及大肠杆菌和肠球菌比例的上升可引起肠源性内毒素水平提升,并且会增加肠道黏膜的通透性,诱发或加重炎症反应,造成患者病情加重[12]。
综上,便秘型、腹泻型、混合型3种亚型的IBS均存在不同程度的免疫紊乱和肠道菌群失调,其中腹泻型IBS的变化最明显,免疫功能紊乱主要表现为IgA、IgG水平的升高,肠道菌群失调则主要表现为乳酸杆菌、双歧杆菌等益生菌减少及大肠杆菌、肠球菌等致病菌的增加。临床针对不同亚型IBS患者进行治疗时,应根据其发病机制选择合适的药物,以改善疗效。

