上调C99片段对N2a/APP695细胞中MAM活性及线粒体自噬的影响*
付燕林, 张文萍, 龙培艳, 郑菊, 高霄, 齐晓岚, 肖雁*
(贵州医科大学 地方病与少数民族疾病教育部重点实验室 & 贵州省医学分子生物学重点实验室, 贵州 贵阳 550004)
阿尔茨海默病(Alzheimer's disease, AD)是一种以大脑中Tau蛋白磷酸化增多和β-淀粉样蛋白(amyloid protein, Aβ)沉积为主要病理特征的神经退行性疾病[1]。淀粉样前体蛋白(amyloid precursor protein, APP)首先经过β-分泌酶剪切生成一个C端(C99)片段和一个N端片段(sAPP),C99再被位于线粒体相关内质网膜 (mitochondrial associated ER membrane, MAM)处的γ-分泌酶诱导到MAM处剪切为Aβ和APP胞内功能域(APP intracellular domain, AICD)片段,Aβ不断积累引起AD的发生[2-3]。近年来,研究发现AD的发病机制可能不是Aβ累积[4-5],而是C99大量聚集在MAM处后导致MAM的活性上调,引起线粒体功能障碍[6-7],但其相关机制尚不明确。MAM是由2个线粒体融合蛋白-2 (mitofusin2, MFN2)相连、线粒体融合蛋白-1(mitofusin1,MFN1)与线粒体分裂蛋白-1(fission1, FIS1)相连,将内质网束缚在线粒体上形成一个富含脂质的区域[8-9],极易受到外在因素的干扰,影响其活性和调节功能[10]。研究发现根据MAM的特性可以通过胆固醇酰基转移酶-1(acetyl-CoAC-acetyl transferase, ACAT1)表达和线粒体与内质网之间的偶联来表示其活性情况[11-12]。MFN2/1和FIS1蛋白分别调节线粒体的融合和分裂,MAM的活性上调可能会影响该处的MFN1/2和FIS1蛋白的表达,造成线粒体分裂融合失衡,引起线粒体自噬增强[13-14]。线粒体自噬的经典信号通路是张力蛋白同源物诱导的假定激酶1(PTEN induced putative kinase 1,PINK1)/E3泛素连接酶(E3 ubiquitinpotein ligase parkin,Parkin),一般情况下,线粒体外膜上的PINK1被诱导到线粒体内膜,当线粒体损伤后,PINK1会聚集在外膜上自身磷酸化而激活,激活下游蛋白Parkin、并与微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)连接, 促进自噬体包裹线粒体,线粒体自噬发生,当自噬不断增强后可能导致细胞出现功能障碍甚至出现细胞凋亡[15-16]。因此,本研究以稳定表达APP695小鼠来源神经瘤母细胞株(mouse neuroblastoma cells, N2a)APP695细胞为AD的细胞模型,探究AD发病机制中C99上调对线粒体分裂融合及线粒体自噬的影响,为AD发病中线粒体功能障碍的后续研究提供相关分子机制。
1 材料与方法
1.1 实验材料
1.1.1细胞 小鼠神经瘤母细胞N2a/APP695由贵州医科大学医学分子生物学重点实验室谭俊教授馈赠。
1.1.2主要试剂和仪器 FIS1抗体购自Gene Tex公司(美国),MFN2、MFN1、PINK1、Parkin抗体和Cholesterol Assay Kit(Cell-Based)购自Abcam公司(美国),LC3、HRP标记的兔二抗和鼠二抗购自CST公司(美国),线粒体探针购自碧云天生物技术有限公司(中国,上海),内质网探针购自凯基公司(中国,江苏),γ-分泌酶抑制剂(DAPT)购自Sigma公司(美国);细胞培养箱购自Thermo fisher公司(美国),多功能酶标仪购自 BIOTEK 公司(美国),激光共聚焦显微镜购自奥林巴斯公司(日本),高速离心机购自Eppendorf 公司(德国),GeneGnome XRQ NPC 化学发光成像仪购自SYNGENE 公司(英国),BG-power600 型稳流电源购自百晶生物(中国,北京)。
1.2 研究方法
1.2.1细胞培养及处理 将高糖DMEM、opti-MEM、血清及双抗按照45 ∶44 ∶10 ∶1的比例配成完全培养基;N2a/APP695细胞从液氮中取出后迅速放置于37 ℃恒温水浴箱中使其快速溶解,然后转移到15 mL离心管中,再加入PBS 3 mL,1 000 r/min 离心4 min,去掉上清,加入 4 mL 完全培养基,将细胞团吹散混匀,装于T25培养瓶,置于5%CO2、37 ℃培养箱中培养;待细胞处于生长对数期时以1×106个/孔种植于6孔板中,细胞长到80%后,去掉完全培养基,加入纯DMEM培养基继续培养24 h。细胞分为γ-分泌酶抑制剂(DAPT)处理组和正常对照组(Control),DAPT处理组去除纯DMEM培养基后加入含有DAPT(10 μmol/L)完全培养基培养20 h,正常对照组去除纯DMEM培养基后加入普通的完全培养基培养20 h。
1.2.2蛋白免疫印迹(Western blot)法检测蛋白表达 DAPT处理组和正常对照组细胞分别用1×PBS洗3次,每孔加入1/100 PMSF的RIPA裂解液100 μL,冰上裂解30 min,14 000 r/min离心20 min后收集上清液,BCA蛋白定量法测定蛋白浓度。通过12%的SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)30 mA恒流电泳至蛋白质标准物分离到合适间距(约1.5~2 h)后结束电泳;将凝胶中的蛋白质通过湿法电转印转移至 PVDF膜上(200 mA,2 h),用含5%脱脂奶粉室温封闭1 h,分别加入一抗 Y188(1 ∶1 000)、ACAT1 (1 ∶1 000)、MFN1(1 ∶1 000)、MFN2(1 ∶1 000)、FIS1(1 ∶1 000)、LC3(1 ∶1 000)、PINK1(1 ∶200)、Parkin(1 ∶1 000)、β-actin(1 ∶4 000)、BCL-2(1 ∶1 000)及P62(1 ∶1 000),一抗孵育放置4 ℃冰箱中摇床慢摇过夜。次日回收一抗后用TBST漂洗3次,每次10 min。加入对应的二抗(1 ∶5 000),室温孵育1 h,TBST 漂洗3次,每次10 min。使用ECL发光试剂盒和GeneGnone XRQ曝光仪进行曝光,Image J软件分析条带灰度值。
1.2.3激光共聚焦显微镜观察内质网与线粒体的共定位 N2a/APP695细胞按照5×105个/孔浓度种植于共聚焦培养皿中,细胞生长到50%后分组,并按照1.2.1项下的方法对细胞分别处理。将ER-Red(1 ∶2 000)和Mito-Tracker Green(1 ∶20 000)分别稀释于无酚红培养基中配置成染色工作液,放于37 ℃培养箱中预温育15 min,去除原培养液,用PBS洗1次,加入ER-Red染色工作液1 mL/孔,37℃孵育30 min。去除ER-Red染色工作液,用无酚红DMEM洗涤细胞1~2次,加入Mito-Tracker Green染色工作液1 mL/孔,37 ℃孵育1 h。去除Mito-Tracker Green染色工作液,用无酚红DMEM洗1次,加入完全培养基,激光共聚焦显微镜观察。
1.2.4JC-1检测细胞线粒体膜电位 N2a/APP695细胞以5×105个/孔种植在激光共聚焦培养皿中,细胞生长到50%后分组,并按1.2.1项下的方法对细胞分别处理。取JC-1(200×) 染色试剂37.5 μL加入到8 mL超纯水中震荡溶解,取JC-1染色缓冲液(5×)1.5 mL混匀即为JC-1染色工作液,去除原培养液,PBS洗2次,每孔先加入完全培养基0.5 mL,再加入JC-1染色工作液1 mL,放置37 ℃培养箱中培养30 min,去除上清,用JC-1缓冲液洗涤1次,加入1 mL完全培养基,激光共聚焦显微镜观察。
1.3 统计学分析
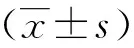
2 结果
2.1 DAPT处理N2a/APP695细胞后C99表达情况
结果显示,与Control组相比,DATP组N2a/APP695细胞中C99蛋白表达明显上调,差异有统计学意义(P<0.01)。见图1。
注:A为Western blot蛋白条带图,B为C99条带灰度值统计图,(1)与Control组比较, P<0.01。图1 两组N2a/APP695细胞中C99蛋白表达Fig.1 Protein expression levels of C99 in N2a/APP695 cells in each group
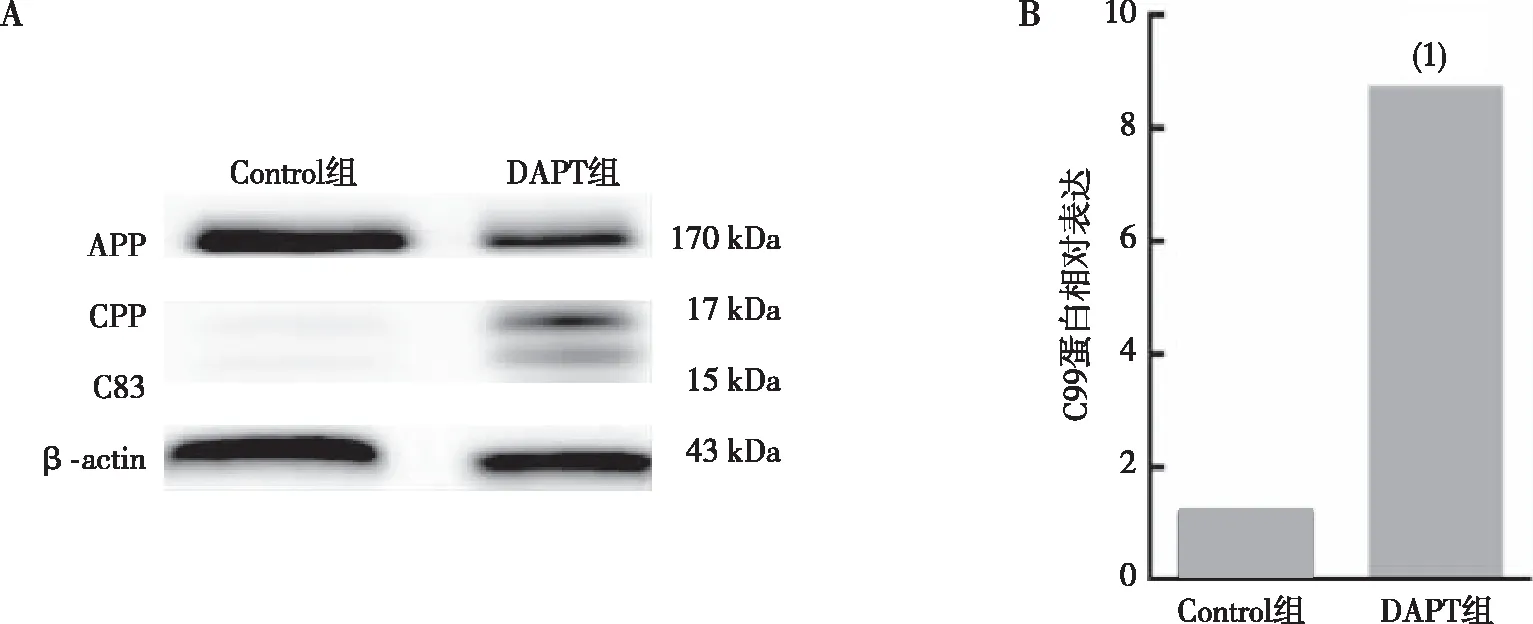
2.2 上调N2a/APP695细胞中C99水平后的MAM活性
DAPT处理N2a/APP695细胞20 h后使用线粒体荧光探针(绿光)与内质网荧光探针(红光)对细胞进行染色处理,结果显示,DAPT组内质网与线粒体共定位(黄光)明显多于Control组;DAPT组中ACAT1的表达高于Control组,差异有统计学意义(P<0.05)。见图2。
注:A为线粒体与内质网共定位图,绿色为线粒体,红色为内质网,黄色为线粒体与内质网共定位;B为细胞中ACAT1蛋白表达情况,(1)与Control组相比,P<0.05。图2 上调N2a/APP695细胞中C99水平后的MAM活性(激光共聚焦,×100)Fig.2 MAM activity following C99 upregulation in N2a/APP695 cells(laser confocal microscope,×100)
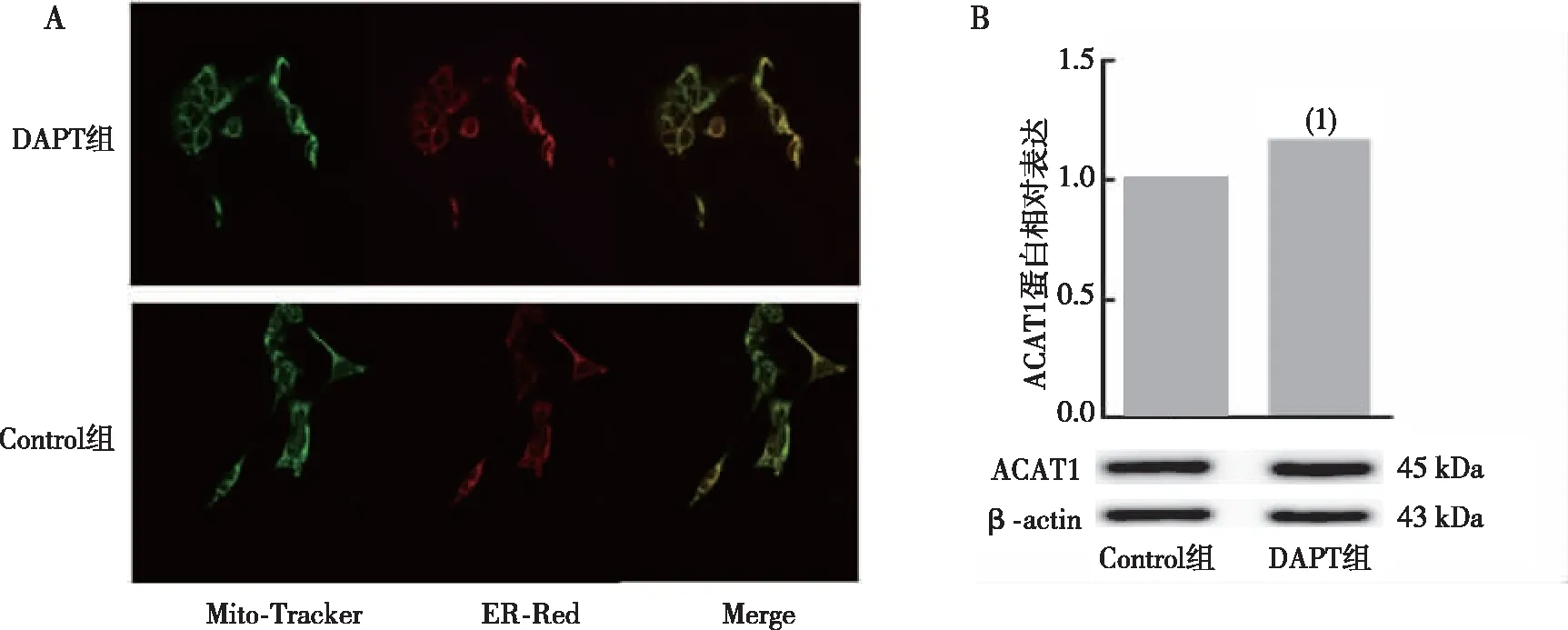
2.3 线粒体分裂融合蛋白的表达与线粒体膜电位
采用Western blot与JC-1染色分别检测线粒体融合与分裂蛋白MFN2、MFN1及FIS1表达与线粒体膜电位,结果显示,与Control组相比,DAPT组细胞中MFN2、MFN1、FIS1表达水平上调,差异有统计学意义(P<0.05,图3);线粒体膜电位结果显示,Control组中细胞产生红色荧光,线粒体膜电位较高,DAPT组中细胞中发出红光荧光较少,线粒体膜电位降低,DAPT组中红光与绿光的比值明显低于Control组(P<0.01,图4)。
注:A为Western blot蛋白条带图,B为MFN1、MFN2、FIS1条带灰度值统计图;与Control组比较, (1)P<0.05,(2)P<0.01。图3 各组N2a/APP695细胞中MFN1、MFN2及FIS1蛋白表达Fig.3 Expression of MFN1, MFN2, and FIS1 proteins in N2a/APP695 cells in each group
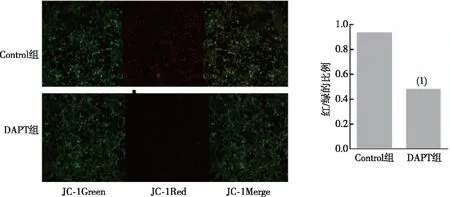
注:线粒体膜电位荧光结果(10×);(1)与Control组比较, P<0.01。图4 两组N2a/APP695细胞中线粒体膜电位情况Fig.4 Mitochondrial membrane potential in N2a/APP695 cells of two groups
2.4 线粒体自噬相关蛋白表达
结果显示,与Control组相比,DAPT组N2a/APP695细胞中PINK1蛋白和Parkin蛋白表达水平上调,差异有统计学意义(P<0.05);LC3Ⅱ/Ⅰ蛋白比例上升,差异有统计学意义(P<0.01)。见图5。
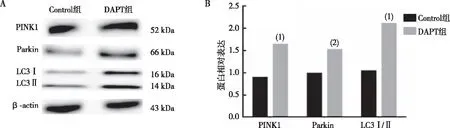
注:A为Western blot蛋白条带图,B为PINK1、Parkin、LC3Ⅰ及LC3Ⅱ条带灰度值统计图;与Control组比较,(1)P<0.01, (2)P<0.05。图5 两组N2a/APP695细胞中PINK1、Parkin及 LC3蛋白表达Fig.5 Protein expression levels of PINK1, Parkin, and LC3 in N2a/APP695 cells of two groups
2.5 细胞凋亡情况
Western blot检测细胞抗凋亡蛋白P62、BCL-2表达结果显示,与Control组比较,DAPT组N2a/APP695细胞中P62、BCL-2蛋白表达降低,差异有统计学意义(P<0.01或P<0.05)。见图6。
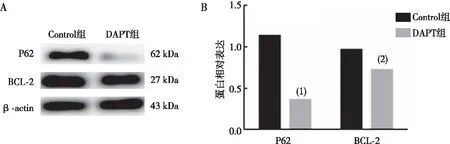
注:A为Western blot蛋白条带图,B为P62、BCL-2条带灰度值统计图;与Control组比较,(1) P<0.01,(2) P<0.05。图6 两组N2a/APP695细胞中BCL-2、P62蛋白的表达情况Fig.6 Protein expression levels of BCL-2 and P62 in N2a/APP695 cells of two groups
3 讨论
MAM 是线粒体与内质网紧密相连的区域,其参与了细胞多种代谢功能和疾病的发生,例如糖尿病、精神分裂症、肝细胞癌[17-19]。在AD的早期发病机理中,MAM-C99的相互作用被认为可能是线粒体功能障碍的一个非常重要的因素[20-21],但是其相关机制并不十分的清楚。
MAM具有脂筏样结构域,该结构域驻留大量的蛋白使线粒体与内质网相连,此外,胆固醇代谢的调节是其结构形成和功能执行的重要决定因素[22-23]。研究发现通过检测ACAT1表达变化和线粒体与内质网之间的偶联情况可判定MAM 的活性变化[12]。在本研究中,利用DAPT抑制γ-分泌酶的活性后C99的表达上调,ACAT1的表达上调、线粒体与内质网之间的偶联增高,这表明C99上调增加了MAM的活性。MFN2、MFN1和FIS1不仅是形成MAM结构区域的组成蛋白,还是线粒体分裂融合的调控蛋白[24-25],线粒体的融合是有选择性的,线粒体分裂后的去极化子线粒体不参与到后期的融合中,最终将会通过自噬消除[26-28]。本研究结果显示,当C99聚集后(细胞中水平增加)MAM活性上调,MFN2、MFN1及FIS1蛋白的表达水平均明显升高,说明线粒体可能通过快速融合与分裂消除细胞内受损的线粒体。采用JC-1染色检测线粒体膜电位发现,与正常对照组比较,DAPT组中细胞线粒体膜电位降低,线粒体膜电位去极化,表明C99聚集后(细胞中水平增加)后线粒体在快速分裂过程中产生了去极化的子线粒体,它们可能无法参与线粒体的再次融合,最终通过自噬消除,因此线粒体自噬蛋白PINK1、Parkin及LC3表达上调,线粒体自噬增强。有研究报道,膜电位的下降还与细胞的凋亡相关[29-30]。本研究对抗凋亡蛋白BCL-2、P62进行检测,结果显示BCL-2、P62表达下降,进一步提示细胞出现凋亡情况。
综上所述,本研究发现在AD细胞模型中C99表达增加会上调MAM活性,影响位于MAM的MFN2、MFN1和FIS1蛋白表达情况,破坏线粒体分裂融合平衡,导致线粒体自噬增强与细胞凋亡,这可能是AD中线粒体功能障碍和细胞损伤分子机制之一。

