基于乳清蛋白的骆驼乳中掺假牛乳的检测及热处理对方法的影响
李玲玉,王 俊,李敏婧,杨迎春,苗 静,赵仲凯,杨 洁
(新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046)
新疆作为我国畜牧大省(区),在双峰驼数量以及驼乳产量上占据优势地位[1]。近年来,随着乳制品工业的快速发展、乳品科学技术的不断进步,国内外学者对驼乳营养价值、生理功能等的研究日益深入,使得驼乳在疾病辅助治疗、营养保健、食品加工应用中拥有巨大的潜力[2-5],其经济价值远高于牛乳(牛乳:7 元/kg;双峰驼乳:50~80 元/kg)。但由于双峰驼乳产量远低于牛乳,乳供应量明显受季节性波动的影响[6],且奶源质量难以控制[7],这使得驼乳及其制品成为蓄意掺假的目标,受经济利益驱动的掺假现象时常发生[8];向高价值的驼乳中掺入低值的牛乳是最常见且最容易实现的掺假行为,这种掺假行为除了造成消费者的经济损失外,还可能对个人健康造成不良后果,特别是对牛乳过敏的人群[9]。
而目前国内对于双峰驼乳及乳制品的掺假检测并没有明确标准[7],市场监管缺乏可依靠的标准及检测方法。此外,国内外关于双峰驼乳的掺假检测相关报道较少,而对水牛乳、羊乳及乳制品掺假辨别技术的研究比较深入[10-11]。因此,迫切需要针对新疆双峰驼乳及乳制品掺假问题,建立筛查、分析检测方法以及相应的标准,维护广大消费者的利益。
常用的乳源畜种的辨别技术可以根据DNA序列和乳蛋白分为两类。物种特异性DNA序列已广泛应用于聚合酶链式反应(polymerase chain reaction,PCR)检测,它可以识别不同畜种的动物乳来源,从而辨别乳的掺假[12-14],但PCR方法的DNA分离程序较为繁琐,且通常不产生定量信息。与基于DNA序列分析的方法相比,基于蛋白质的方法主要关注乳的蛋白质差异,相比之下更为实用,常见的技术方法有毛细管电泳法[15]、双向电泳法[10,16]、酶联免疫吸附法[17-18]和液相色谱法[19]。
基于蛋白质的检测方法中,液相色谱法因具有简单的样本制备、有效的分离和定量以及高的灵敏度和选择性的特点,被广泛地应用于乳及乳制品的掺假检测当中。近年来,高效液相色谱(high performance liquid chromatography,HPLC)法和超高液相色谱(ultra-high performance liquid chromatography,UPLC)法已经成功应用到掺假的水牛乳、山羊乳或绵羊乳及其制品的检测,蛋白标识物主要分为乳清蛋白和酪蛋白[19-20]。乳清蛋白标识物以β-乳球蛋白(β-lactoglobulin,β-Lg)和α-乳白蛋白(α-lactalbumin,α-La)为主,酪蛋白标识物主要有κ-酪蛋白和αs1-酪蛋白。如Ke Xing等[21]建立了一种UPLC-串联质谱方法,通过检测特征蛋白肽同时定量4 种酪蛋白和两种主要的乳清蛋白,这些肽能够作为标识物用于定量分析山羊乳或绵羊乳制品中掺假的牛乳。然而目前报道中鲜见使用UPLC法,以牛乳清蛋白为掺假标识物,检测新疆双峰驼乳及其制品中掺假的牛乳。本实验室在前期研究工作中发现,驼乳乳清蛋白的组成与牛乳相比有较明显的差异[22];此外,有大量研究表明:驼乳乳清蛋白中含有极少量或不含有β-Lg[16,23-24],因此牛β-Lg可作为一种潜在的标识物用于驼乳中牛乳掺假的检测。
本研究基于UPLC技术手段,以牛β-Lg为掺假标识物,通过评估牛β-Lg的水平定性、定量检测驼乳中掺假的牛乳。此外,通过已建立的UPLC方法对10种随机购买的市售纯驼乳粉进行检测,以评估目前国内市场上纯驼乳粉的掺假情况。
1 材料与方法
1.1 材料与试剂
鲜驼乳采集自乌鲁木齐市红雁池,鲜牛乳采集自昌吉吉木萨尔,10 种市售全脂纯驼乳粉购买自当地市场及电商平台,纯牛乳粉和纯驼乳粉样品由厂家提供。
牛β-Lg标准品(纯度≥90%)、牛α-La标准品(纯度≥85%)、牛血清白蛋白标准品(纯度≥98%)、牛乳铁蛋白标准品(纯度≥85%)和乙腈(HPLC级) Sigma上海仪器公司;三氟乙酸(trifluoroacetic acid,TFA,分析纯) 成都市科隆化学品有限公司;冰乙酸(分析纯) 天津市鑫铂特化工有限公司;实验过程中均使用超纯水。由于缺乏骆驼乳蛋白的商业标准品,本研究所用驼α-La是由本实验室制备,通过质谱鉴定为alpha-lactalbumin(Camelus bactrianus),登录号为XP_010962515.1。
1.2 仪器与设备
AcquityTMUPLC仪(配有光电二极管阵列检测器和Waters Empower 3色谱工作站) 美国Waters公司。
1.3 方法
1.3.1 色谱条件
色谱柱:BEH300 C4柱(100 mm×2.1 mm,1.7 µm);流动相:A为0.1% TFA溶液,B为0.1% TFA的乙腈溶液;洗脱梯度:0~2.08 min,75%~68% A、25%~32% B;2.08~8.34 min,68%~48% A、32%~52% B;8.34~10.42 min,42%~75% A、52%~25% B;10.42~11 min,75% A、25% B。流速0.2 mL/min,检测波长214 nm,进样体积5 µL,柱温30 ℃,样品温度25 ℃。
1.3.2 样本制备及处理
取鲜牛乳按体积分数100%、80%、60%、50%、35%、25%、20%、10%、5%、3%、2%、1%、0.5%、0.2%、0.1%比例掺入到鲜驼乳中制备掺假样本(3 个重复);取牛乳粉按质量分数100%、80%、60%、50%、40%、30%、20%、10%、5%、2%、1%、0.5%、0.2%比例掺入到纯驼乳粉中,制备掺假样本(3 个重复),然后按1∶10的比例,将10 g粉样溶于100 mL超纯水中;热加工处理鲜乳样条件如表1所示。

表1 乳样本的热处理条件Table 1 Heat treatment conditions for milk samples
参考Manzo等[19]的乳样前处理方法并稍作改动,去除乳样中的乳脂和酪蛋白。取25 mL乳样经4 ℃、8 000 r/min离心15 min去除乳脂;将清液收集到烧杯中,向脂肪层和沉淀酪蛋白层加入5 mL水,涡旋3 次,使残留在脂肪层和酪蛋白层的乳清蛋白洗出,将洗液一并倒入烧杯;用冰乙酸调pH 4.6,40 ℃水浴20 min,经4 ℃、8 000 r/min离心15 min,除去酪蛋白;将清液收集到烧杯中,向沉淀酪蛋白层加入10 mL水,涡旋3 次,使残留在酪蛋白层的乳清蛋白洗出,将洗液一并倒入烧杯中;最后将乳清蛋白清液用水洗入50 mL容量瓶并定容,经0.22 μm微孔滤膜过滤,用于液相色谱分析。
1.3.3 蛋白标准品标准曲线的绘制
取牛β-Lg标准品,用超纯水将标准品配成1 000 mg/L的母液,后依次稀释成质量浓度为500、200、100、50、25 mg/L的标准系列溶液,进行液相色谱分析。以牛β-Lg标准品质量浓度为横坐标(x),峰面积为纵坐标(y),绘制牛β-Lg的标准曲线。
1.3.4 掺假乳样本掺假标准曲线的绘制
通过测量一系列掺假样本中牛β-Lg的峰面积,与添加的牛乳或牛乳粉的比例构建掺假标准曲线,掺假样本的标准曲线以掺入牛乳或牛乳粉的百分比为横坐标,以掺假标识物牛β-Lg的峰面积(3 个平行测量的平均值)为纵坐标绘制。
1.4 数据统计及图表绘制
使用Microsoft Excel 2013(Microsoft Corporation,Redmond,WA,USA)进行数据统计分析和表格绘制,使用Origin 8.5软件(OriginLab,Northampton,MA,USA)进行数据回归分析和绘制蛋白色谱瀑布图。
2 结果与分析
2.1 乳清蛋白的分离鉴定
采用外标法,所建立的掺假检测分析方法可以有效的分离和鉴定驼乳和牛乳中的乳清蛋白。含有驼α-La、牛α-La和牛β-Lg的混合标准品溶液在色谱柱梯度洗脱程序中运行11 min,3 种乳清蛋白组分在9 min内实现了有效分离(图1A);由图1A可知,驼α-La的保留时间为6.6 min,牛α-La的保留时间为7.2 min,牛β-Lg的保留时间为8.4 min;图1B为3 种蛋白混合标准品的三维色谱图。
驼α-La由123 个氨基酸组成,其中第39个氨基酸与牛α-La的对应氨基酸不同[25],根据氨基酸序列比对,这两个蛋白之间的相似性和同一性分别为82.9%和69.1%[26];此外,驼α-La的分子质量为14.43 kDa,而牛α-La的分子质量为14.18 kDa[27],因此,这两种蛋白质具有不同的保留时间。
由鲜驼乳乳清蛋白的色谱图(图1C蓝色线)可以看出,在该掺假检测分析方法下,鲜驼乳乳清蛋白谱图只有一个主峰(b1),该峰保留时间在6.649 min,根据标准品色谱图比对,可以确定该蛋白为驼α-La。与鲜驼乳乳清蛋白不同,鲜牛乳乳清蛋白(图1C红色线)在保留时间7.280 min和8.417 min(a1)处出现了两个主峰,根据峰保留时间和牛β-Lg标准品色谱峰锋形,可以确定蛋白a1为牛β-Lg。鲜牛乳和鲜驼乳乳清蛋白谱图重叠时,可以清晰地识别出牛β-Lg(图1C),驼乳中不含有β-Lg;同时,在分析鲜驼乳和鲜牛乳各占50%(体积分数)的掺假乳样本时,可以确定牛β-Lg很容易被识别出(图1D)。因此,所建立的以牛β-Lg为掺假标识物的UPLC方法,可用于驼乳中掺假牛乳的检测。显示峰纯度的三维色谱图:鲜驼乳和鲜牛乳各50%掺假乳样本的三维色谱图如图2所示。

图1 单独标准品、混合标准品及掺假样品色谱图Fig.1 Chromatograms of individual and mixed standards of camel α-La,bovine α-La and bovine β-La and adulterated samples
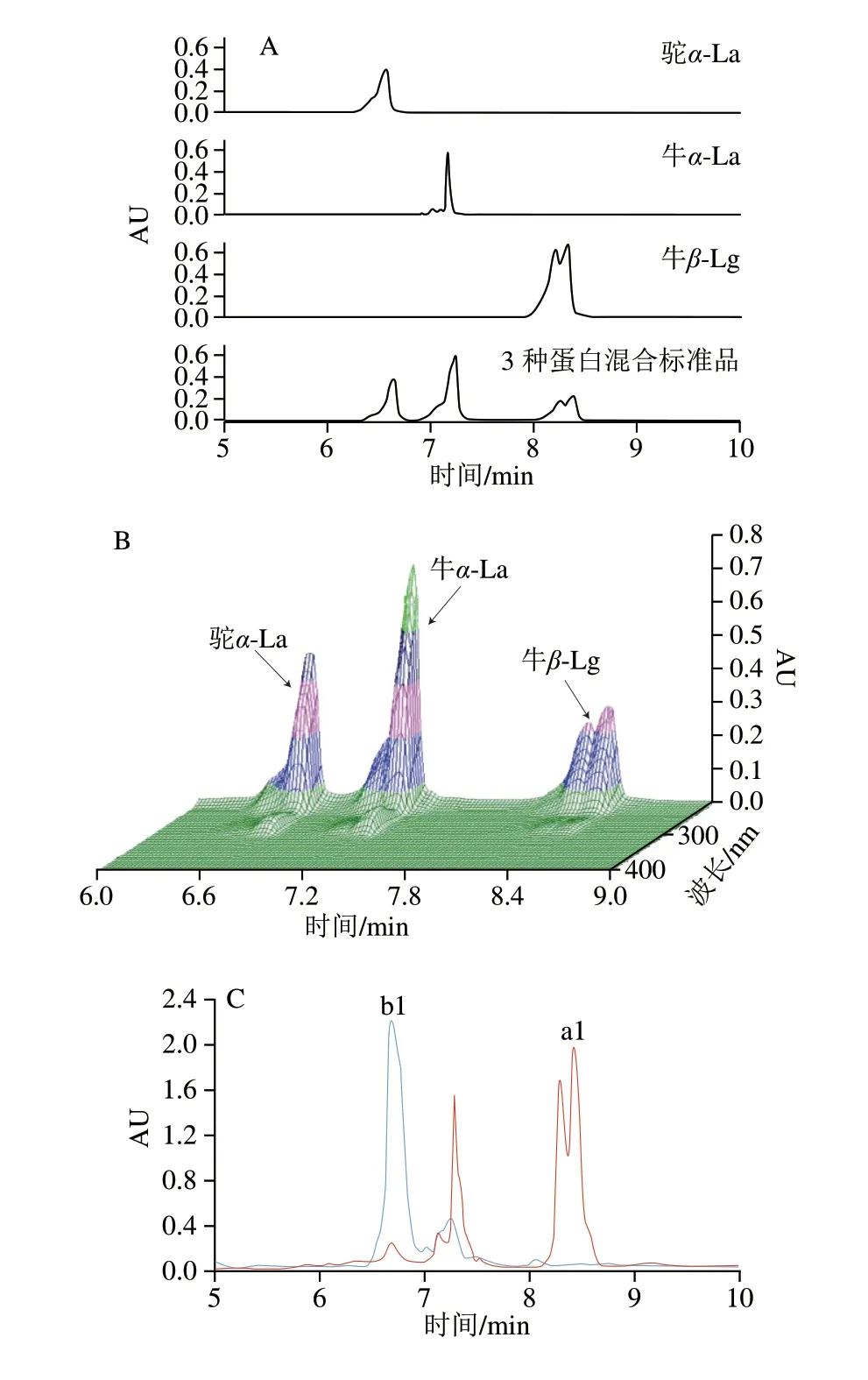
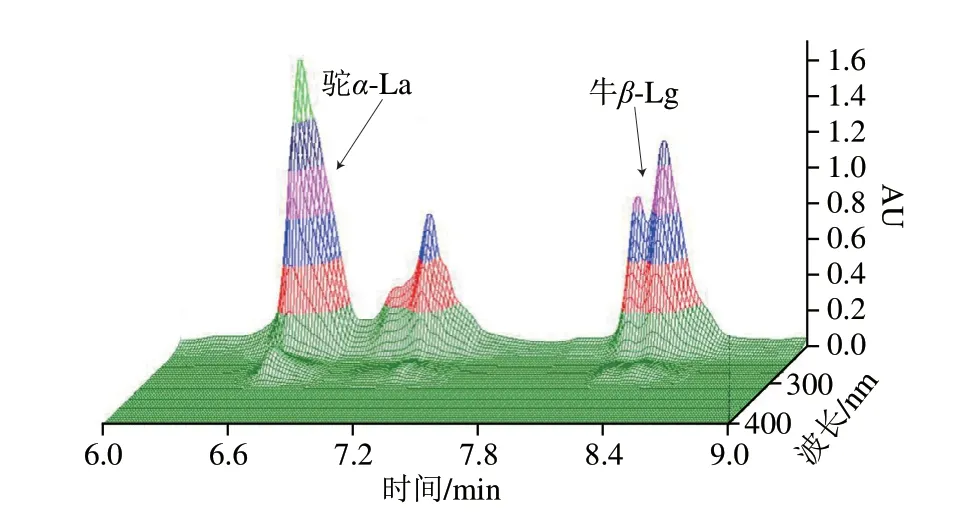
图2 鲜驼乳和鲜牛乳各50%掺假乳样本的三维色谱图Fig.2 3D chromatograms of raw camel milk and milk powder adulterated with 50% cow milk
2.2 掺假标识物牛β-Lg受热处理的影响
根据表1,将同一批采集的新鲜牛乳分成5 组,其中3 组按不同热处理条件处理:巴氏杀菌乳、高温灭菌乳和超高温灭菌乳,1 组新鲜乳样不经任何热处理作为对照,另外1 组新鲜乳样不经任何处理直接冻干作为奶粉的对照(涉及复溶使蛋白溶度不一致的问题)。
由图3可知,巴氏杀菌条件下,掺假标识物牛β-Lg受热处理的影响较小,而高温灭菌条件以及超高温灭菌条件影响均较大。与鲜乳相比,不经任何处理直接冻干的乳粉按1∶10比例复溶后,乳液中的β-Lg含量有所下降;而喷雾干燥乳粉与冻干乳粉相比,β-Lg的损失较大,这可能是乳粉制作过程中蛋白质的降解所致[28]。结果表明:巴氏杀菌乳受热处理影响较小,不影响β-Lg作为掺假标识物进行检测;乳粉样本虽受热处理的影响较大,但不影响β-Lg作为掺假标识物进行检测;因此,该掺假检测方法,以牛β-Lg为掺假标识物,可以应用于鲜驼乳、巴氏杀菌驼乳以及驼乳粉的掺假定性检测。
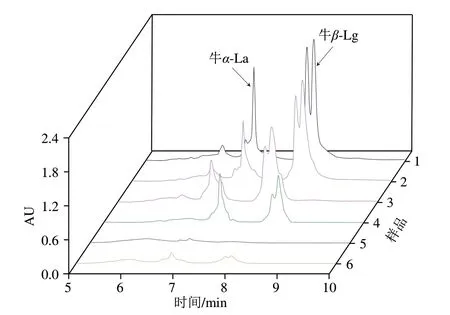
图3 不同热处理方式下牛乳乳清蛋白谱图Fig.3 Chromatograms of cow milk whey protein under different heat treatments
2.3 掺假标准曲线的绘制
将同一批采集的新鲜乳样,按照1.3.2节样本的制备配成一系列驼乳掺假样本后,分为2 组:鲜乳组和巴氏杀菌乳组3 个重复;纯驼乳粉和纯牛乳粉样本同样按照1.3.2节样本的制备配成一系列驼乳粉掺假样本3 个重复;按照1.3.1节的色谱条件进行3 种类型掺假乳样标准曲线的绘制。
3 种类型一系列掺假乳样本的色谱图如图4所示,牛β-Lg的峰强度均随着牛乳或牛乳粉添加比例的增加而增加,同时牛β-Lg峰面积的增加与牛乳或牛乳粉添加比例的增加呈正相关,说明该方法能较好地检测驼乳中掺假牛乳的百分比。驼鲜乳掺入牛乳的标准曲线,其回归方程为y=277 219.32x-128 496.92,R2=0.997 9;巴氏杀菌驼乳掺入牛乳的标准曲线,其回归方程为y=267 597.11x-647 839.84,R2=0.996 9;驼乳粉掺入牛乳粉的标准曲线,其回归方程为y=101 795.61x-363 117.54,R2=0.997 8;结果表明:3 种类型掺假乳样本标准曲线的线性良好,线性相关系数(R2)分别为0.997 9、0.996 9和0.997 8,均在0.99左右,可用于驼乳中掺假牛乳的定量检测。

图4 鲜驼乳掺牛乳(A)、巴氏杀菌驼乳掺牛乳(B)、驼乳粉掺牛乳粉(C)的蛋白色谱瀑布图Fig.4 Waterfall chromatograms of proteins in raw camel milk adulterated with cow milk (A),pasteurized camel milk adulterated with cow milk (B) and camel milk powder adulterated with cow milk powder (C)
通过检测牛β-Lg的峰面积,定量评价驼乳中掺假牛乳的百分比,该分析方法最低可检测至鲜驼乳掺假牛乳2%(V牛乳/V驼乳)、巴氏杀菌驼乳掺假牛乳3%(V牛乳/V驼乳)、驼乳粉掺假牛乳粉5%(m牛乳粉/m驼乳粉),检出限依据信噪比RSN=3确定,从成本和风险的角度来看,掺假比例低于5%属于无意污染[29],因此该方法可满足实际应用的要求。以β-Lg标准品的标准曲线计算得,鲜驼乳掺假检出限为β-Lg 107.448 mg/L、巴氏杀菌驼乳掺假检出限为β-Lg 103.648 mg/L、驼乳粉掺假检出限为β-Lg 77.947 mg/100 g。掺假检测定量限为鲜驼乳掺假牛乳5%(V牛乳/V驼乳)β-Lg 181.324 mg/L、巴氏杀菌驼乳掺假牛乳5%(V牛乳/V驼乳)β-Lg 149.628 mg/L、驼乳粉 掺假牛乳粉1 0 %(m牛乳粉/m驼乳粉),β-Lg 105.246 mg/100 g,定量限依据信噪比RSN=10确定。
此外,建立良好的掺假定量方程时,存在乳中蛋白质浓度的不确定性问题[11],如掺假标识物牛β-Lg在牛乳中的浓度受多种因素(品种、季节、地区、泌乳期等)的影响[24],具有不可控和不确定性;此外,乳粉的加工工艺条件不尽相同,会导致不同程度的蛋白质损失,也使得乳中蛋白质浓度存在不确定性[28,30]。但是,蛋白质浓度的不确定性现实存在并且不可避免,对于任何掺假标识物和任何掺假定量检测方法均是如此,因此,定量方程必须假设相同的牛β-Lg浓度,计算出的掺假水平只能视为近似估计。
2.4 方法学评价结果
2.4.1 分离选择性
由于样本前处理准备过程中没有选择性的只提纯牛β-Lg(除脂后仅酸沉淀去除酪蛋白),所以获得的乳清清液里包含其他乳清蛋白,并且可能在214 nm处对目标蛋白(β-Lg)检测的存在干扰。因此,根据Boitz等[31]的方法,为验证该方法的分离选择性,使用所建立的UPLC方法对另外的主要牛乳清蛋白(牛血清白蛋白、乳铁蛋白和乳白蛋白)进行分析。混合标准品溶液的色谱图见图5,4 种牛乳请蛋白在9 min内实现有效分离,且驼α-La与牛α-La和牛β-Lg也实现了很好地分离(图1a),结果表明牛乳和驼乳乳清中主要其他乳清蛋白对牛β-Lg标识物的检测不会造成干扰。
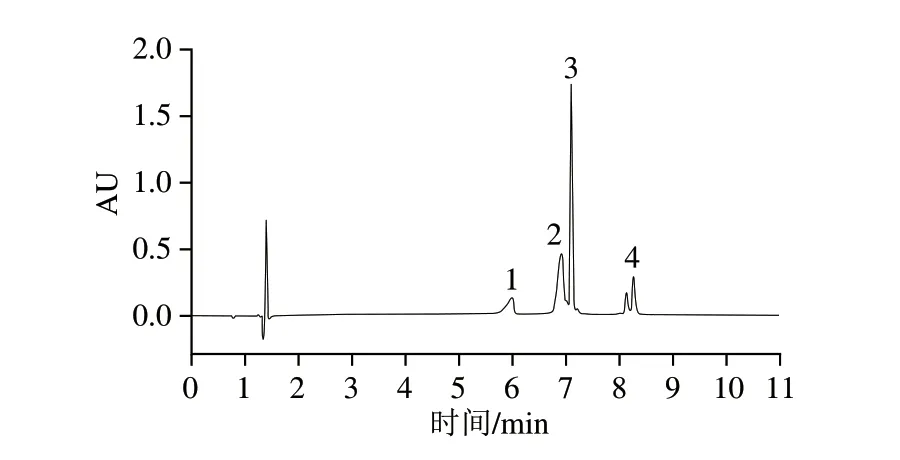
图5 牛乳清蛋白标准品的液相色谱图Fig.5 Liquid chromatograms of bovine whey protein standards
2.4.2 线性范围
通过制备一系列质量浓度的牛β-Lg标准溶液,评估该方法下牛β-Lg线性质量浓度范围。以6 个数据点(3 次进样的平均值)建立牛β-Lg标准曲线,结果表明β-Lg在25~1 000 mg/L范围内线性良好,线性回归方程为y=18 996.40x-386 292.29,R2=0.999 9。
2.4.3 精密度
以低、中、高3 个水平掺假驼奶粉(30%、50%、80%)为样本,通过比较牛β-Lg峰面积的值,评价该方法的日内(同一样本1 d内进样6 次)和日间(同一样本连续进样3 d)的精密度[32]。3 个掺假驼奶粉样本日内精密度的相对标准偏差(relative standard deviation,RSD)分别为0.45%、0.23%和0.10%,日间精密度RSD分别为7.18%、1.64%和1.26%。结果表明,所建立的掺假检测方法具有良好的精密度,包含仪器的精密度和供试样本的稳定性。
2.4.4 重复性和回收率
通过对纯牛奶粉和纯驼奶粉各进行5 次独立前处理样品检验,通过比较牛β-Lg、驼α-La峰面积值,验证样品制备过程以及取样的重复性,纯牛奶粉和纯驼奶粉RSD分别为2.77%和1.44%。以上结果表明,该方法的重复性好(RSD≤5%)。
为测试检测方法的回收率,向经过重复性检验的纯牛奶粉样品(β-Lg质量浓度均值为126.95 mg/L)中加入牛β-Lg标准品,加入标准品的质量浓度分别为61.80、122.40 mg/L和204.00 mg/L,各3 个重复;向经过重复性检验的驼奶粉样本(β-Lg含量为0.00 mg/L)中加入牛β-Lg标准品,加入标准品的质量浓度为61.92、103.20 mg/L和165.12 mg/L,各3 个重复;按照与样本相同的前处理方法以及色谱条件进行测试,用牛β-Lg标准品的线性标准曲线计算牛β-Lg的质量浓度。该方法的加标回收率为94.76%~105.18%,RSD为0.48%~4.20%,结果表明方法回收率较好(表2)。

表2 方法的回收率Table 2 Spiked recovery of the developed method
2.5 市售驼乳粉样本检测
从当地市场和电商平台随机购买了10 种市售纯驼乳粉样本,将这些样本按照1.3.2节前处理方法以及1.3.1节色谱条件进行检测,各3 个重复。根据牛β-Lg标准曲线y=18 996.40x-386 292.29,可以计算得出市售纯驼乳粉样本中牛β-Lg含量;此外,根据建立的“理想化”驼乳粉掺假牛乳粉标准曲线可计算得到驼乳粉掺假牛乳的大致估计比例,纯驼乳粉掺假情况如表3所示。在10 种全脂纯驼乳粉样本中,未检测到牛β-Lg的有6 种,表明这6 种驼乳粉没有掺入牛乳;有4 种检测到了牛β-Lg,表明这4 种驼乳粉中掺入了牛乳,该检测结果与本实验室以前建立的PCR方法检测结果一致[12],这排除了检测结果的假阳性和假阴性。结果表明,该方法可成功应用于市售驼乳粉中掺假牛乳的筛查、检测。市售纯驼乳粉样本CMP1-2和CMP1-3的色谱图见图6。
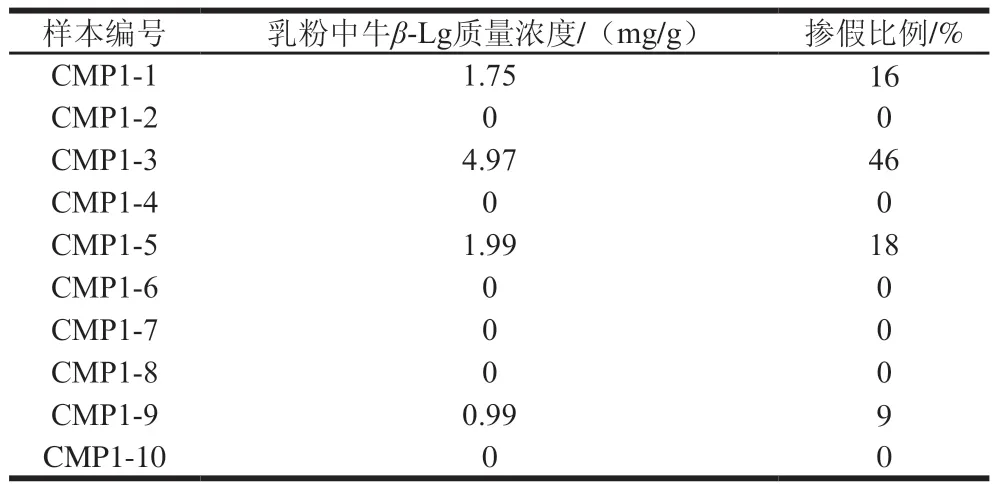
表3 10 种市售纯驼乳粉样本掺假检测结果Table 3 Results obtained for detection of adulteration in 10 different camel milk powder products
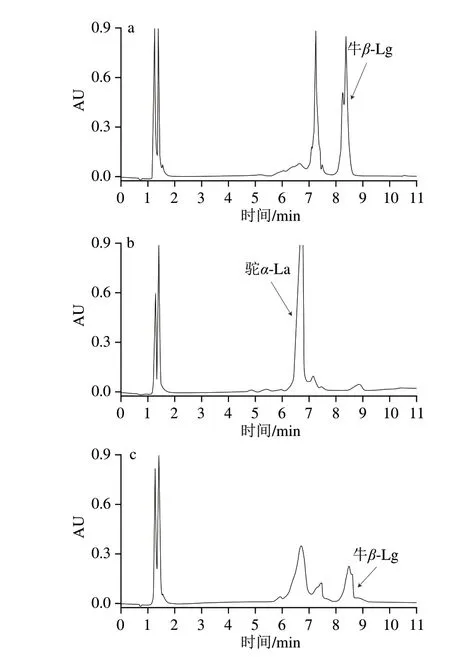
图6 市售驼乳粉样本色谱图Fig.6 Chromatograms of commercial camel milk powder samples
3 结论
基于乳清蛋白以牛β-Lg为掺假标识物,建立了定性定量检测驼乳中掺假牛乳的UPLC方法,并且探究热加工处理对掺假标识物的影响,结果表明该检测方法可应用于鲜驼乳、巴氏杀菌驼乳以及驼乳粉中掺假牛乳的检测。此外,利用该方法对10 种市售驼乳粉样本进行了检测,其中4 个样本检出了掺假牛乳,由检测结果可知,目前国内市场上存在驼乳粉掺假现象,建立掺假检测方法及相应标准势在必行。
无论使用哪种标识物(蛋白或DNA),进行乳的掺假水平定量时,都必须在不考虑标识物含量变化的前提下进行定量,这表示计算得出的掺假水平只能视为一种近似度量,但实际上对掺假水平进行精确定量的问题可以忽略不计,因为如果发生受经济利益驱动的掺假行为,必将以大量的水平存在(5%以及更多),较低的掺假百分比不会产生期望的经济意义[11,29],因此,考虑到实际情况,定量过程中的不精确性可以容忍。
此外,乳清蛋白的稳定性受到热处理强度的影响,使得该方法存在一定的局限性,因此需要继续探究热稳定性标识物,为今后驼乳掺假检测标准技术规程的建立提供实验依据。本实验室目前正在寻找热稳定性标识物,发现乳中的酪蛋白热稳定性非常好[33],并且牛乳的酪蛋白与驼乳相比存在差异,基于UPLC技术手段,有望实现全面检测驼乳及其乳制品中掺假的牛乳。

